肿瘤优势供血动脉及胃周血管移位征对胃源性外生型肿瘤定位诊断价值
黎佩君,王秋实,黄飚,龙晚生,兰勇,林伟星
胃周间隙有胰腺、脾、肝、肠管包绕,脏器之间解剖毗邻、间隙狭小。胃周间隙肿块较小时CT常能准确地显示肿块的来源。肿块较大时常与周围脏器界限不清[1]且常伴有瘤内坏死、囊变或不均匀强化等相似的CT表现,导致起源脏器判断偏差,影响正确诊断及术前手术方案的制定。本文旨在探讨CT上肿瘤优势供血动脉以及肿瘤与胃周血管的关系对胃源性外生型肿瘤的定位诊断价值。
材料与方法
1.病例资料
采用回顾性描述性研究方法。搜集2010年3月-2019年5月本院符合标准的患者。纳入标准:①经手术病理证实起源于胃或其周围器官组织的外生型肿瘤;②术前行CT增强检查,扫描范围包含肿瘤及邻近脏器整体;③肿瘤最大径>3 cm且CT显示肿瘤同时与胃及胃周至少一个组织脏器分界不清、脂肪间隙消失。单纯囊性肿块不纳入分析。73例患者共73个肿块纳入分析,其中胃起源肿瘤39例,胃周围器官组织起源肿瘤34例(表1)。

表1 73例肿块临床资料
2.CT检查
CT检查采用日本东芝Aquilion One-64或德国西门子Somatom Force扫描仪,行平扫及增强CT检查。检查前患者常规肠道准备。均取仰卧位,扫描范围从膈顶至腹主动脉分叉处。扫描参数:管电压120 kV,管电流采用自动毫安秒技术,探测器准直64×0.625 mm 或192×0.625 mm,螺距分别为0.656或0.7,矩阵512×512,重建层厚3 mm。经肘前静脉注入约80~100 mL对比剂(碘海醇,300 mg I/mL,1.5 mL/kg),注射流率3.5 mL/s。注射对比剂后分别延迟30、60 s行动脉期及静脉期扫描。
3.图像后处理及分析
由两名分别具有6年及11年腹部影像诊断经验的放射科医师根据轴面、冠状面、矢状面图像及MIP图像盲法独立阅片。意见分歧时经商量后达成一致。由一名医师测量肿瘤最大径及动静脉期肿瘤内实性成分CT值(肿瘤主体层面上避开血管ROI尽可能大)。记录术前血清癌胚抗原(CEA)、CA19-9水平。
胃周血管包含动脉弓和静脉弓,以及其分支及属支血管,动静脉伴行。肿瘤与胃周血管关系的判定:在肿瘤主体层面上①若病变边缘胃周血管走行自然,未见明显移位,记为“无移位”;②若病变与胃壁之间可见胃周血管且偏向胃壁侧移位,记为“内移位”;③若病变与胃壁之间未见胃周血管且病变边缘胃周血管偏离胃壁侧向外移位即血管弓被推离胃壁,记为“外移位”。
肿瘤优势供血动脉的判定:增强扫描动脉期示血管或其分支进入肿瘤内,若供血动脉只有1支,则该动脉为优势供血动脉,若供血动脉为多支,选择最粗的1支血管或以其瘤内分支所占区域最大者为优势供血动脉[2]。
4.统计学方法
统计数据用SPSS 22.0统计软件进行处理。连续变量采用独立样本t检验(正态分布)或Mann-WhitneyU检验(偏态分布),非连续变量采用χ2或Fisher确切概率法比较。二分类Logistic回归行单因素分析。采用Kappa检验评价两名医师观察结果的一致性。计算肿瘤优势供血动脉对胃源性肿瘤组与非胃肿瘤组定位诊断的灵敏度、特异度、阳性预测值、阴性预测值和诊断准确度。P<0.05为差异有统计学意义。
结 果
1.肿瘤的临床及基本CT特征
胃源性肿瘤组与非胃肿瘤组两组间肿瘤最大径、动脉期及静脉期肿瘤内实性成分CT值、术前血清CEA水平的差异均不具有统计学意义。胃源性肿瘤组术前血清CA19-9水平低于非胃肿瘤组且差异有统计学意义(表2)。
2.肿瘤与胃周血管的关系
2例胃周血管显示不清,2例胃周血管受侵犯,均不作分析。两名医师对肿瘤与胃周血管关系判定的一致性较好(Kappa值0.687)。肿瘤主体层面上69例中病变边缘胃周血管显示“无移位”17例,包括胃源性肿瘤8例,非胃肿瘤组9例;病变边缘胃周血管显示“内移位”22例,非胃肿瘤组(20/22)明显多于胃源性肿瘤组(2/22);病变边缘胃周血管显示“外移位”30例,胃源性肿瘤组(26/30)明显多于非胃肿瘤组(4/30)(图1~2)。两组肿瘤间胃周血管移位差异有统计学意义(表2)。Logistic单因素回归分析显示为“内移位”的多为非胃来源肿瘤(OR=8.89,95%CI:1.56~50.53),显示为“外移位”的多为胃来源肿瘤(OR=0.14,95%CI:0.03~0.57)。
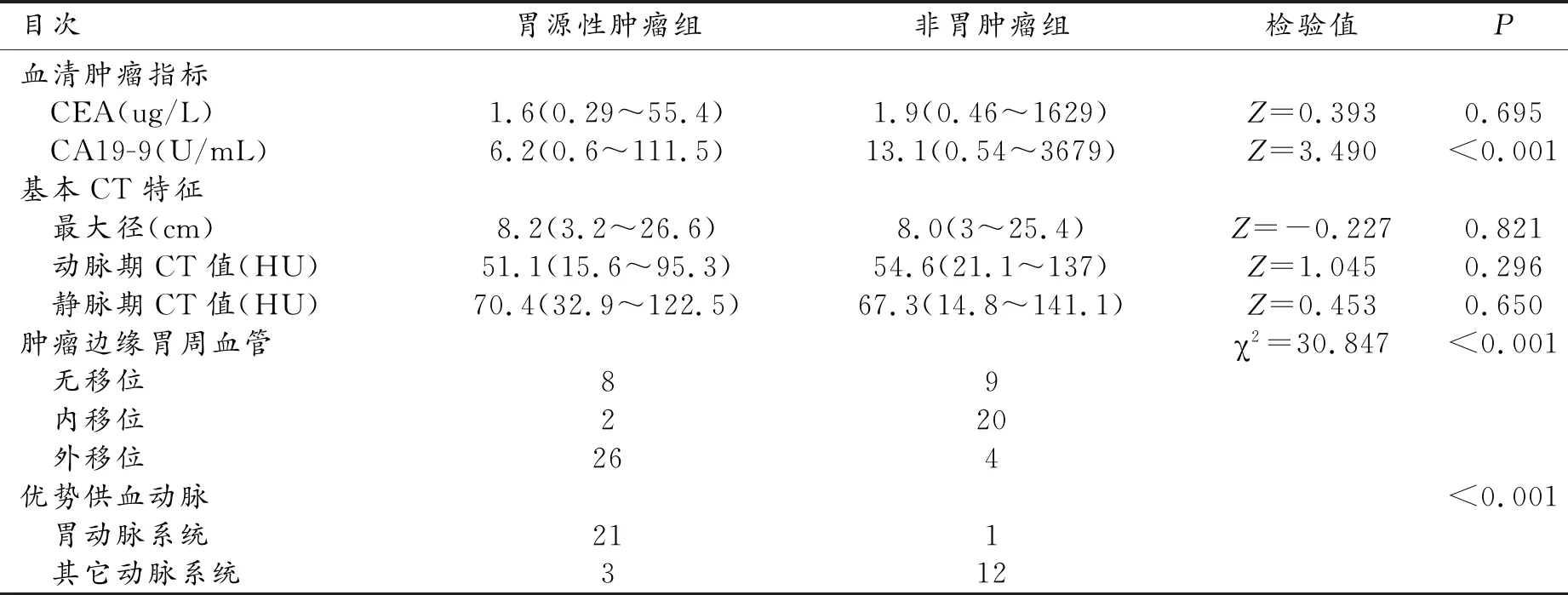
表2 胃源性肿瘤组与非胃肿瘤组临床及影像特征
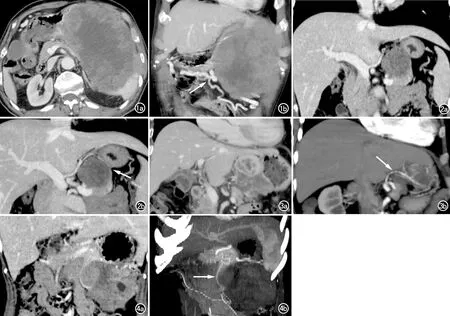
图1 男,84岁,胃来源胃肠间质瘤(高危险度)。a)轴面CT图示肿瘤与胃、胰腺均分界不清;b)冠状面MIP图示肿瘤边缘增粗的胃周血管(箭)被推离胃壁向外移位。 图2 女,32岁,胰腺实性假乳头状瘤。a)CT冠状面图示肿瘤位于胰腺与胃之间且分界不清;b)冠状面MIP图示肿瘤与胃壁之间胃周血管并偏向胃壁侧移位(箭)。 图3 女,76岁,胃来源胃肠间质瘤(高危险度)。a)CT冠状面图示肿瘤与胰腺、胃分界不清;b)斜冠状面MIP图示肿瘤血供来自胃左动脉且为优势供血动脉(箭)。 图4 女,31岁,胰腺实性假乳头状瘤。a)CT冠状面图示肿瘤位于胰腺与胃之间且分界不清;b)斜冠面MIP图示肿瘤血供来自胰上动脉且为优势供血动脉(箭)。
3.肿瘤优势供血动脉
两名医师对肿瘤优势供血动脉判定的一致性较好(Kappa值0.724)。41例(41/73)能够清楚显示肿瘤供血动脉及其起源,包括胃源性肿瘤组26例及非胃肿瘤组15例。
26例胃源性肿瘤中有23例肿瘤见胃动脉系统参与供血包括胃左动脉、胃右动脉、胃网膜左动脉、胃网膜右动脉、胃短动脉及胃后动脉,其中21例优势供血动脉属于胃动脉系统(图3)。1例存在胃网膜左动脉及肠系膜上动脉分支共同供血,1例存在胃网膜左动脉、胰尾动脉、膈下动脉共同供血,但均未能识别出优势供血动脉。3例胃源性肿瘤未见胃动脉系统参与供血,其中2例由胰尾动脉供血,1例由脾动脉小分支供血且均为优势供血动脉。
15例非胃肿瘤中有11例由脾动脉胰腺分支供血(图4),1例由膈下动脉供血,1例由胃左动脉供血且均为优势供血动脉。1例由肠系膜下动脉分支和胰大动脉共同供血,1例由肠系膜上动脉分支、胰上动脉、胃网膜右动脉共同供血,但均未能识别出优势供血动脉。把除胃动脉系统的供血动脉归为其它动脉系统。胃源性肿瘤组优势供血动脉多来源于胃动脉系统(OR=84,95%CI:7.84~900.12),而非胃肿瘤组优势供血动脉多来源于其它动脉系统且差异有统计学意义(表2)。
肿瘤优势供血动脉对胃源性肿瘤组诊断的灵敏度、特异度、阳性预测值、阴性预测值和诊断准确度分别为80.8%、92.3%、95.5%、70.6%、80.5%,对非胃肿瘤组诊断的上述效能分别为80.0%、87.5%、80.0%、80.0%、80.5%。
讨 论
CT是临床上排查腹部病变的常用检查方法[3-4]。来源于胃的外生型肿瘤较大时常导致肿块-脏器交界面过多[5]造成CT判断起源器官困难,影响正确诊断、术前风险评估及手术方式。常规增强CT图像能够清楚显示血管与软组织结构间的关系[6-7]。有学者通过CT图像显示网膜囊区肿块与胃小弯侧胃周血管(含动静脉及其分支)的关系[8]帮助诊断胃来源肿块。本研究分析胃小弯侧肿块与胃周血管的关系得到类似结果,并且发现了胃大弯侧肿块与胃周血管间的关系也能帮助判断来源。Ping等[9]在一组胃周肿块研究中发现胃源性肿块见“血管移位征”即病变处胃动脉弓向外移位的表现,本研究发现了包含动静脉弓的胃周血管被推离胃壁、或在肿块边缘绕行;胃邻近组织起源肿块,病变与胃壁之间见胃周血管或可出现胃周血管被推压向胃壁侧移位[8]。本研究发现当胃壁受肿块压迫出现充血、淤血,胃周血管增粗时更易于显示。值得注意的是本研究还发现若肿块位于胃周血管远端分支胃壁且相对较小时,由于病变边缘胃周血管细小可能显示不清而邻近血管弓移位又不显著,此时对鉴别肿块来源帮助较小,既往研究未见提及。
肿瘤内可存在多支异位供血动脉,但主要由源器官动脉供血[11]。有学者通过CT无创性显示肿瘤供血动脉鉴别胃肠间质瘤与其它组织来源的肿块[2,10]。然而,通过CT鉴别胃周间隙外生型肿瘤中胃来源肿瘤的价值尚不清楚。本文纳入研究的胃源性肿瘤中大部分肿块(88.5%)有胃动脉系统供血且为优势供血动脉(80.8%);而非胃肿瘤中仅有少数肿块(13.3%)有胃动脉系统参与供血,成为优势供血动脉者更少(6.7%)。由此,通过CT显示肿瘤优势供血动脉,可帮助胃源性外生型肿瘤的起源定位。
此外,本研究发现非胃肿瘤组术前血清CA19-9水平高于胃源性肿瘤组。推测原因可能为本文纳入研究的非胃肿瘤组中大部分为胰腺来源肿瘤(25/34),而CA19-9是胰腺疾患尤其是胰腺癌敏感性最高的血清标志物[12-14]。因此,在鉴别胃周间隙肿物的来源时高水平CA19-9可作为胰腺来源肿物的参考依据。
本研究存在局限性:第一,本研究旨在解决临床中的定位诊断问题,对肿瘤大小、肿瘤-脏器交界面都作规定,纳入标准较为严格,因而样本量较少;第二,肿块侵犯或包绕胃周血管时不能准确评价胃周血管移位。
综上所述,通过MSCT显示肿瘤优势供血动脉及肿瘤与胃周血管的关系,2种方法相互结合可辅助胃源性外生型肿瘤的定位诊断。

