LncRNA MEG8影响结肠癌细胞恶性进展
徐王彦,刘忠臣
(1.安徽理工大学医学院,安徽 淮南 232001;2.同济大学附属第十人民医院胃肠外科,上海 200072)
结直肠癌是世界上第三种最常见的癌症,占人类癌症相关死亡人数的1/10。由于其发展迅速且隐蔽,每年新增结肠癌人数超过12万,死亡率超过33%。尽管诊断和治疗策略不断进步,但结肠癌患者的预后在过去十年间未发生显著变化。目前只有少数生物标记物可用于结肠癌的预防,因此,鉴定早期诊断结肠癌的分子标志物具有重要意义。
长非编码RNA(LncRNA)是长度超过200nt但没有蛋白质编码能力的RNA分子。LncRNA可以作为肿瘤中的癌基因或抑癌基因,参与肿瘤增殖、转移、自噬和凋亡等调控。多种lncRNA异常与结肠癌进展密切相关。据报道,与正常结肠组织相比,母系表达基因8(matemally expressed gene 8,MEG8)在结肠癌组织中表达下调,但其参与结肠癌发病的潜在机制尚不清楚。MicroRNA(miRNAs)是一类约22个核苷酸的非编码小RNA,其失调与多种生物学过程,包括细胞增殖,分化和凋亡相关。前人研究表明,miR-1827在结肠癌组织中上调,但其对结肠癌细胞增殖、侵袭及凋亡的作用还有待探究。
本研究主要探讨lncRNA MEG8对结肠癌细胞增殖、侵袭和凋亡的影响,并阐明其涉及的主要分子机制。
1 材料方法
(1)细胞与试剂 NCM460、HT29、CACO2、SW480、HCT116、HEK293T细胞均购自上海生命科学研究院;Magna RIP试剂盒购自美国Millipore公司;NC siRNA、MEG8 siRNA、miR-1827mimic、NC mimic、miR-1827 inhibitor、NC inhibitor均由上海吉玛公司合成;细胞凋亡试剂盒购自中国上海联科生物公司;CCK-8试剂盒购自美国Abcam公司;TRIzol试剂盒购自美国Invitrogen公司;反转录和RT-qPCR试剂盒购自中国大连Takara公司; 总的和磷酸化的细胞外调节蛋白激酶1/2(t-ERK1/2 和p-ERK1/2)、 总的和磷酸化的c-Jun氨基末端激酶(t-JNK和p-JNK)抗体购自美国CST公司;流式细胞仪和酶标仪购自德国Thermo Fisher和美国Bio-Rad公司;凝胶成像仪和CO细胞恒温培养箱购自美国CARESTREAM Gel Logic和德国Thermo scientific公司。
(2)细胞培养和转染 将NCM460、HT29、CACO、SW480、HCT116、HEK293T细胞置于含10% 胎牛血清的DMEM培养基中,并于37℃,含5% CO的恒温培养箱中培养。将细胞接种于6孔板,待密度达到60%,使用Lipofectamine3000转染试剂按照说明书进行转染。
(3) RNA免疫沉淀反应(RNA Immunoprecipitation,RIP) 将HT29细胞裂解液与包含磁珠(磁珠与anti-Ago2或IgG的抗体偶联)的RIP缓冲液在4℃下孵育过夜。用蛋白酶K消化免疫沉淀物以纯化沉淀的RNA,再用qPCR分析免疫沉淀的RNA。
(4)双荧光素酶报告基因试验 使用StarBase v2.0预测MEG8与miR-1827的结合位点。使用psiCHECK-2载体构建野生型和突变型psiCHECK-2-MEG8(MEG8-Wt、MEG8-Mut)载体。将HEK293T细胞接种于24孔板,并将MEG8-Wt(或MEG8-Mut)分别与miR-1827mimic或NC mimic共转染。24h后,按照说明书的操作检测荧光素酶活性。
(5)细胞凋亡 使用Annexin V-FITC /碘化丙啶(PI)凋亡检测试剂盒进行凋亡分析。简言之,细胞处理完成后收集细胞,用PBS洗涤并重悬细胞,随后依次添加5μLAnnexin V-FITC和5μLPI。使用流式细胞仪检测细胞凋亡。
(6)细胞增殖 将处理后的细胞接种于96孔板,并分别培养24、48或72h。在每个时间点添加10μL CCK-8溶液,并将细胞继续孵育2h。使用酶标仪测量450nm处的吸光度值。
(7)细胞侵袭 将人工基底膜涂于Transwell室底膜上腔表面,并置于37℃放置30min。将细胞(2×10个)悬浮于500μL无血清培养基中,并添加到上腔室中。在下腔室中添加含10%胎牛血清的RPMI-1640培养基。温育36h后,将下腔室中的细胞用4%多聚甲醛固定并用结晶紫染色。选择5个随机区域计算侵袭细胞数量并计算平均值。
(8)Western blotting 使用RIPA裂解液提取细胞总蛋白质,使用BCA试剂盒测量蛋白质浓度。通过10%SDS-PAGE分离蛋白质样品,然后电转至PVDF膜。将膜在室温用5%脱脂奶粉封闭2h后,与稀释后的一抗在4℃孵育过夜。随后将膜与辣根过氧化物酶标记的二抗在室温孵育1h。在ChemiDoc XRS成像系统中检测蛋白质条带。使用Image J软件进行条带灰度分析。
(9)实时荧光定量PCR(Real Time-Quantitative PCR,RT-qPCR) 采用TRIzol提取细胞总RNA,进行反转录。使用SYBR PrimeScript RT-PCR试剂盒检测mRNA表达。反应条件设计如下:95℃,3min,进行35个循环,94℃,15s;55℃,25s;72℃,30s。mRNA相对表达通过2方法计算。
(10)统计学分析 采用SPSS 22.0软件进行统计分析。测量的数据表示为均数±标准差,组间数据比较采用学生t检验和双向方差分析。P
<0.05视为差异有统计学意义。2 结果
(1)过表达MEG8抑制HT29细胞恶性进展。如图1所示。与人正常肠上皮细胞(NCM460)相比,结肠癌细胞系(HT29,CACO2,SW480,HCT116)中MEG8表达显著下调(P
<0.05),如图1(a)所示。与转染Vector相比,在HT29细胞中转染Ad-MEG8后,MEG8的表达显著上调(P
<0.01),如图1(b)所示,显示过表达效率较高。与Vector组相比,过表达MEG8后细胞增殖和侵袭显著下降(P
<0.05), 如图1(c)~(e)所示,而细胞凋亡显著上升(P
<0.05), 如图1(f)~(g)所示。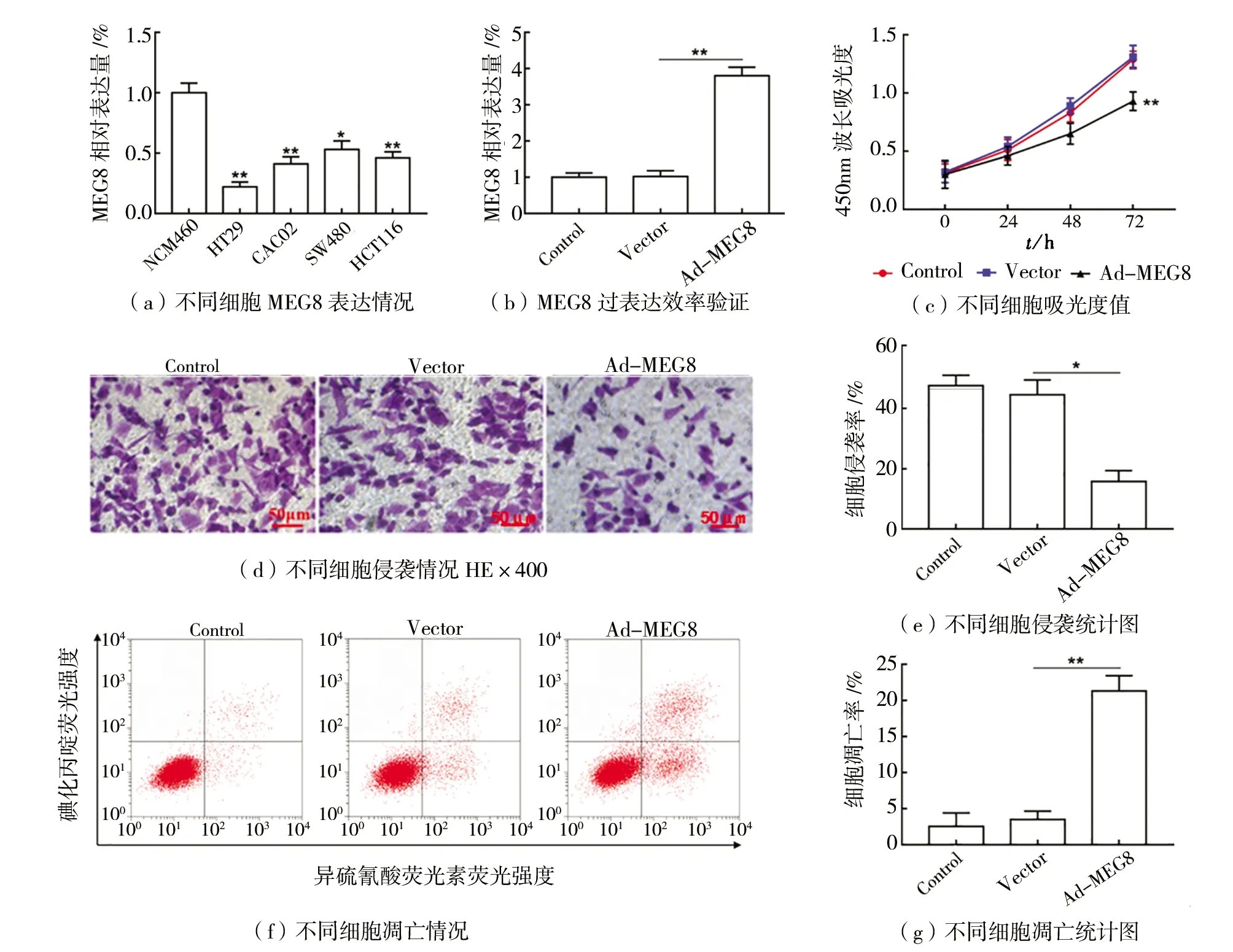
图1 过表达MEG8抑制HT29细胞恶性进展
(2)MEG8与miR-1827结合并下调其表达如图2所示。 与转染NC mimic相比,转染miR- 1827mimic后,MEG8-Wt报告载体荧光素酶活性显著下降(P
<0.05),如图1(b)所示,而MEG8-Mut报告载体荧光素酶活性无显著变化。RIP实验结果显示,分别过表达miR-1827和MEG8后,与IgG抗体组相比,Ago2抗体组的MEG8和miR-1827显著富集(P
<0.05),如图1(c)所示。与转染Vector相比,在HT29细胞中转染Ad-MEG8显著抑制miR-1827表达(P
<0.05),如图1(d)所示。而与转染NC siRNA相比,转染MEG8 siRNA显著促进miR-1827表达(P
<0.05),如图1(d)所示。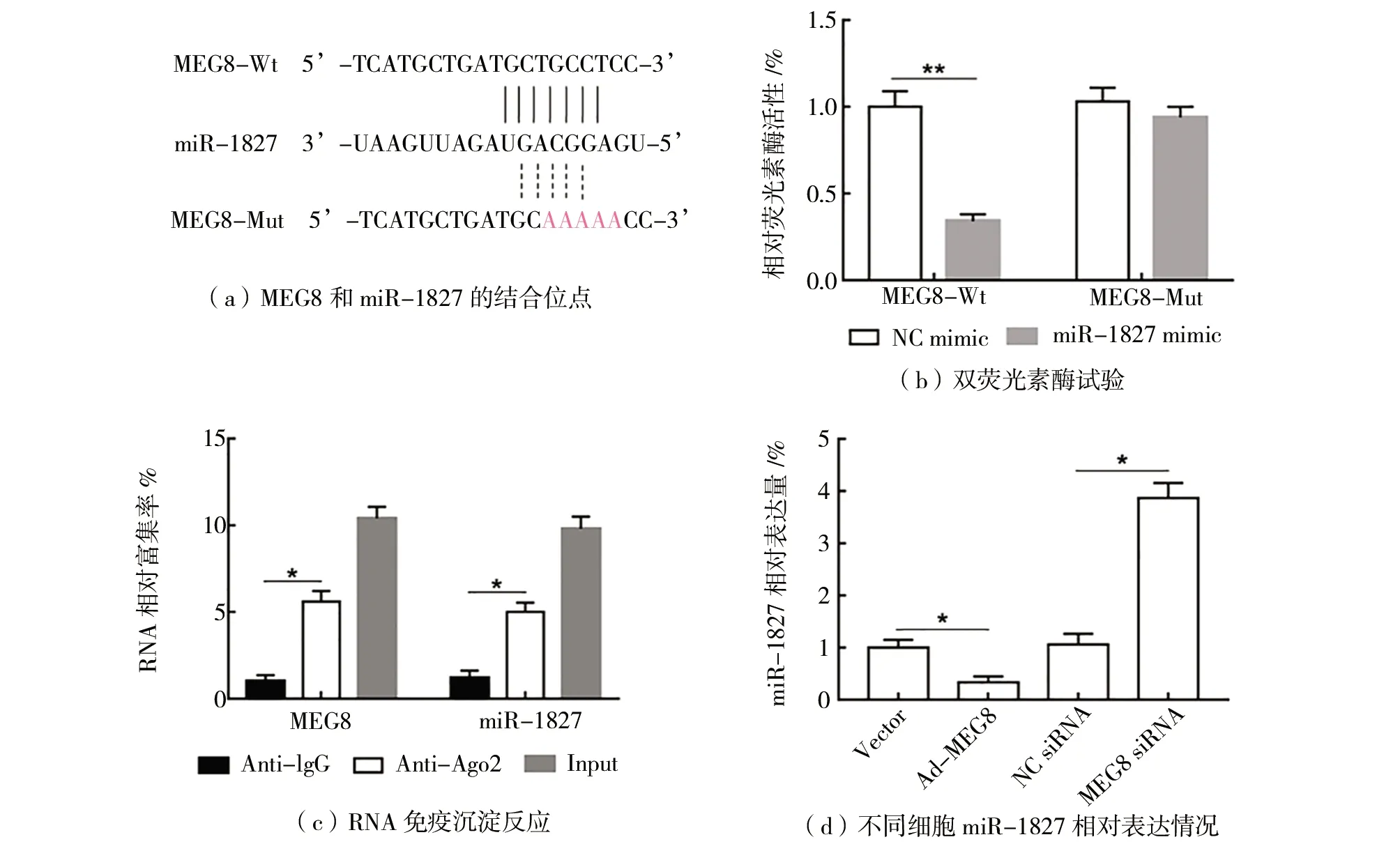
图2 MEG8与miR-1827结合并负调控其表达
(3)干扰miR-1827抑制HT29细胞恶性进展如图3所示。与人正常肠上皮细胞(NCM460)相比,结肠癌细胞系(HT29,CACO2,SW480,HCT116)中miR-1827表达显著上调(P
<0.05),如图3(a)所示。与转染NC inhibitor相比,在HT29细胞中转染miR-1827 inhibitor显著抑制miR-1827表达(P
<0.05),如图3(b)所示,显示干扰效率较高。与NC inhibitor组相比,干扰miR-1827组的细胞增殖和侵袭显著下降(P
<0.05),如图3(c)~(e)所示,而细胞凋亡显著上升(P
<0.05),如图3(f)~(g)所示。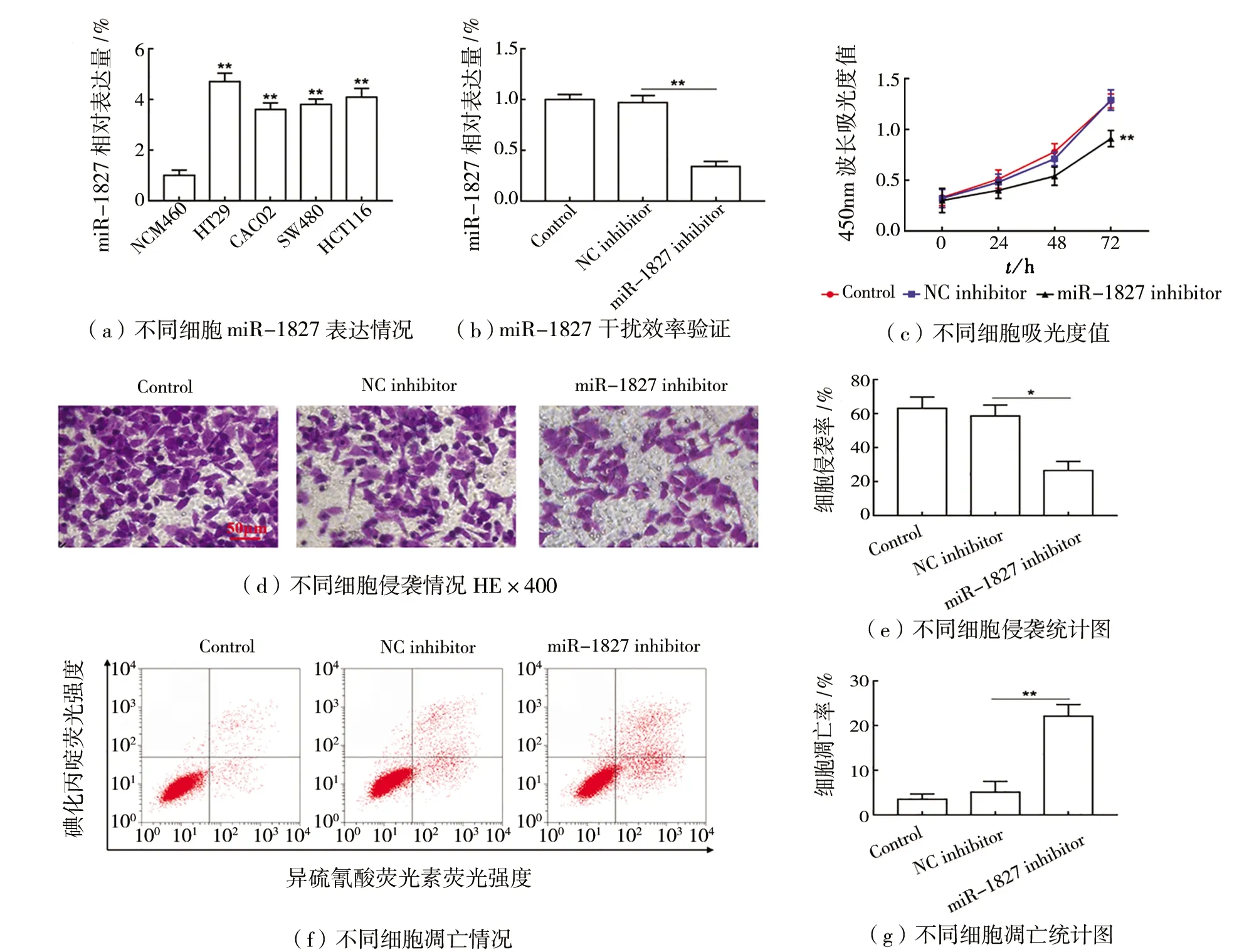
图3 干扰miR-1827抑制HT29细胞恶性进展
(4)MEG8通过抑制miR-1827调控HT29细胞进展如图4所示。与转染NC siRNA相比,在HT29细胞中转染MEG8 siRNA显著促进细胞增殖和侵袭(P
<0.05),如图4(a)~(c)所示,抑制凋亡(P
<0.05),如图4(d)~(e)所示。而与转染MEG8 siRNA+NC inhibitor相比,共转染MEG8 siRNA和miR-1827 inhibitor,细胞增殖和侵袭显著下降(P
<0.05),如图4(a)~(c)所示,而凋亡显著上升(P
<0.05),如图4(d)~(e)所示。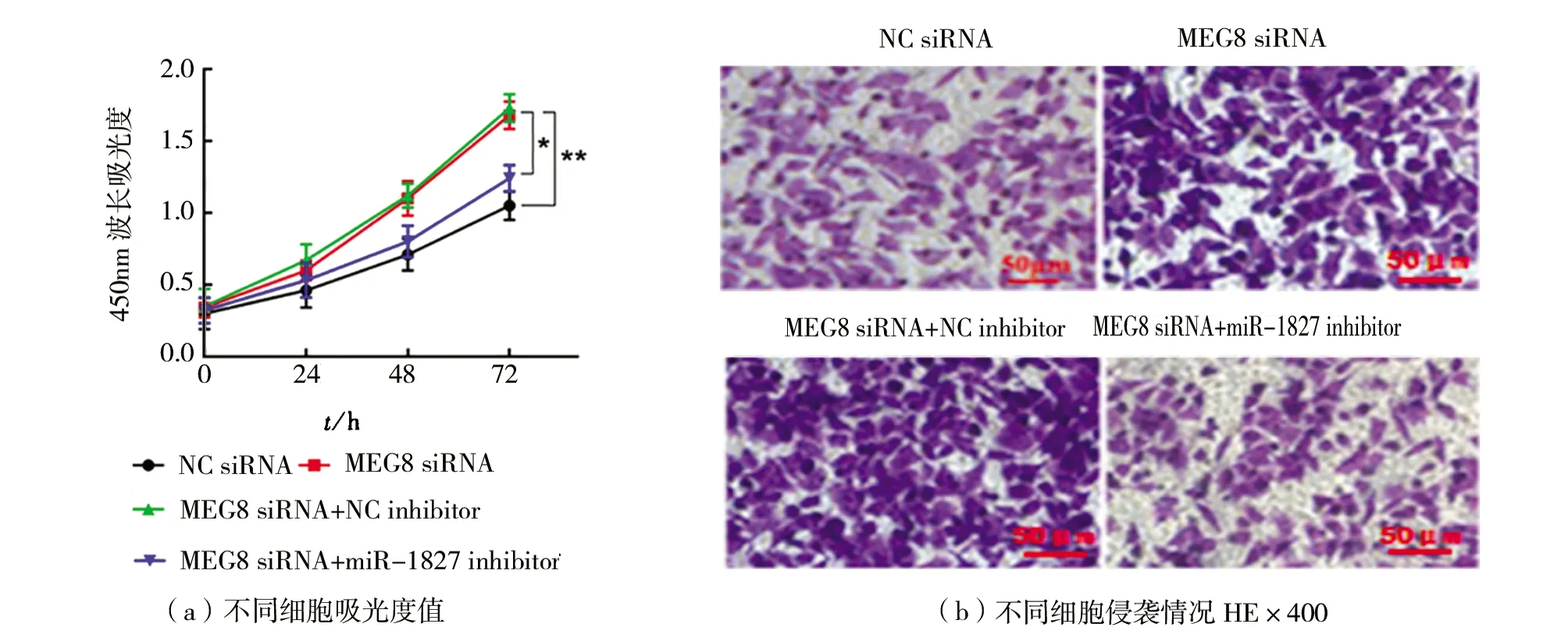
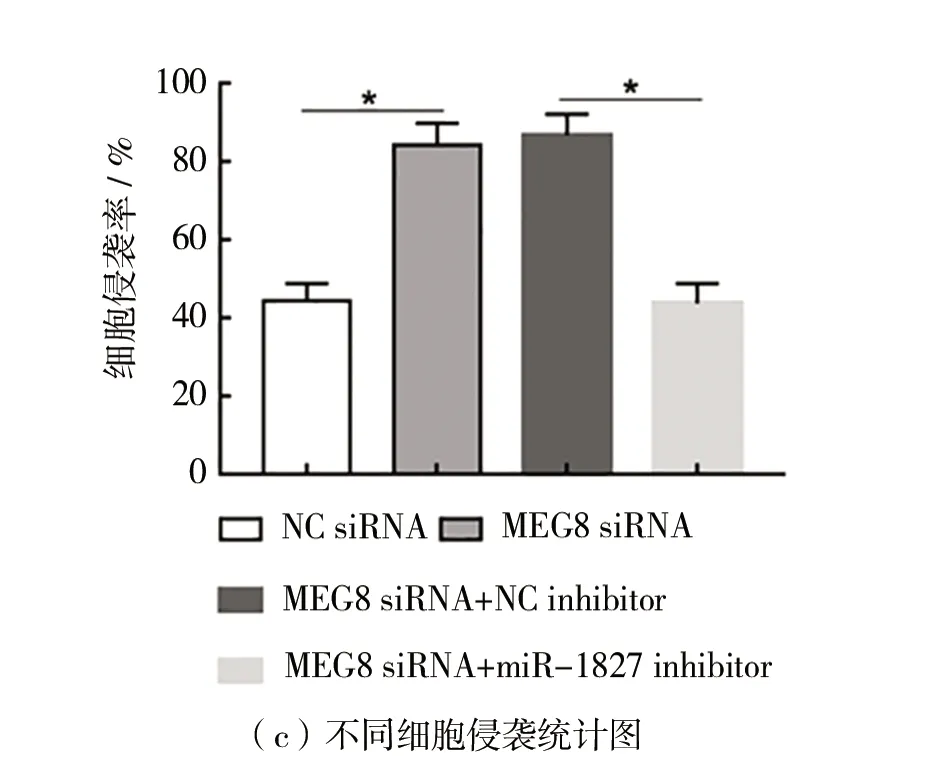
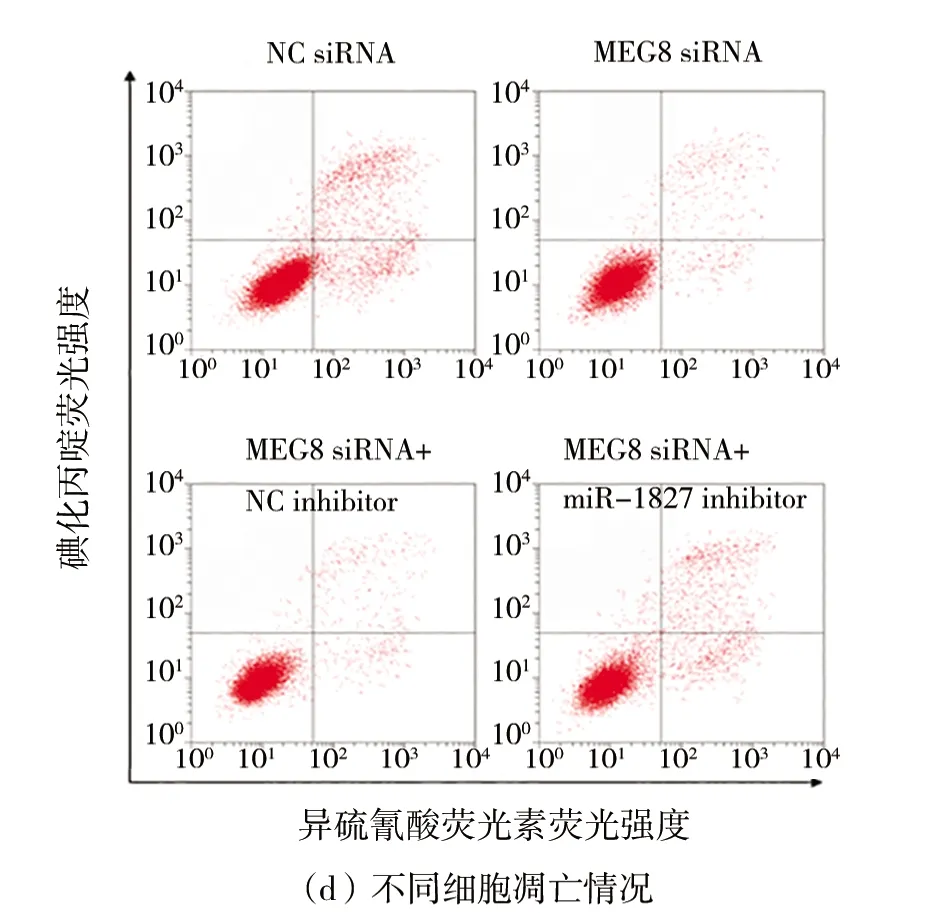
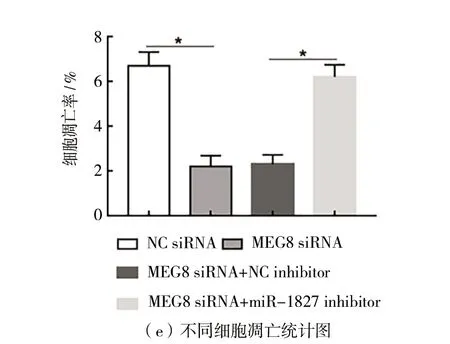
图4 MEG8通过抑制miR-1827调节HT29细胞进展
(5)MEG8通过抑制miR-1827调节ERK/JNK通路活性如图5所示。与转染NC siRNA相比,在HT29细胞中转染MEG8 siRNA显著抑制p-ERK1/2和p-JNK的蛋白质表达(P
<0.05),如图5(a)~(c)所示,而t-ERK1/2和t-JNK的蛋白质表达不变。与转染MEG8 siRNA+NC inhibitor相比,共转染MEG8 siRNA和miR1827 inhibitor,p-ERK1/2和p-JNK蛋白质表达显著上升(P
<0.05),如图5(a)~(c)所示,而t-ERK1/2和t-JNK的蛋白质表达不变。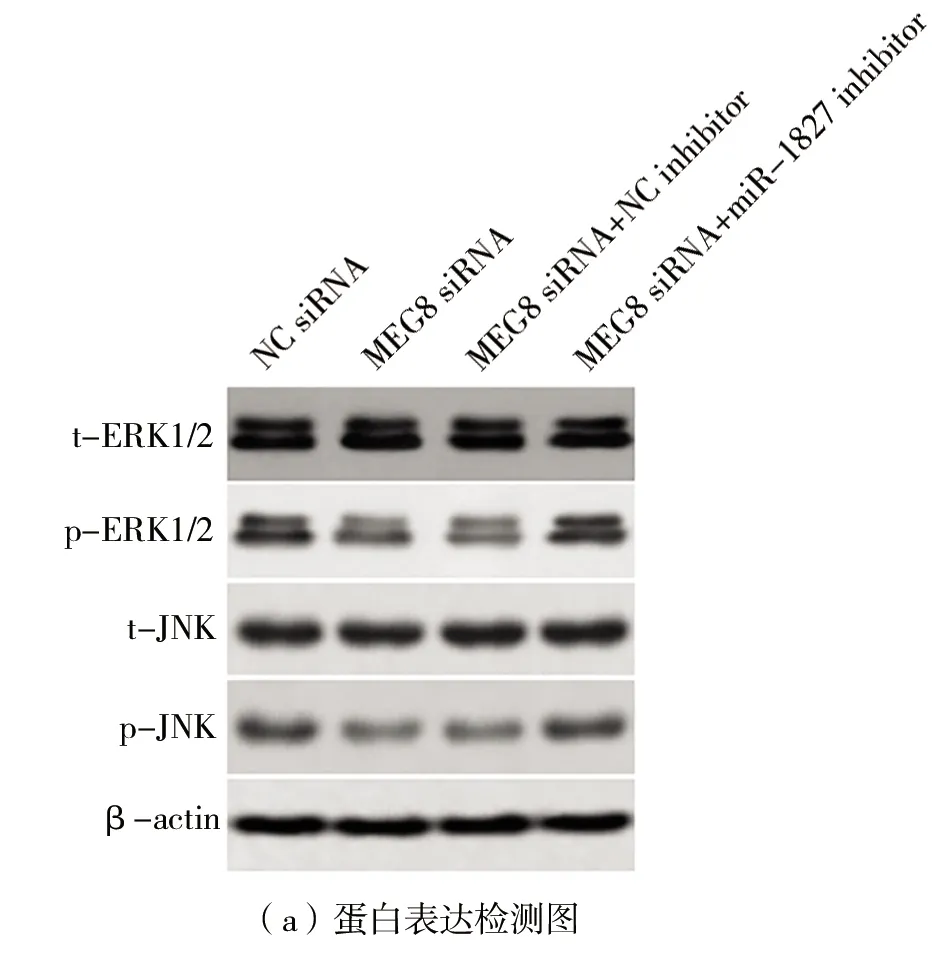
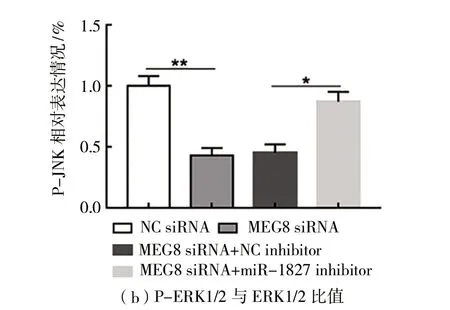
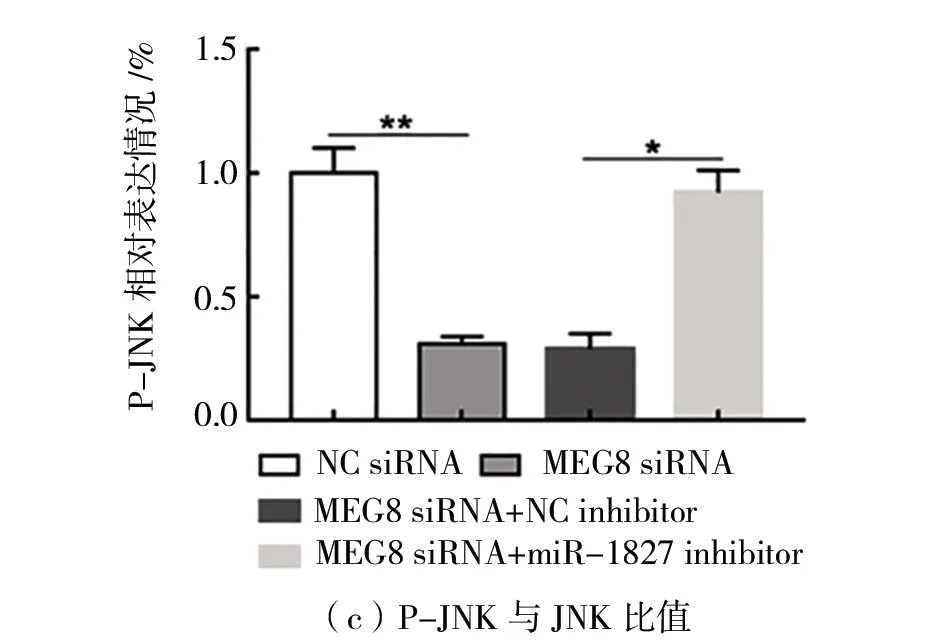
图5 MEG8通过抑制miR-1827调节ERK/JNK通路活性
3 讨论
结肠癌是一种常见的消化系统癌症,在全球与癌症相关死亡中排名第四。癌细胞的无限增殖和高转移特性导致结肠癌的高死亡率。在2014a和2015a,结肠癌导致约70万人死亡。结肠癌的早期治疗结果通常令人满意,并且大于95%的患者在积极治疗后生存率超过5a。然而,由于其隐蔽和发展迅速的特征,大多数患者在首次诊断时就处于晚期,导致多数患者生存结果较差。结肠癌发生是一个复杂过程,包括遗传和表观遗传学变化。因此,阐明肿瘤发生的分子机制,为早期诊断,预后和治疗评估寻找新的分子标志物意义重大。
LncRNA通过多种机制介导基因表达,包括lncRNA-miRNA相互作用,lncRNA-蛋白质相互作用和lncRNA-mRNA相互作用。前人研究表明,lncRNAs参与各种生物过程调控,包括细胞增殖、侵袭、转移、癌变和癌症进展。多种lncRNA失调与结肠癌进展相关。LncRNA BCAR4通过激活Wnt/β-catenin信号传导途径促进结肠癌肿瘤生长和转移。LncRNA HOTAIR在结肠癌中表达上调,与结肠癌远端转移和不良预后有关。LncRNA MALAT1通过海绵miR-129-5p调控HMGB1促进结肠癌发展。本研究表明,与人正常肠上皮细胞相比,MEG8在结肠癌细胞中表达下调,与文献报道一致。过表达MEG8显著抑制结肠癌细胞系HT29增殖和侵袭,促进凋亡,显示MEG8在结肠癌中作为肿瘤抑制基因,可能作为结肠癌的预测指标。研究还发现,MEG8与miR-1827直接结合,负调控miR-1827的表达,表明MEG8可能通过抑制miR-1827发挥肿瘤抑制作用。
MiRNA通过与mRNAs的3’非翻译区结合,在基因表达中发挥转录后调控作用,导致翻译抑制或基因沉默。MiRNA基因只代表人类基因组一小部分,但它们调控几乎1/3的人类基因。研究表明,miRNAs与多种生理病理过程相关, 包括细胞分化、 凋亡、 增殖、 胰岛素分泌、 胆固醇合成和肿瘤生成。MiRNAs与结肠癌进展紧密相关。MiR-144通过下调SMAD4抑制结肠癌生长和转移;MiR-192在结肠癌中发挥抑癌作用,辛伐他汀通过激活miR-192抑制癌细胞生长;MiR-215抑制低氧诱导的结肠癌干细胞活性。文献[16]报道,MiR-1827通过靶向MYC在肺腺癌中发挥抑癌作用。文献[6]报道,miR-1827通过调控Wnt信号通路,在结肠癌中发挥致癌作用。本研究结果显示,与人正常肠上皮细胞相比,miR-1827在结肠癌细胞中表达上调,与前人研究结果吻合。在HT29细胞中干扰miR-1827,细胞增殖和侵袭下降,而凋亡上升。此外,转染miR-1827 inhibitor逆转沉默MEG8诱导的细胞增殖和侵袭上调,凋亡下降。
越来越多证据表明,ERK/JNK信号通路在结肠癌细胞进展中发挥重要作用。据报道,ERK-JNK信号通路上调通过CC趋化因子配体7和CC趋化因子受体3之间的串扰促进结肠癌细胞转移。衣霉素通过下调ERK-JNK信号通路抑制结肠癌细胞生长和转移。Mahalingam等人证明,在结肠癌中,舒尼替尼通过增强JNK活性,降低凋亡抑制蛋白质水平,促进TRAIL介导的凋亡。本研究数据显示,干扰MEG8显著抑制HT29细胞中p-ERK1/2、p-JNK蛋白质水平。而干扰miR-1827反转MEG8对ERK/JNK通路的作用,表明MEG8和miR-1827对HT29细胞增殖和凋亡的影响很可能通过调控ERK/JNK通路实现。
综上所述,与正常肠上皮细胞相比,MEG8在结肠癌细胞中表达下调,过表达 MEG8抑制HT29细胞增殖和侵袭,促进凋亡。机制研究显示,MEG8可能通过负调控miR-1827,激活ERK/JNK通路,进而调控HT29结肠癌细胞增殖、侵袭和凋亡。此项研究,一定程度上补充了影响结肠癌细胞增殖、侵袭和凋亡的免疫学理论,也为结肠癌免疫治疗方面提供一条潜在的方法。

