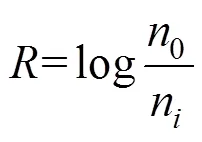氯消毒对产ESBLs菌β-内酰胺酶类抗性基因接合转移的抑制作用
张崇淼,牛治瑶,王 真,李永强,梁 杰
氯消毒对产ESBLs菌β-内酰胺酶类抗性基因接合转移的抑制作用
张崇淼*,牛治瑶,王 真,李永强,梁 杰
(西安建筑科技大学环境与市政工程学院,西北水资源与环境生态教育部重点实验室,陕西省环境工程重点实验室,陕西 西安 710055)
以产超广谱β-内酰胺酶(ESBLs)的大肠杆菌T413和NK5449分别作为供体菌和受体菌进行接合试验,研究氯消毒处理供体菌对β-内酰胺酶类抗性基因接合转移的抑制作用.结果表明,供体菌质粒上的CTX-M和TEM基因可接合转移至受体菌,接合转移频率为6.57×10-2.当氯消毒接触时间为30min,有效氯浓度在0.25~1.5mg/L时,接合转移频率未出现数量级的降低,而有效氯浓度为2mg/L时,接合转移频率则骤降至2.02×10-5.在值为60 (mg·min)/L的各种组合中,4mg/L×15min对接合转移的抑制效果最佳.氯消毒后的供体菌数量与接合转移频率呈正相关.经高剂量氯消毒后的供体菌具有较高的再生长率,但接合转移频率却很低.高剂量氯消毒会损伤供体菌菌体结构和功能,使胞外分泌物减少,阻碍质粒传递.
氯消毒;超广谱β-内酰胺酶;β-内酰胺酶类抗性基因;质粒介导;接合转移
超广谱β-内酰胺酶(ESBLs)是指一类能水解青霉素类、头孢菌素类和单环β-内酰胺类抗生素的酶.产ESBLs菌的出现使很多抗生素失去了疗效,给人类健康造成了巨大的威胁[1-2].大量研究表明,产ESBLs菌已不仅仅局限于医院内,在污水[3-5]、河流[6]、湖泊[7]等多种水环境中都发现了它们的踪迹.随着污水再生利用的日益广泛,城市地表水环境可能成为耐药菌和耐药基因的“汇”和“源”[8-9],产ESBLs菌的介水传播是社会公众不得不面对的严峻问题.
根据ESBLs的编码基因,可以将ESBLs分为TEM族、SHV族、CTX-M族和OXA族[10].随着研究的深入,一些不属于上述任何家族的新型ESBLs(例如VEB、PER、GES等)也逐渐被发现[11-12].这些β-内酰胺酶基因位于产ESBLs菌的质粒上[13],很容易在同种或异种细菌之间发生水平转移(HGT).通过供体菌和受体菌的接合,则是耐药基因主要的水平转移方式[14-15].
氯消毒对微生物杀灭作用快、持久性强,是应用最普遍的污水消毒技术之一[16].然而,近年来多项研究都对氯消毒消除耐药菌和耐药基因的能力提出了质疑.研究发现城市污水处理厂氯消毒出水中的多重耐药性沙门氏菌的比例显著升高[17];氯消毒后的污水中胞外耐药基因丰度提高了3.8倍,胞内耐药基因丰度提高了7.8倍[18];铜绿假单胞菌暴露于4mg/L的次氯酸钠后对头孢他啶、氯霉素、氨苄西林的耐药性提高1.4~5.6倍[19].氯消毒能有效杀灭大部分细菌,但并不能完全降解耐药基因,反而可能造成细菌体内耐药基因的释放.从控制细菌耐药性传播的角度上看,抑制耐药基因水平转移比单纯考虑灭活耐药菌更有意义.然而,迄今为止这方面鲜有研究报道.氯消毒究竟对耐药基因水平转移产生何种影响尚不明确.
鉴于此,本文利用从城市地表水中分离出的一株产ESBLs大肠杆菌作为对象,通过研究经过不同氯消毒处理后的供体菌,其耐药基因的接合转移频率的变化,以及接合子的性状分析,来揭示氯处理对产ESBLs菌的β内酰胺酶类基因接合转移的影响,为控制抗生素抗性传播提供科学依据.
1 材料与方法
1.1 供体菌和受体菌的选择与培养
使用1株分离自城市地表水体的大肠杆菌T413作为供体菌,经双纸片协同试验鉴定为产ESBLs菌,含质粒,对头孢噻肟耐药.使用大肠杆菌NK5449作为受体菌,该菌无质粒,对萘啶酸和利福平耐药.分别使用含有4μg/mL头孢噻肟的LB液体培养基,含有100μg/mL萘啶酸和300μg/mL利福平的LB液体培养基培养供体菌和受体菌.在37℃, 150r/min过夜培养,使细菌浓度达到约109CFU/ mL.4000r/min离心6min,用PBS缓冲液重悬沉淀,稀释至108CFU/mL,备用.
1.2 接合实验
取受体菌悬液1mL,4000r/min离心6min,得到菌体沉淀.用1mL LB液体培养基重悬受体菌沉淀,并与同样方法制得的供体菌沉淀混合,充分混匀,置于37℃培养箱中接合24h.
将混合菌液进行梯度稀释,分别取100μL涂布于受体菌筛选平板(含有100μg/mL萘啶酸和300μg/mL利福平的营养琼脂平板)和接合子筛选平板(含有4μg/mL头孢噻肟、100μg/mL萘啶酸和300μg/mL利福平的营养琼脂平板),37℃倒置培养24h后分别计数受体菌和接合子的数量.按式(1)计算接合转移频率().
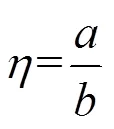
式中:为混合菌液中接合子的数量,CFU/mL;为混合菌液中受菌体的数量,CFU/mL.
1.3 耐药表型及耐药基因的检测
使用K-B纸片扩散法分别对供体菌,受体菌以及接合子进行药敏试验,准确测量氨苄西林(AMP,10μg/片)、四环素(TET,30μg/片)、磺胺甲恶唑(SMZ,300μg/片)、环丙沙星(CIP,5μg/片)和头孢噻肟(CTX,30μg/片)所产生的抑菌环直径,以大肠杆菌ATCC 25922作为质控菌株,根据美国临床和实验室标准协会(CLSI)标准[20]进行耐药性判定.

表1 β-内酰胺酶类抗性基因和I型整合子的引物序列及扩增产物长度
使用质粒提取试剂盒(Spin Columns,TIANGEN)分别提取供体菌及接合子质粒,利用PCR测定5种主要的β-内酰胺酶类抗性基因(CTX-M、TEM、SHV、VEB、GES)和I型整合子整合酶基因(I1),所使用的引物如表1所示.PCR反应体系为:10´buffer(Mg2+)2.5μL,dNTPs(10mmol/L)2.0μL,10mmol/L上下游引物各1.0μL,5UTaq mix 0.2μL, ddH2O 16.3μL,模板2μL.β-内酰胺酶类抗性基因PCR扩增条件为:94℃预变性5min,95℃变性30s, 52℃退火45s,72℃延伸1min,35个循环;72℃延伸10min.I型整合子PCR扩增条件为: 94℃预变性3min,94℃变性30s,57℃退火30s,72℃延伸30s,44个循环;72℃延伸5min.
取5μL PCR产物在110V电压、1.5%琼脂糖凝胶浓度条件下进行核酸水平电泳.使用凝胶成像仪(GelDocXR+,Bio-Rad)拍照记录电泳结果,确定特异性扩增片段.
1.4 氯消毒实验
取30mL供体菌悬液置于无菌的血清瓶中,使用300r/min的磁力搅拌保证菌悬液始终均匀.加入一定量的次氯酸钠溶液,使有效氯终浓度分别为0.25mg/L, 0.5mg/L, 0.75mg/L, 1mg/L, 1.5mg/L, 2mg/L, 2.5mg/L, 5mg/L, 10mg/L,接触反应30min后,加入过量的1.5%硫代硫酸钠溶液终止反应.不投加次氯酸钠溶液的样品作为空白对照(有效氯终浓度为0).
保持有效氯浓度()和接触时间()的乘积(值)为60(mg·min)/L,分别在1mg/L×60min,1.5mg/L× 40min,2mg/L×30min,3mg/L×20min,4mg/L×15min,6mg/L×10min等组合方式下处理供体菌悬液.
分别取上述不同条件处理后的供体菌悬液1mL进行接合实验,计算接合转移频率.
将使用氯消毒处理后供体菌与未经氯消毒处理后的供体菌分别进行接合实验,比较接合转移频率.按式(2)计算氯消毒对接合转移频率的对数抑制率().