热电池复合阴极材料NiCl2/NiF2放电性能的研究
马士平,曹 勇,张小强,魏开远,吴 涛,王 超,崔艳华
(中国工程物理研究院电子工程研究所,四川 绵阳 621000)
1 前 言
热电池是一种热激活式贮备电池,使用高温熔盐作为电解质,具有快激活、大功率、长贮存寿命等优点,常用于导弹和火箭弹等先进武器中[1-3]。其主要由单体电池、加热片、保温材料、引燃材料、壳体等组成,如图1所示。在贮存过程中,热电池所使用的熔盐电解质为固态,电导率极低,因此热电池自放电速率维持在极低水平。当通过引燃加热材料快速释放热量,热电池内部温度快速(≤1 s)升高至熔盐电解质熔点以上,熔盐电解质电导率显著升高(1~3 S·cm-1),此时热电池能够进行大电流放电[4]。
目前,热电池中常使用LiB、LiSi等合金作为阳极材料[3,5],LiCl-KCl、LiCl-LiBr-KBr、LiF-LiCl-LiBr作为电解质,FeS2、CoS2等硫化物作为阴极材料[6-9]。硫化物具有放电容量高、与熔盐电解质相容性好等优点,但其较低的热分解温度和单体电池放电电压(<2.0 V)导致热电池体积难以进一步减小[10-12]。因此,亟需发展具有较高放电电压的热电池阴极材料,以满足未来武器系统对热电池小型化的发展需求[6,9,13-18]。
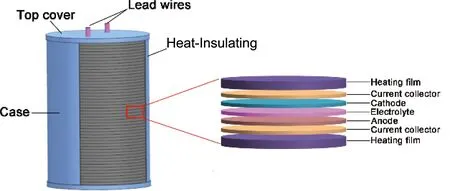
图1 热电池的结构示意图Fig.1 Structural schematic of thermal battery
目前,热电池高放电电压阴极材料主要分为氧化物、氯化物[19-22]和氟化物[23-25]。其中,NiCl2作为热电池阴极材料,具有高的理论放电电压(当阳极材料为Li金属时,其放电电压为2.64 V)、理论放电比容量(413 mAh·g-1)和热分解温度(>800 ℃),应用前景相对广泛[26]。Giagloglou等[27]采用LiCl-KCl熔盐作为NiCl2阴极材料的电解质,其实际放电比容量可达到360 mAh·g-1(放电截止电压≥1 V)。在本团队的前期研究中,通过采用新型全锂LiF-LiCl-Li2SO4电解质代替传统全锂LiF-LiCl-LiBr电解质,实现了NiCl2阴极材料在大电流放电过程中实际放电容量达到377 mAh·g-1(放电截止电压≥1.2 V)[26]。
但是,NiCl2阴极材料在放电过程中,会在其周围生成LiCl等物质,如式(1)所示:
NiCl2+Li→Ni+2LiCl
(1)
导致含LiCl熔盐电解质中的LiCl含量显著增高,引起熔盐电解质成分出现偏析,进而降低熔盐电解质的液相点,导致NiCl2阴极材料在放电过程中的极化电阻显著增大、放电电压下降[20,21,28,29]。因此,采取有效措施抑制NiCl2阴极材料在放电过程中产生的LiCl等物质对熔盐电解质成分造成影响,对于提升其放电性能具有重要意义。
在本研究中,提出了将NiF2与NiCl2进行复合的方法,通过两者间的相互反应(式(2)):
NiF2+2LiCl→NiCl2+2LiF
(2)
调控熔盐电解质中LiF、LiCl的含量,从而减小NiCl2阴极材料在放电过程中造成的熔盐电解质成分偏析对其放电性能的影响。此外,NiF2材料较高的理论放电电压(2.96 V)和理论放电比容量(554 mAh·g-1),能够使NiCl2阴极材料的放电电压和放电容量得到进一步提升。
2 实 验
2.1 电池材料的制备及单体电池组装
NiCl2/NiF2复合阴极材料的制备过程如下:首先,按质量比分别为9∶1,8∶2,7∶3和6∶4的比例混合NiCl2和NiF2材料(均购自国药集团化学试剂有限公司);然后,在球磨机中以450 r·min-1的转速球磨10 h;最后,将制备的NiCl2/NiF2复合阴极材料保存在Ar气氛中。
LiF-LiCl-Li2SO4低共熔熔盐电解质的制备:将购自阿拉丁集团的LiF粉体、LiCl粉体、Li2SO4粉体在250 ℃下干燥10 h,然后以11.4∶35.0∶52.6的质量比混合,经过熔化、制片、粉碎和干燥得到LiF-LiCl-Li2SO4低共熔熔盐电解质(E)。
电解质隔离粉(EB)的制备:将电解质E和MgO粉体(购自阿拉丁集团)按质量比4∶6混合,经过熔融、球磨、过筛、干燥制得EB,将制备好的电解质E和电解质隔离粉EB保存于Ar气氛中待用。
阳极材料的制备:称取一定量的Li-Si合金和Ag粉(质量比为9∶1)放入研钵中研磨混合均匀,随后放入手套箱中待用。
单体电池的组装:将0.5 g阳极材料、0.8 g EB粉、0.3 g阴极材料依次平铺在直径为32 mm的单体电池模具中,以40 mm·min-1的加压速度加载到100 MPa并保压10 s,冷压成型单体电池。
单体电池的电极材料制备及组装均在露点温度低于-50 ℃的干燥间内进行。此外,本实验涉及的电解质及电解质隔离粉的详细制备过程参见本团队前期工作[26]。
2.2 材料表征及电化学性能测试
使用Bruker D8 Advance型X射线衍射仪(XRD)进行物相表征,基本参数为:Cu-Kα、扫描速度为5°/min、扫描角度范围为10°~90°;采用NETZSCH STA449C型综合热分析仪对LiF-LiCl-Li2SO4及其与NiF2的混合物进行热性能表征,基本参数为:Ar气氛、温度为30~600 ℃、升温速率为10 ℃·min-1;采用自制的热电池单体放电装置和Land电化学测试系统,对单体电池进行放电测试与数据收集。
3 结果与讨论
图2a为LiF-LiCl-Li2SO4电解质及其与NiF2阴极材料的混合物的热重-差热分析(TG-DSC)曲线。可以看出,LiF-LiCl-Li2SO4在438.8 ℃处有一个吸热峰,对应其熔化过程。而对于NiF2与LiF-LiCl-Li2SO4的混合物,除了在LiF-LiCl-Li2SO4熔点附近有一个吸热峰外,在更高温度(506.8 ℃)下,出现了一个新的吸热峰,表明NiF2和LiF-LiCl-Li2SO4发生了相互溶解或反应。
图2b为NiF2与LiF-LiCl-Li2SO4电解质隔离粉的混合物(50%∶50%,质量分数)在520 ℃下、Ar气氛中煅烧30 min后的XRD图谱。可以看出,经过煅烧后,在NiF2与LiF-LiCl-Li2SO4电解质隔离粉的混合物中,并未发现LiCl的特征峰,而在36.2°、52.5°和55.0°发现了分别对应于NiCl2材料(104)、(018)和(113)晶面的衍射峰,表明NiF2与LiF-LiCl-Li2SO4熔盐电解质中的LiCl发生了化学反应[30]。表1为反应式(2)中的反应物和生成物在约520 ℃的热力学焓值(ΔH)及熵值(ΔS),其中T为反应温度。通过式(3)计算,反应式(2)的吉布斯自由能(ΔG)为-45.4 kJ·mol-1,表明此化学反应在520 ℃左右能够自发进行。
ΔG=ΔH-TΔS
(3)
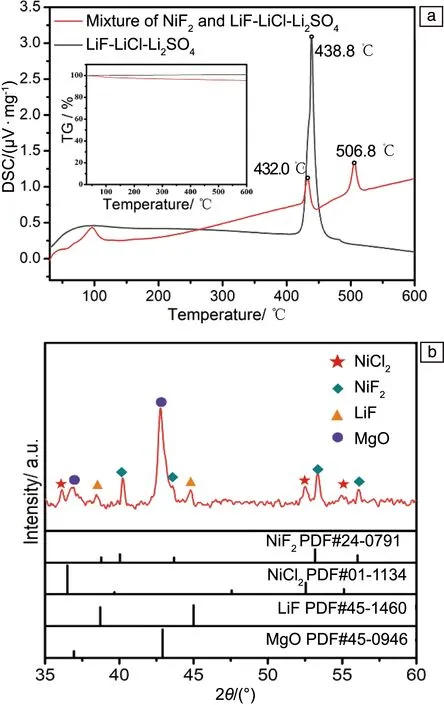
图2 LiF-LiCl-Li2SO4电解质及其与NiF2混合物的热重-差热分析(TG-DSC)曲线(a);在Ar气氛中,NiF2与LiF-LiCl-Li2SO4电解质隔离粉在520 ℃下煅烧30 min后的XRD图谱(b)Fig.2 TG-DSC curves of LiF-LiCl-Li2SO4 electrolyte and its mixture with NiF2 (a);XRD pattern of the mixture of NiF2 and LiF-LiCl-Li2SO4 electrolyte seperator calcined at 520 ℃ for 30 min in Ar atmosphere (b)
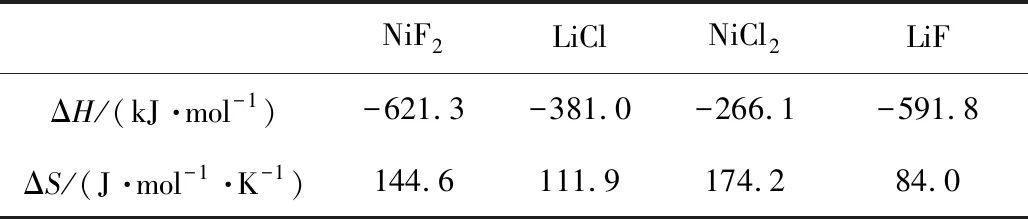
表1 反应式(2)中涉及的不同物质在520 ℃下的焓值及熵值Table 1 Enthalpies and entropies of different materials involved in reaction (2)at 520 ℃
当放电电流密度为100 mA·cm-2时,LiSi/LiF-LiCl-Li2SO4/NiCl2单体电池在不同温度下的放电曲线,如图3所示。可以看出,NiCl2阴极材料在不同温度下随着放电深度的增加,其放电电压显著下降,原因在于,随着放电深度增加,放电产物LiCl在熔盐电解质中的含量急剧增加,引起熔盐电解质出现成分偏析,导致熔盐电解质的液相点降低、极化内阻显著增大,进而表现为NiCl2阴极材料的放电电压迅速降低。对比图3中不同温度下的放电曲线,发现LiSi/LiF-LiCl-Li2SO4/NiCl2体系中NiCl2阴极材料的放电性能并不单纯地随着温度的升高而上升或下降。当温度较低(490 ℃)时,电解质离子的电导率较低,Li+的扩散受到影响,单体电池内阻较大,导致其放电平台电位较低、放电性能较差;当温度较高(550 ℃)时,NiCl2阴极材料在电解质中的溶解度增大,导致其自放电速率增加、放电性能下降。当放电温度为520 ℃时,LiSi/LiF-LiCl-Li2SO4/NiCl2单体电池中NiCl2阴极材料的放电性能达到最优,因此,在对NiCl2/NiF2复合阴极材料的研究中设定其放电温度为520 ℃。
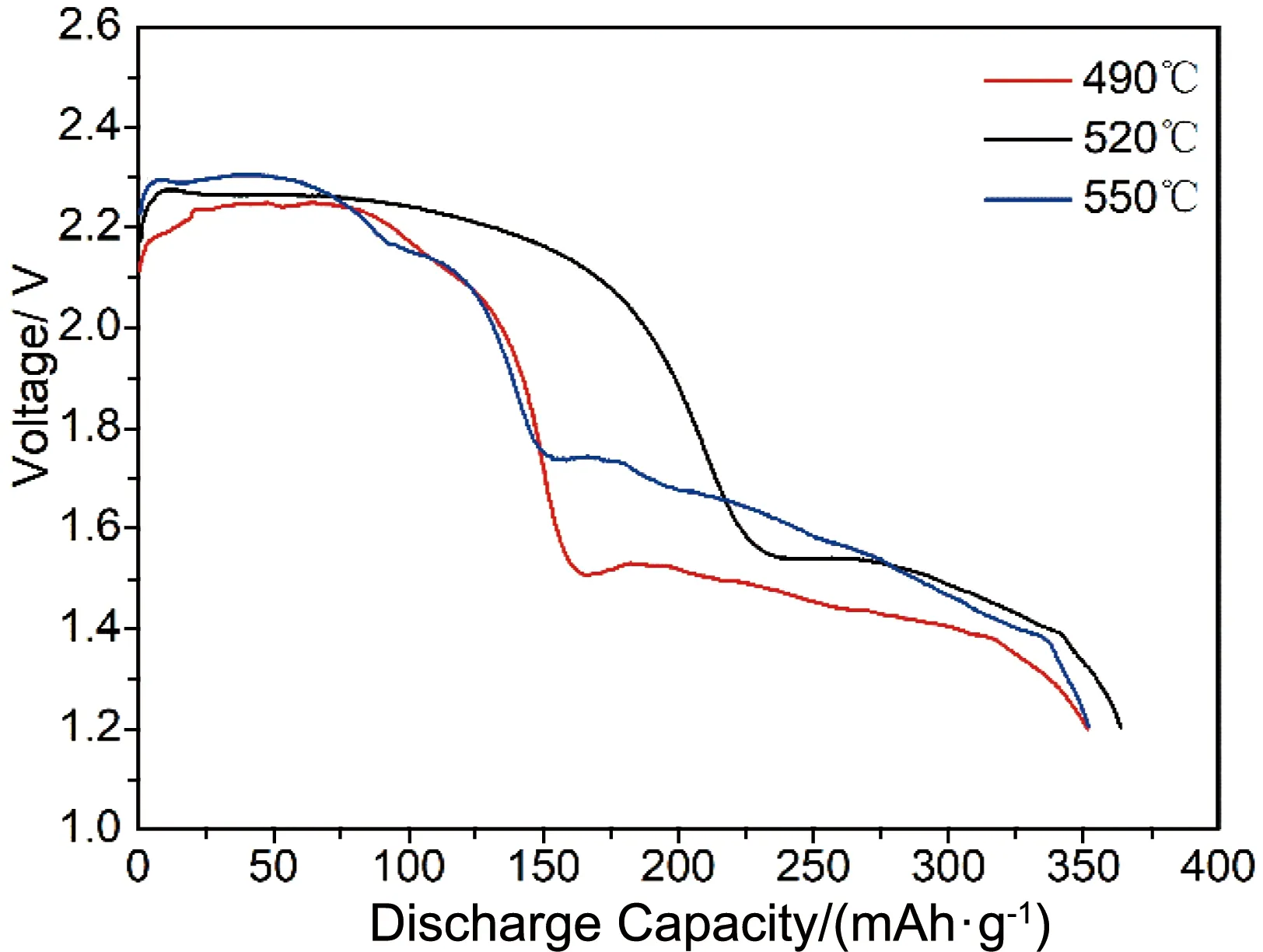
图3 当放电电流密度为100 mA·cm-2时,NiCl2阴极材料在不同温度下的放电曲线Fig.3 Discharge curves of NiCl2 cathode material under different temperatures at the discharge current density of 100 mA·cm-2
当放电电流为100 mA·cm-2时,不同NiF2含量的NiCl2/NiF2复合阴极材料在520 ℃下的放电曲线如图4a所示。可以看出,当仅以NiCl2为阴极材料时,不仅其放电电压明显低于理论放电电压,而且放电电压高于2 V的有效放电容量也较低;当以NiF2为阴极材料时,虽然其放电电压明显高于NiCl2阴极材料,但其实际放电容量较低,主要是由于NiF2会与电解质发生反应;当将NiF2与NiCl2进行复合时,复合阴极材料的放电电压不仅得到明显提升,同时其放电电压较为平稳。当添加的NiF2质量分数分别为10%,20%和30%时,复合阴极材料的放电容量可分别达到216.0,226.7和291.2 mAh·g-1(截止电压为2.0 V),相较于NiCl2(187.8 mAh·g-1)和NiF2(126.2 mAh·g-1)阴极材料的放电容量都有较为明显的提升,且其高电位平台非常平稳。图4b为NiCl2/NiF2复合阴极材料的放电比能量密度(截止电压≥2 V)随NiF2含量的变化图。当NiF2的质量分数小于30%时,随NiF2含量的逐渐提高,NiCl2/NiF2复合阴极材料的比能量密度也在逐渐升高,表明NiF2的添加对NiCl2阴极材料放电过程中产生的熔盐电解质成分偏析抑制作用逐渐增大。当NiF2的质量分数达到30%时,NiCl2/NiF2复合阴极材料的比能量密度最高,达到0.701 Wh·g-1,分别是NiCl2和NiF2阴极材料的1.67和2.11倍。但是,当NiF2的质量分数大于30%时,NiCl2/NiF2复合阴极材料的比能量密度逐渐降低。由此可见,当NiF2的质量分数为30%时,NiCl2/NiF2复合阴极材料具有最优的放电性能。
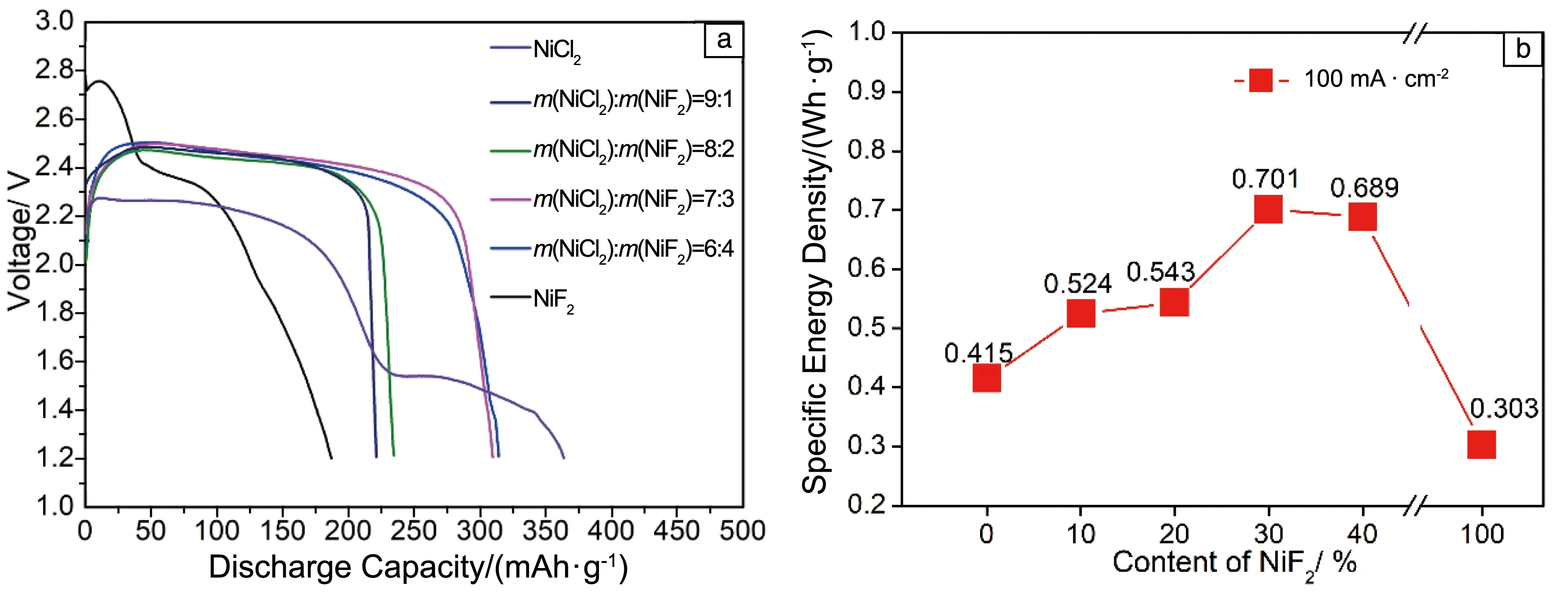
图4 当放电电流密度为100 mA·cm-2时,NiCl2/NiF2复合阴极材料在520 ℃下的放电性能:(a)放电曲线,(b)比能量密度变化(截止电压≥2 V)Fig.4 Discharge performances of NiCl2/NiF2 composite cathode materials at 520 ℃ under the discharge current density of 100 mA·cm-2:(a)discharge curves,(b)variation of specific energy density (Cut-off voltage ≥2 V)
图5和图6分别为不同NiF2含量的NiCl2/NiF2复合阴极材料的脉冲放电曲线和极化电阻随时间变化图,采用的恒放电电流为50 mA·cm-2,脉冲电流为200 mA·cm-2,时间间隔为15 s,时长为1 s。当施加脉冲电流时,NiCl2/NiF2复合阴极材料的放电电压明显下降,移去脉冲电流后,电压快速回复至较高水平并快速下降,主要是由于放电过程中反应产物的生成导致极化增大。该现象在不同NiF2含量的NiCl2/NiF2复合阴极材料中均出现,且随着NiF2含量的增加逐渐变弱甚至消失。综上,在相同条件下,NiF2的添加一方面能够与NiCl2阴极材料的放电产物LiCl发生反应,降低熔盐电解质中LiCl的含量,进而抑制熔盐电解质的成分偏析,使得NiCl2阴极材料在放电过程中的极化电阻得到有效降低;另一方面,NiF2材料较高的放电电压和放电容量也有益于NiCl2/NiF2复合阴极材料放电性能的提升。通过对比不同NiF2含量的NiCl2/NiF2复合阴极材料的单体电池的极化内阻(图6),进一步表明NiF2可以有效降低NiCl2在放电过程中因LiCl生成引起熔盐电解质成分偏析而导致的较大的极化电阻。
4 结 论
通过简单的球磨法合成NiCl2/NiF2复合阴极材料,能够有效抑制NiCl2阴极材料在放电过程中产生的LiCl所引起的熔盐电解质成分偏析,从而降低NiCl2阴极材料在放电过程中的极化电阻,进而实现NiCl2阴极材料放电性能较为明显的提升。当NiF2的质量分数为30%时,NiCl2/NiF2复合阴极材料的放电容量可达291.2 mAh·g-1(截止电压≥2 V),较NiCl2阴极材料(187.8 mAh·g-1,截止电压≥2 V)提升了55%。由此可见,将NiF2和NiCl2阴极材料进行复合,是一种有效提升NiCl2阴极材料放电性能的方法。本研究不仅为解决NiCl2阴极材料在热电池实际应用中产生的问题提供了新的解决方法,也为推动热电池新型阴极材料的发展提供了新的研究思路。
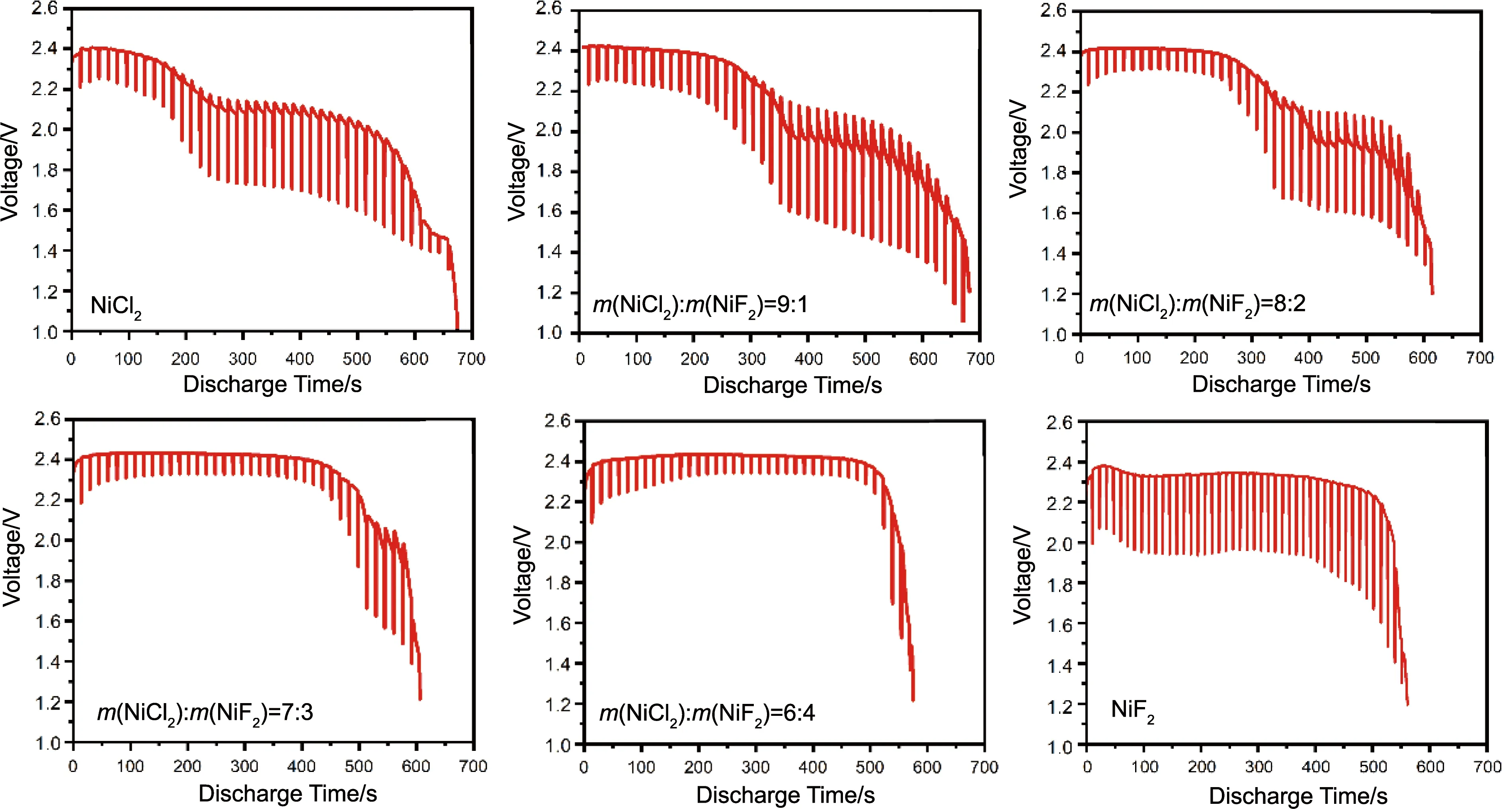
图5 以不同NiCl2/NiF2复合阴极材料制备的单体电池的脉冲放电曲线Fig.5 Pulse discharge curves of single cells prepared with different NiCl2/NiF2 composite cathode materials
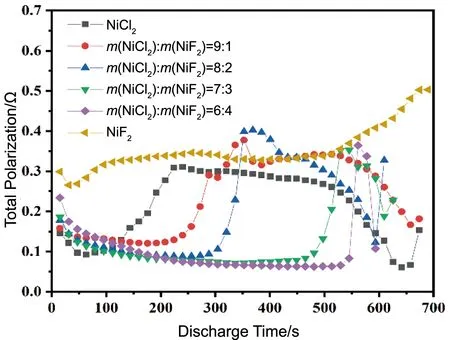
图6 以不同NiCl2/NiF2复合阴极材料制备的单体电池的极化内阻变化Fig.6 Variation of polarization internal resistance for single cells prepared with different NiCl2/NiF2 composite cathode materials

