一种酸化缓蚀剂的制备与评价
刘 佳,张婷婷,张科良
(1.中国石油长庆油田分公司第一采气厂,陕西靖边 718500;2.西安石油大学化学化工学院,陕西西安 710065)
添加酸化缓蚀剂是解决油田腐蚀的最经济手段[1]。有机吸附型酸化缓蚀剂一般包括[2]:曼尼希碱型缓蚀剂、咪唑啉型缓蚀剂、季铵盐型缓蚀剂、席夫碱及其衍生物[3]、天然生物质类缓蚀剂、药物型缓蚀剂[4]、其他杂环类缓蚀剂等类型。曼尼希碱的合成一般通过醛、酮与胺之间,发生曼尼希反应来实现。醛一般包括甲醛(多聚甲醛)、苯甲醛、肉桂醛等;酮一般包括环己酮、苯乙酮、丙酮、戊二酮等;胺包括环己胺、苯甲胺、苯胺、多乙烯多胺等。水合肼不仅具有胺的通性,本身还具有较强的还原性,常常用于水介质中的除氧剂。然而,水合肼的曼尼希碱型酸化缓蚀剂研究的比较少[5-7]。因此,进一步开发醛-酮-肼曼尼希碱,不仅具有理论价值而且具有一定的实用价值。
1 实验部分
1.1 实验仪器与药品
甲醛、环己酮、丙酮、苯乙酮、水合肼、无水乙醇、浓盐酸等试剂均为分析纯。2-亚苄基环己酮按照文献[8]进行制备。
超级恒温水浴,腐蚀静态失重评价装置,分析天平(精确到0.000 1 g),N80 钢片等。NICOLET5700 傅里叶变换红外光谱仪,美国赛默飞世尔科技公司;RE-2000A 旋转蒸发器,西安予辉仪器有限公司。
1.2 酸化缓蚀剂腐蚀速率的测定方法
参考《SY 5405-1996 酸化用缓蚀剂性能试验方法及评价指标》,采用静态失重法对酸化缓蚀剂产品进行缓蚀性能评价。测定条件如下:N80 钢片,腐蚀介质为15%盐酸,腐蚀时间为4 h。
1.3 曼尼希碱型酸化缓蚀剂的制备及最佳酸化缓蚀剂的筛选
1.3.1 制备原理 反应方程式(见图1)。其中,R1可以是CH3,C6H5,R2可以是H 等。
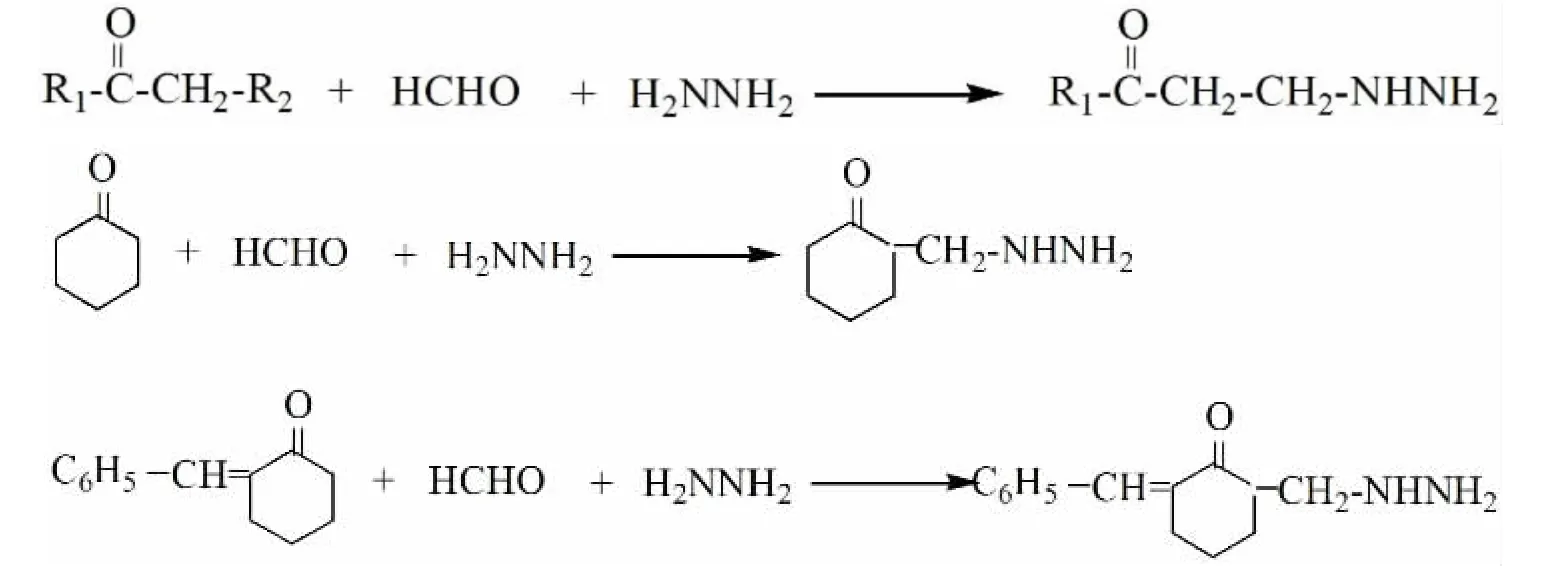
图1 反应方程式
1.3.2 制备步骤 在100 mL 三口烧瓶中,安装机械搅拌器、回流冷凝器和恒压滴液漏斗。向三口烧瓶中加入10 mL95%的乙醇和计量的水合肼,用体积比为1:1 的浓盐酸-95%乙醇混合溶液调节反应混合物至拟定的pH,搅拌下滴加计量的醛、酮溶液混合物。搅拌下,加热升温至设定的温度,反应至设定的时间。
1.3.3 制备条件优化 曼尼希碱型酸化缓蚀剂的制备条件优化(见表1)。

表1 曼尼希碱型酸化缓蚀剂L16(45)正交实验表头设计
1.4 最佳酸化缓蚀剂吸附热力学研究
最佳酸化缓蚀剂加量如下:0.3%,0.4%,0.6%,0.8%,1.0%;实验温度为:50 ℃、60 ℃、70 ℃、80 ℃、90 ℃,腐蚀介质为15% HCl,腐蚀时间为4 h。
1.4.1 吸附吉布斯自由能的计算 若缓蚀剂分子在金属表面的吸附符合Langmuir 吸附等温式,则有式(1):

式中:K-吸附平衡常数;C-缓蚀剂浓度,%;η-缓蚀效率,%;θ-缓蚀剂分子在金属表面的吸附覆盖率,%(η≈θ)。
以C/η 对C 作图,对数据进行拟合,可由直线截距计算出吸附平衡常数K[9]。
根据吸附的标准自由能的计算公式(2):
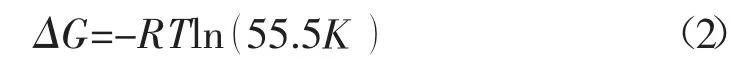
式中:R-气体常数,J/mol-1·K-1;T-热力学温度,K;55.5-1 mol/L 溶液中水的浓度。
1.4.2 吸附焓变以及熵变的计算 依据Arrhenius 方程(3):
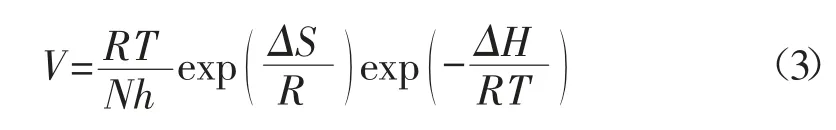
式中:N-Avogadro 常数;h-Planck constant;ΔS-金属溶解过程中的熵变;ΔH-金属溶解过程中的焓变。
以ln(V/T)对1/T 作图。由图可知,该直线的斜率为(-ΔH/R),该直线的截距为(ln(R/Nh)+ΔS/R)[9]。
1.5 最佳酸化缓蚀剂吸附动力学研究(吸附活化能的计算)
依据Arrhenius 方程:V=Aexp(-Ea/RT),以lnV 对1/T 作图。由该直线的斜率为(-Ea/R)可计算出表观活化能。
1.6 最佳酸化缓蚀剂的精制与红外光谱表征
对曼尼希碱产物应用水蒸气蒸馏,除去产物中残留的甲醛。再用柱分离的方法除去残留的2-亚苄基环己酮。对精制产品采用溴化钾压片法,进行红外光谱结构表征。
2 结果与讨论
2.1 曼尼希碱的制备及最佳缓蚀剂的筛选
依据实验方案,实验结果(见表2)。

表2 正交实验腐蚀测试结果及分析
由极差分析可得,影响曼尼希碱型酸化缓蚀剂缓蚀性能的最大影响因素是酮的种类;其次反应介质pH值和反应物料配比;反应温度和反应时间对其缓蚀性能影响很小。正交实验结果表明,以80%水合肼、36%甲醛溶液和2-亚苄基环己酮为原料,在pH 值为5、反应温度为30 ℃、反应时间为9 h 及反应物料配比n(醛):n(酮):n(肼)为1.2:1.0:1.0 的条件下合成的曼尼希碱,其缓蚀性能最佳。最佳条件下制备的产品,其腐蚀速率仅为0.673 2 g/(m2·h)。
2.2 最佳酸化缓蚀剂的吸附热力学结果
2.2.1 最佳酸化缓蚀剂的吸附自由能计算结果 N80钢 片 在323.15 K、333.15 K、343.15 K、353.15 K 和363.15 K 温度下,不同缓蚀剂加量的C/η-C 点图并进行线性拟合(见图2),拟合方程(见表3)。
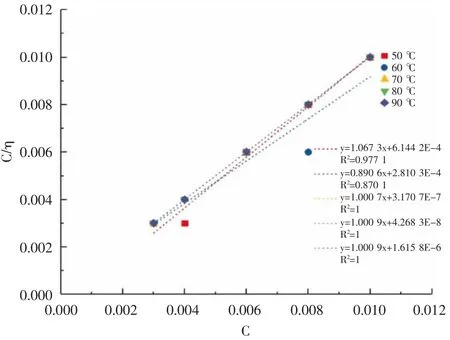
图2 酸化缓蚀剂在不同温度下的Langmuir 吸附等温线
根据表3 可知,拟合曲线的斜率均接近于1.00,可确定最佳酸化缓蚀剂在金属表面的吸附符合Langmuir吸附等温方程;吸附自由能的绝对值数据随着腐蚀介质的温度的升高(363.15 K 除外)而增大,说明自制的最佳酸化缓蚀剂在金属表面的吸附随腐蚀介质温度的提高而增强;吸附自由能ΔG 均小于0,表明该酸化缓蚀剂在腐蚀介质中发生的吸附过程均为自发反应;由吸附自由能ΔG 的绝对值大于40 kJ/mol,说明酸化缓蚀剂在金属表面的吸附属于化学吸附。

表3 吸附自由能的计算
2.2.2 最佳酸化缓蚀剂的吸附焓变的计算 以ln(V/T)对1 000/T 作图(见图3),可以获得吸附焓变的数据(见表4)。
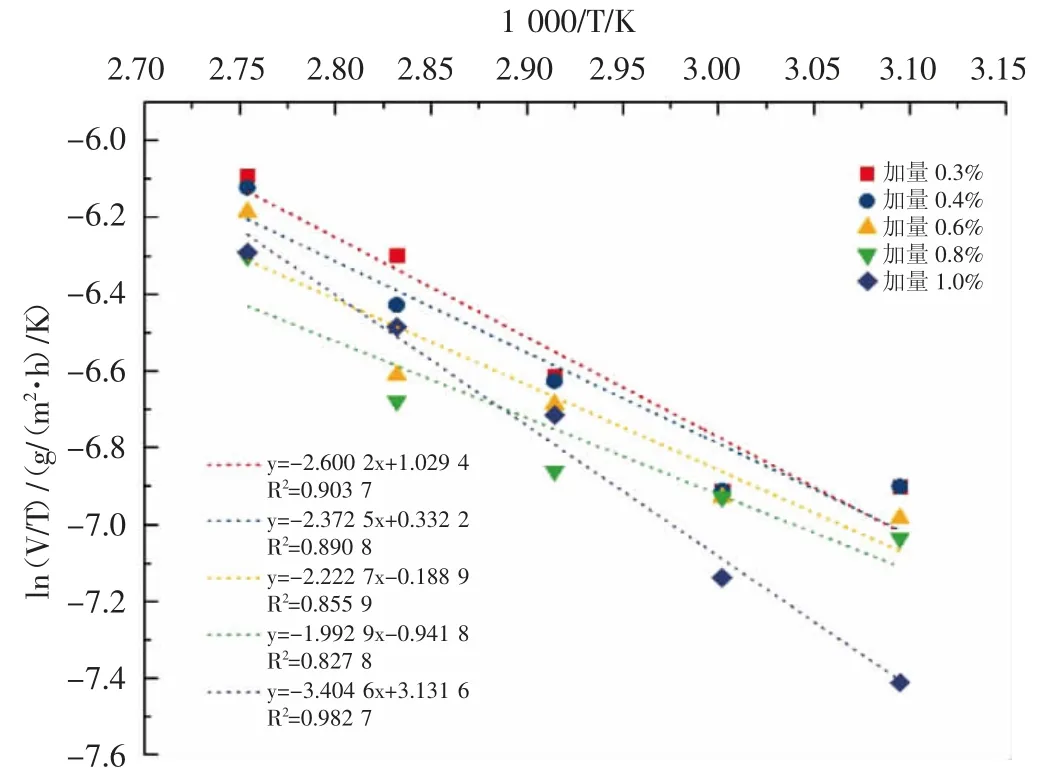
图3 不同温度下最佳曼尼希碱的吸附焓变的计算
由表4 可知,最佳曼尼希碱的ΔH 为正值,表明该缓蚀剂在金属表面的吸附过程是一个吸热过程。这也说明该酸化缓蚀剂在金属表面的吸附符合化学吸附。与吸附自由能的判定结果一致。最佳曼尼希碱在不同腐蚀温度下的ΔS 均为正值,表明该缓蚀剂在金属表面的吸附过程是一个熵增的过程。这也表明酸化缓蚀剂在金属表面的吸附是一个无需状态。
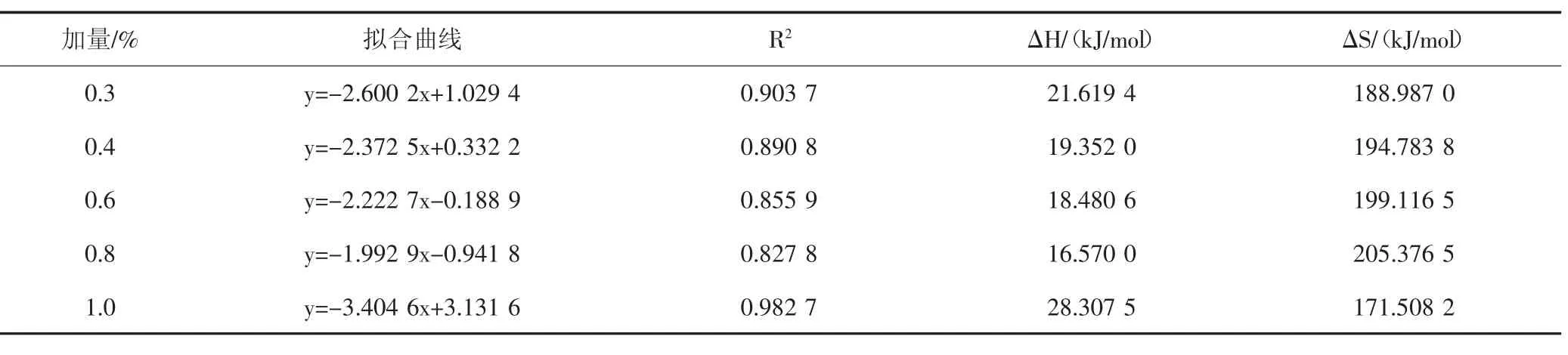
表4 吸附焓变以及熵变的计算
2.3 最佳曼尼希碱在金属表面吸附的动力学数据
以lnV 对1 000/T 作图(见图4),可以获得吸附活化能的数据(见表5)。

表5 吸附活化能的计算

图4 不同温度下最佳曼尼希碱的腐蚀活化能的计算
由表5 可知,当在15%盐酸介质中加入该曼尼希碱型酸化缓蚀剂后,金属的腐蚀是受到一定程度的抑制。当加量为1%时,抑制腐蚀的能力在考察的范围内最强。
2.4 最佳曼尼希碱的结构表征
最佳曼尼希碱的红外光谱(见图5)。
由图5 可知,3 404 cm-1为N-H 键的伸缩振动吸收;3 030 cm-1的肩峰为芳烃C-H 键的伸缩振动;2 932 cm-1,2 856 cm-1为CH3和CH2的C-H 伸缩振动吸收;1 709 cm-1为六元环酮中的C=O 振动吸收;1 648 cm-1为N-H 伸缩振动吸收;1 602 cm-1,1 493 cm-1,1 444 cm-1为苯环骨架振动吸收;1 342 cm-1和1 308 cm-1归属为C-N 键的伸缩振动。756 cm-1的弱峰和700 cm-1的中强峰表明苯环为单取代结构。

图5 最佳曼尼希碱的红外谱图
3 结论
(1)实验结果表明,以80%水合肼、30%甲醛溶液和2-亚苄基环己酮为原料,在pH 值为5、反应温度为30 ℃、反应时间为9 h 及反应物料配比n(醛):n(酮):n(肼)为1.2:1.0:1.0 的条件下合成的曼尼希碱为最佳酸化缓蚀剂。
(2)实验表明,N80 钢片在15%盐酸水溶液、腐蚀温度为90 ℃、最佳缓蚀剂加量仅为0.3%的腐蚀介质中腐蚀4 h,腐蚀速率为0.822 7g/(m2·h),优于行业一级标准。
(3)从吸附热力学角度证明了最佳曼尼希碱缓蚀剂在金属表面的吸附过程符合Langmuir 等温吸附模型,最佳曼尼希碱在不同温度下的|ΔG|均大于40 kJ/mol以及吸附焓变大于零,表明其在金属表面的吸附为化学吸附。
(4)吸附动力学研究表明,当在15%盐酸介质中加入该曼尼希碱酸化缓蚀剂后,腐蚀活化能大于19 kJ/mol,金属的腐蚀是受到一定程度的抑制。当加量为1%时,腐蚀活化能最大,抑制腐蚀的能力在考察的范围内最强。

