低植酸作物遗传改良途径与磷资源高效利用
蒋 鹏,李家庆,郭竞选,赵 政,袁力行
(中国农业大学资源与环境学院,国家农业绿色发展研究院/植物-土壤相互作用教育部重点实验室,北京 100193)
磷 (phosphorus,P) 是一种有限的、不可再生的矿质元素,在生命遗传繁衍 (DNA和RNA)、能量转运 (ATP) 等过程中发挥着重要作用[1]。磷是作物生长所必需的大量元素之一。作物根系主要吸收无机磷酸盐 (phosphate,Pi)。由于土壤磷具有低溶解度、低迁移率和高固定率的特征,土壤溶液中的Pi浓度仅为1~10 μmol/L[2-3],而植物组织内的Pi浓度一般达到5~20 mmol/L,因此在农业生产中需要施用磷肥来维持作物生长。磷矿资源是磷肥生产的原料,全球探明储量可达6.9 × 1010t,其大部分集中在摩洛哥(USGS,2020)[4]。我国磷矿资源储量约有 3.2 × 109t[4],主要分布于云、贵、川、湘、鄂5省[5],磷矿石P2O5的平均品位为16.85%[5-6],存在资源集中、富矿及易选矿少等问题[7]。然而,农业磷资源的过量投入却导致了全球农田磷盈余,从1961年的2.3 × 106t增长到2013年的1.08 × 107t,仅有22%的磷投入最终被人类消费[8]。大部分盈余磷进入环境引起了水体富营养化[9-10]、土壤重金属污染等问题[11-12]。为此,磷资源的可持续利用及其对粮食安全和环境安全的影响已经引起世界各国的重视[13]。
为了解决磷的资源与环境问题,必须从整个农业系统磷流链条的角度创新磷资源可持续性管理[14]。其中,提高作物磷效率 (P efficiency,PE) 尤为重要,包括作物从土壤中获取磷的效率 (PupE,P uptake efficiency) 和体内磷的利用效率 (P utilization efficiency,PutE)[14-15]。植物根系进化出多种形态和生理学策略来高效获取土壤磷。磷高效吸收的理想根构型 (root system architecture,RSA) 应具有较浅的根基部生长角度、密集的侧根分支和较长的根毛,从而通过增加浅层土壤的根表面积来提高PupE[16-17]。植物根系还可以通过增加质子、有机酸阴离子和酸性磷酸酶分泌来提高土壤中难溶磷的利用率[18]。为了提高PutE,植物可将衰老叶片组织中丰富的线粒体与叶绿体中的核酸 (DNA和RNA) 分解进行循环利用[19],活化与再利用液泡中存储的磷,以及减少磷向籽粒的分配等[20-21]。此外,植物磷的吸收利用通常伴随着与氮、钙等元素的相互作用[22-24],调控植物对其它元素的吸收利用也能间接提高磷效率。
作物体内60%~85%的磷储存在成熟的籽粒中[25-26],每年作物收获带走的磷约占全球农田磷肥施用量的85%[27],而动物或人类消费的磷仅有约10%能被再循环利用[28]。植酸 (肌醇-1,2,3,4,5,6-己磷酸,InsP6) 是磷在籽粒中的主要储存形式,占籽粒总磷的65%~80%[29-30]。植酸能够螯合Fe2+、Zn2+等元素形成植酸盐[31]。籽粒萌发过程中内源植酸酶被激活,降解植酸盐来释放肌醇、磷和其他矿质阳离子用于支撑幼苗生长[32]。然而,包括人类在内的非反刍动物均无法消化植酸盐来获取其螯合的Fe2+、Zn2+等有益微量元素[33-34]。这些植酸盐随动物排泄物排出体外,进入水体后加剧富营养化而造成环境污染[35]。畜牧业中通常向动物饲料中添加磷补充剂[36]或外源植酸酶[35]来满足动物营养需求,但磷补充剂的添加无法从根本上解决高磷排泄物对环境的危害。添加植酸酶虽然能够降解籽粒中富含的植酸,但费用高昂。
农业系统的磷流动链条包括磷矿开采加工、磷肥生产、土壤磷过程、作物生产、畜禽养殖、人类消费,及最终向环境的磷输入等多个过程,将矿石中的磷逐步转化为土壤磷、植物磷和动物磷,以满足人类的消费需求。开发籽粒低植酸 (low grain phytate,LGP) 作物,可以通过降低籽粒植酸含量来解决植酸磷引起的营养问题,降低作物磷需求,减少磷向环境的排放,从而提升磷在农业系统中的循环利用效率,显示出广阔的应用前景和商业价值[37]。籽粒低植酸作物品种有两种类型:一类品种的籽粒总磷基本不变,但植酸含量低,因此,大部分籽粒磷可以被动物有效利用而导致“废物磷”排放减少,并且籽粒中有益元素的生物有效性也较高,营养品质好,降低了动物饲料中磷补充剂等资源的额外投入;另一类品种的籽粒植酸和总磷含量均低,作物吸收的磷主要积累在秸秆中,这类品种既具有籽粒低植酸的优点,又减少了籽粒收获带走的磷量,积累在秸秆中的磷还可通过秸秆还田来实现磷在农田中的循环利用,降低了作物生产的磷资源需求 (图1)。本文系统综述作物籽粒中磷的来源、籽粒低植酸品种的遗传改良途径,剖析现有研究存在的不足,并对未来籽粒低植酸品种培育与应用进行展望。
1 植物籽粒磷的来源
植物体内磷以无机磷酸盐 (Pi) 和有机磷酸酯两种形式存在。籽粒中Pi在细胞质基质或内质网中合成植酸,并最终储存在蛋白质储存液泡 (protein storage vacuole) 中[38]。尽管籽粒植酸含量在不同作物品种中存在差异,但它与籽粒总磷之间的相关性通常 ≥ 95%[39]。磷在籽粒中的积累主要通过3个步骤完成:Pi从源器官运输到籽粒、籽粒利用Pi合成植酸以及合成植酸的转运与储存。
Pi运输到籽粒有两个途径,包括从叶片等营养器官中活化的Pi通过韧皮部运输到籽粒,和从根系吸收的Pi通过木质部运输到籽粒。因此,土壤Pi的供应和植物组织的Pi浓度能够显著影响Pi从源器官到籽粒的运输过程[40]。目前在模式植物拟南芥中鉴定到一些关键基因,如AtPHT1;5[41]基因可能参与Pi向籽粒的韧皮部运输,AtSPDT[42]基因则通过介导Pi从木质部向韧皮部的横向转运来影响Pi向籽粒的分配;在水稻中也鉴定到参与木质部Pi在茎节的横向转运基因SPDT[21]、OsPHO1;1和OsPHO1;2[43];另外,OsPHT1;8[44]基因可能参与穗轴中Pi向籽粒的运输。在籽粒内部,OsPHT1;4[45]和OsPHT1;8基因参与了Pi向胚的转运,OsSULTR3;3[46]基因则可能在亚细胞水平介导细胞质中Pi向内质网的转运以合成植酸 (表1和图2)。

图2 影响籽粒植酸累积的关键基因 (以水稻为例)Fig. 2 Key genes involved in grain phytate accumulation (take rice as an example)
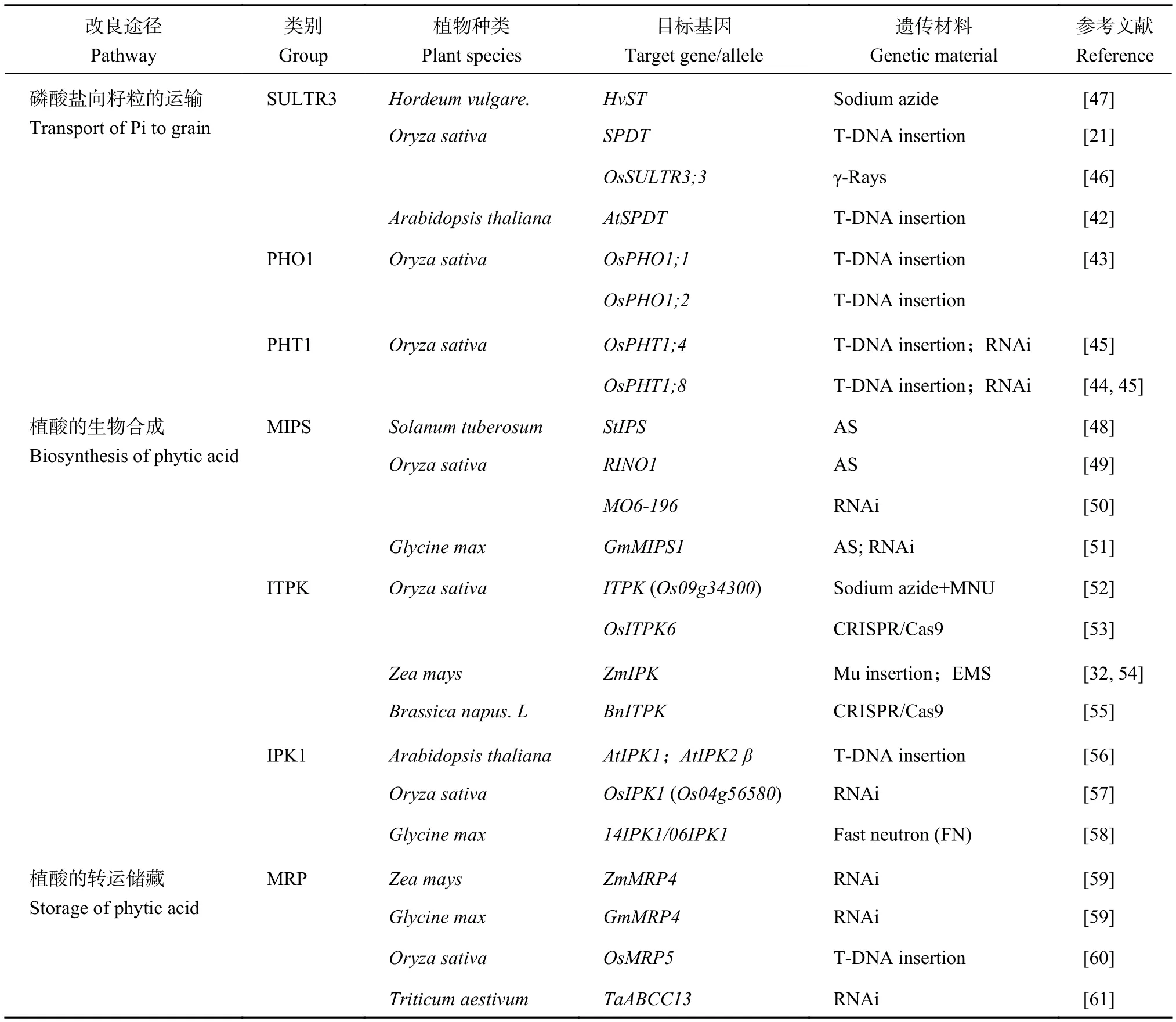
表1 籽粒低植酸品种的遗传改良途径Table 1 Pathways of genetic improvement for low grain phytate varieties
Pi运输到籽粒后,在细胞质基质或内质网中合成植酸,包括非脂质依赖性途径和脂质依赖性途径两种不同的途径,均以肌醇作为反应底物。6-磷酸葡萄糖 (glucose 6-phosphate) 首先在肌醇-3-磷酸合酶(myo-inositol-3-phosphate synthase,MIPS) 作用下转化成肌醇-3-磷酸 [Ins (3) P1],肌醇-3-磷酸水解酶[Ins(3) P1- monophosphatase,IMP] 进一步催化肌醇-3-磷酸生成肌醇。植物组织中常见的脂质依赖性途径是以磷脂酰肌醇 (phosphatidylinositol,PtdIns) 为前体,由肌醇在磷脂酰肌醇合酶 (phosphatidylinositol synthase) 的催化下合成,磷脂酰肌醇在磷脂酶 C(phospholipase C,PLC) 水解作用下生成肌醇-1,4,5-三磷酸[myo-inositol-1,4,5-trisphosphate,Ins (1,4,5)P3],经过多步磷酸化生成植酸。而非脂质依赖性途径在植物籽粒植酸合成中占主导地位,该途径中肌醇在肌醇激酶 (myo-inositol kinase,MIK) 的催化下生成肌醇-3-磷酸,然后再经过多个激酶的顺序磷酸化形成植酸,涉及MIPS、ITPK、IPK1等关键酶。植酸生物合成途径以及相关酶的作用机制非常复杂,还需要深入研究[62]。
合成后的植酸在籽粒中进一步转运并储存。不同谷物中的植酸含量和分布不同,如玉米中植酸主要储存于胚和盾片中,小麦、大麦和水稻中80%的植酸储存于糊粉层和麸皮中,只有小部分植酸储存在胚中[63];豆科作物中95%以上的籽粒植酸在子叶中积累[64];拟南芥中植酸则主要储存在胚中[65]。在水稻中,籽粒发育过程中胚的植酸含量始终较低,但调控植酸合成最后一步的OsIPK1基因在胚和糊粉层中表达最高,因此推测胚中合成的植酸立即被运输到糊粉层中,或者植酸只在糊粉层和亚糊粉层中被合成[66]。目前鉴定到ABC转运蛋白 (ATP-binding cassette transporter) 家族成员中的MRP (multidrugresistance-associated protein) 蛋白可能参与了籽粒中植酸的转运与储存过程[67]。
2 籽粒低植酸品种的遗传改良途径
降低Pi从源器官向籽粒的分配,阻断植酸的生物合成或转运储藏,都能显著降低籽粒的植酸含量,是籽粒低植酸品种遗传改良的主要途径。低植酸突变体材料是籽粒低植酸品种遗传改良的种质基础。研究早期,利用物理、化学诱变或插入突变等方法构建作物突变体库,科学家直接筛选获得一些低植酸突变体材料,并利用这些遗传资源分离克隆到控制籽粒植酸累积的关键基因。另外,随着籽粒植酸磷积累途径分子机制的解析,通过反义、RNAi干扰等技术下调关键基因表达,或采用T-DNA插入、CRISPR/Cas9靶向敲除基因,也能创制相应的低植酸突变体。利用上述正向或反向遗传学手段,在许多作物种类中都取得了很好研究进展,具体汇总在表1中。
2.1 阻断Pi转运途径—减少无机磷向籽粒的运输
减少Pi从源器官向籽粒的运输与分配是降低籽粒植酸含量最直接的途径,倾向于产生籽粒植酸低且总磷也低的品种。目前,已经在SULTR3、PHO1、PHT1家族中克隆出参与Pi向籽粒运输的关键基因成员。它们在植物体内的时空表达模式并不相同,相关低植酸突变体的农艺性状表现也有很大差异。
2.1.1 SULTR 3 (硫酸盐转运蛋白,sulfate transporter) 近年来,在水稻和拟南芥中均鉴定到SULTR3;4基因参与Pi由木质部向籽粒的运输过程。SULTR3;4基因编码的SPDT (SULTR-like phosphorus distribution transporter) 蛋白定位于质膜上,介导H+/Pi的同向转运,而不参与转运硫。Yamaji等[21]研究发现,水稻籽粒灌浆期间,SPDT基因在旗叶与穗部相连的茎节(node I) 处大量表达,受低磷胁迫诱导。它介导了根系吸收的Pi从茎节木质部向韧皮部转移,尤其是Pi从扩大维管束 (enlarged vascular bundles,EVBs)向与穗部相连的分散维管束 (diffuse vascular bundles,DVBs) 转移,从而将Pi优先分配到籽粒。Ding等[42]在拟南芥中也鉴定到类似功能的AtSPDT基因,介导了Pi从木质部经维管形成层向韧皮部的横向转运,进而实现Pi向新生叶及籽粒的优先分配。由于拟南芥的维管系统不同于水稻,根系吸收的Pi通过蒸腾作用向上运输到木质部后,是由位于不同器官分枝点的木质部薄壁细胞中的AtSPDT转运蛋白将其从木质部卸载,再经由维管形成层和伴胞/韧皮部薄壁细胞中的AtSPDT进一步向韧皮部转运,最后运输到籽粒。
在野生型水稻中,地上部总磷的64.5%向籽粒分配,而在spdt突变体中则降低到42.5%~44.0%。由于整株总磷含量没有显著改变,突变体秸秆的磷含量由35%增至57%。因此,spdt籽粒磷含量下降主要是抑制SPDT介导Pi向籽粒分配所造成的。籽粒总磷降低约20%,但并不影响突变体的农艺性状及产量,而秸秆中增加的磷累积可通过秸秆还田来循环利用,因此能节约20%的磷肥投入。突变体的籽粒植酸浓度比野生型降低25%~32%,但不影响籽粒发芽率及其早期萌发,Fe2+、Zn2+的生物有效性得到增强,还降低了植酸磷向环境排放的风险。通过抑制SPDT基因介导的Pi向籽粒分配的过程,可显著降低籽粒植酸磷含量。不影响作物产量,减少了作物磷需求,提高了籽粒品质,是遗传改良的最好靶标。
水稻中还有另外一个SULTR3家族成员OsSULTR3;3,其突变体ossultr3;3的籽粒植酸浓度显著降低35.2%~43.9%,总磷浓度相应下降18.9%~27.5%[46]。OsSULTR3;3基因在发育籽粒的维管束中表达,其编码蛋白定位于内质网上。异源表达体系没有检测到OsSULTR3;3蛋白转运肌醇等植酸前体、磷酸盐或硫酸盐的活性,但不排除在植物中具有相应的转运功能。OsSULTR3;3基因只对植酸合成后期步骤有影响,基因突变会导致编码IPK1、ITPK激酶的基因表达水平改变。鉴于InsP3到InsP6的转化发生在内质网上[65],OsSULTR3;3基因可能参与Pi向内质网的转运,从而为植酸合成提供原料。此外,突变体总硫、硫酸盐以及糖醇、生物胺和游离脂肪酸等营养相关代谢物的浓度上升,说明该基因还可能参与植物组织内部磷酸盐和硫酸盐稳态调节及信号传导过程。Zhou等[68]发现ossultr3;3突变体与商业栽培种的杂交后代,可以稳定观察到籽粒植酸降低和代谢物增加的表型。因此,遗传操作OsSULTR3;3既能降低籽粒植酸,还能增强籽粒营养,也是有效的改良途径之一。
大麦lpa1-1突变体作为最早进行商业化育种的籽粒低总磷类型的LGP品种[69-70],籽粒植酸含量降低约50%,总磷降低15%~20%[71],并且能够特异性降低胚乳30%的总磷[72],具有良好的田间表现[73]。有意思的是,导致lpa1-1突变体表型的大麦HvST也编码了一个SULTR3家族成员,有可能参与植酸合成原料Pi的转运,但具体机制还有待研究[47,74]。
2.1.2 PHO1 (磷转运蛋白,phosphate transporter)研究发现水稻OsPHO1;1和OsPHO1;2基因也参与Pi向籽粒的分配过程。它们编码的转运蛋白同属于PHO1家族,介导Pi的跨质膜流入过程[43]。在成熟期,OsPHO1;1和OsPHO1;2基因在茎节 (node I) 处有较高的表达,其中OsPHO1;1基因主要在DVBs的韧皮部表达,而OsPHO1;2基因主要在EVBs的木质部表达。OsPHO1;2负责将Pi从EVBs的木质部中卸载,而OsPHO1;1则将Pi装载到DVBs的韧皮部后再运输到籽粒。敲除OsPHO1;2基因会减少Pi向籽粒的分配,与野生型相比籽粒磷浓度降低约44%~50%,但并不影响其他矿质元素的分配。与敲除OsPHO1;2基因相比,敲除OsPHO1;1基因对水稻Pi向籽粒分配的影响较小。此外,OsPHO1;1基因在颖果的胚珠维管束和内珠皮的外层,OsPHO1;2基因在颖果的胚珠维管束和珠心表皮也有表达,推测它们可能也参与了Pi从母体组织向籽粒发育的子代组织的传递。这一假设也在拟南芥的PHO1同源基因研究中得到验证[75]。然而,ospho1;1和ospho1;2突变体与野生型的株高和穗数相比均有下降,籽粒明显变小且萌发延迟,ospho1;2突变体的千粒重仅为野生型的52%~58%。因此,对PHO1基因的遗传操作会导致作物产生不良的农艺表现,用于培育低植酸品种的价值不大。
2.1.3 PHT1 (磷转运蛋白,phosphate transporter)研究发现磷转运蛋白PHT1家族成员参与了衰老组织中活化出的Pi向籽粒的再转移过程。AtPHT1;5基因在拟南芥衰老叶片的维管束韧皮部中高度表达,负责Pi从衰老叶片到库器官的转移。过表达AtPHT1;5可导致转基因株系的籽粒Pi浓度提高两倍[41]。OsPHT1;4[45]和OsPHT1;8[44]基因在水稻籽粒发育过程中也有高表达,但二者功能并不冗余。OsPHT1;4基因在胚中的表达量是胚乳和穗轴的10倍[45],可能介导Pi从其他组织向籽粒胚的转运[76]。OsPHT1;4基因功能缺失会导致籽粒中22%~32%的植酸浓度和胚中21%~24%的总磷含量下降,胚乳总磷含量不受影响。参与植酸合成的MIPS合酶和IPK1激酶基因的表达也显著降低,并造成胚的缩小。过表达OsPHT1;4基因则导致胚和胚乳中总磷和植酸浓度增加,植酸合成相关酶的基因表达也被上调。OsPHT1;4基因的功能缺失会导致穗茎秆较弱,结实率比野生型降低50%~58%,产量和千粒重也相应减少,籽粒萌发和根系伸长均受到抑制[45]。OsPHT1;8基因可能参与Pi从穗轴向籽粒的运输,以及从胚乳向胚的运输。缺失OsPHT1;8基因导致突变体穗轴中总磷含量增加30%,灌浆期籽粒中总磷降低30%,结实率降低[44]。OsPHT1;4和OsPHT1;8基因在水稻体内有着复杂的生物学功能,基因缺失突变体有不良农艺表现。然而,选择性沉默胚乳中的OsPHT1;8基因则导致胚中总磷含量下降40%~50%,但不影响胚乳中的磷含量,对千粒重和结实率影响也较小[77],成为一种可能的籽粒低植酸性状的改良途径。
2.2 阻断植酸合成途径—控制Pi合成植酸
作物籽粒中的植酸主要是通过非脂质依赖性途径合成,涉及MIPS、ITPK、IPK1等关键酶。降低这些关键酶的表达及活性,倾向于产生籽粒低植酸、总磷不变的作物品种。
2.2.1 MIPS (肌醇-3-磷酸合酶,myo-inositol-3-phosphate synthase) 植酸合成的首要步骤是MIPS催化6-磷酸葡萄糖生成Ins (3) P1,该反应也是生物体内肌醇的唯一从头来源[78]。不同植物基因组中的MIPS基因数量不同,如水稻有两个MIPS基因,大豆有4个MIPS基因,它们在籽粒发育阶段各有一个MIPS基因特异性高表达[47,79-82]。MIPS基因最早由Dean-Johnson等[83]通过遗传互补从酿酒酵母中克隆。Kuwano等[84]通过反义RNA来降低编码MIPS合酶的RINO1基因表达,获得籽粒植酸含量下降、但总磷含量没有降低的水稻突变体。虽然敲除MIPS基因可以显著降低籽粒植酸含量,但通常会对籽粒萌发、幼苗生长和产量造成不良影响。Keller等[48]利用反义RNA抑制马铃薯中StIPS基因的表达水平至野生型水平的20%以下,籽粒肌醇含量明显降低,但会导致叶片形态改变、早熟衰老及整体块茎产量下降。
有研究发现对籽粒MIPS基因进行特异性沉默似乎可以避免敲除基因带来的相关缺陷。Kuwano等[49]采用籽粒特异性启动子oleosin18,反义下调了水稻RINO1基因表达,籽粒植酸含量减少了68%,但对籽粒干重、发芽或植株生长没有产生负面影响,Ali等[50]利用RNAi技术沉默水稻RINO1基因表达也取得了类似的效果。在大豆中使用籽粒特异性启动子vicilin下调GmMIPS1基因的表达,也不会影响其他组织的肌醇代谢[85],Kumar等[51]利用vicilin靶向破坏大豆籽粒中GmMIPS1基因的表达,突变株系的籽粒中分别观察到38.75%和41.34%植酸含量的降低,矿质元素Fe2+、Ca2+的含量显著增加,表明特异性沉默MIPS基因来实现籽粒低植酸性状遗传改良切实可行。
2.2.2 ITPK (肌醇三/四磷酸激酶,inositol tris/tetrakisphosphate kinase) ITPK激酶属于ATPGRASP折叠蛋白家族 (ATP-grasp fold protein)。在肌醇形成与代谢中间过程中,ITPK激酶催化的肌醇磷酸盐的持续磷酸化过程研究最多。通过可逆赖氨酸乙酰化可以调控ITPK1激酶,进而抑制肌醇的更高磷酸化,降低细胞中的植酸含量[86]。目前在拟南芥[87-88]和大豆[89]中分别鉴定到4种不同的ITPK激酶,其中大豆GmITPK3在籽粒发育早期有较高表达。在水稻中鉴定到6个ITPK激酶[62],其中OsITP5/6K-4和OsITP5/6K-6基因在籽粒胚中特异性表达。尽管水稻OsITP5/6K-6基因的突变可以有效抑制水稻籽粒的植酸合成,却会显著影响植株的生长和繁殖[53]。Kim等[52]筛选水稻TILLING (targeting of induced local lesions IN genomes) 库鉴定到4个低植酸突变体,其中两个目标基因属于ITPK基因家族,其突变导致籽粒中植酸含量分别减少46%和68%,其中减少46%植酸含量的突变株系的农艺性状无显著变化。目前在玉米中只鉴定到一个编码ITPK激酶的基因ZmIPK,且在胚中特异性表达,该基因的突变可以降低玉米籽粒30%~50%的植酸含量且总磷不变,籽粒干重有部分下降但不会影响功能[32,54]。最近,Sashidhar等[55]在多倍体油菜中寻找到15个ITPK同源基因,通过CRISPR/Cas9技术获得了两个ITPK基因三重突变体bnitpk1。其籽粒植酸含量显著降低27.2%~35.3%,同时Pi含量增加,总磷基本保持不变,并没有表现出产量和种子活力等农艺性状的缺陷。因此,在不同作物中敲除关键酶ITPK的编码基因可以降低籽粒植酸含量,但对农艺性状的影响在不同作物种类中存在较大差异,该途径的应用还需更深入的研究。
2.2.3 IPK1 (肌醇-五磷酸二激酶,inositolpentakisphosphate 2-kinase) 植酸生物合成的最终步骤是IPK1激酶催化Ins (1,3,4,5,6) P5转化为InsP6。Sun等[90]在玉米中鉴定到ZmIPK1A和ZmIPK1B为两个相似的旁系同源基因,ZmIPK1B基因在根中表达,而ZmIPK1A基因在幼穗、籽粒的胚乳和胚中等部位均有表达。水稻的IPK1基因在籽粒发育早期的糊粉层中表达最高[62]。拟南芥中至少有两个IPK1基因表达,其中AtIPK1基因在发育阶段的花蕾、角果等部位表达[91]。AtIPK1和AtIPK2β基因双突变体的籽粒植酸含量降低83%,Pi含量增加10倍,且籽粒产量不受影响[56]。
拟南芥中的AtIPK1基因的突变虽然可以降低籽粒植酸含量,但会导致植物体内磷酸盐稳态的紊乱,导致磷酸盐的过度积累[92]。植酸参与细胞核的mRNA输出过程,AtIPK1基因突变会导致mRNA输出不足,Lee等[93]发现Gle1蛋白是调控植酸在植株生长和繁殖中功能的重要因子,gle1基因突变的拟南芥表现出对植酸的敏感性增强,可以弥补AtIPK1基因突变的缺陷,显著提高突变体的营养生长和籽粒产量,为从遗传操作植酸信号转导途径培育低植酸作物品种提供了可能。Ali等[57]使用启动子oleosin18特异性沉默籽粒IPK1基因的表达,突变体水稻的籽粒植酸含量显著降低,Pi含量增加,胚乳的铁含量为野生型的1.8倍,并且对籽粒萌发等农艺性状没有产生负面影响。Vincent等[58]通过挖掘作物优良的等位变异,对大豆6号染色体与14号染色体的IPK1基因进行基因型和籽粒磷表型间的关联分析,培育出两个位点上均有突变的籽粒低植酸品种,籽粒萌发和田间出苗率等性状均无显著降低,并表现出极低的植酸水平与适宜的Pi水平。围绕植酸信号转导过程,特异性沉默籽粒IPK1基因及挖掘优良等位变异等为遗传改良籽粒低植酸品种提供了可行途径。
2.3 阻断植酸转运途径—控制籽粒的植酸含量
植酸在细胞质基质或内质网中通过肌醇的顺序磷酸化合成后,在由ABC型的MRP蛋白介导下跨膜运输与区室化,并最终储存在液泡中。也有研究认为,MRP蛋白是通过调控植酸合成原料Pi的供应来参与调节植酸水平[67,94-95]。对植酸转运途径进行阻断,植酸将无法转运到液泡内存储,因而在细胞质被磷酸酶降解,从而使植酸含量减少、Pi含量增加,倾向于产生籽粒低植酸、总磷不变的品种。Shi等[59]利用籽粒特异性启动子globoulin-1靶向沉默玉米胚中编码MRP4蛋白的基因,突变体籽粒的植酸含量下降32%~75%,总磷基本保持不变,籽粒发育未受影响。在大豆中对同源基因进行沉默也得到相似效果。
然而,T-DNA插入缺失水稻OsMRP5基因,虽然显著降低了籽粒的植酸含量,但是子代出现纯合致死现象[66]。大豆中MRP蛋白的功能缺失也可能会对作物生长发育造成不良影响。Neelam等[96]对低植酸大豆品系 (携带一个MIPS和两个MRP基因突变)与正常品系的RNA测序数据进行了差异表达和功能富集分析,发现突变体籽粒的细胞壁合成相关基因提前表达,而光合作用相关基因在发育后期表达降低,可能会对籽粒的产量和发育造成负面影响。Bhati等[61]利用RNAi技术沉默小麦TaABCC13基因的表达,籽粒的植酸含量虽然降低22%~34%,但小麦的穗发育不良、籽粒灌浆减少,并且TaABCC13基因参与小麦的侧根发生和重金属解毒。MRP基因在植物体内有着复杂的生物学功能,还不能简单通过敲除或沉默该基因的表达来进行籽粒低植酸性状的遗传改良。
3 展望
培育籽粒低植酸品种是解决农业磷资源、环境及动物/人类营养问题的关键。较外源植酸酶添加等手段[97],它仍是解决籽粒植酸磷问题的优选方案。本文综述提出的调控植酸磷积累关键基因可以作为未来育种的潜在靶标。目前亟待解决的问题是,籽粒低植酸表现会伴随产量下降、种子萌发率低等不良农艺性状,尤其是遗传操作植酸合成途径相关基因。未来可从3个方向着手,突破制约籽粒低植酸品种培育及应用的瓶颈。
3.1 特异性修饰籽粒中关键基因的表达
植酸和其前体肌醇、肌醇磷酸盐及衍生物肌醇焦磷酸盐 (InsP7,InsP8) 行使着重要功能,如信号转导、生物和非生物胁迫的响应、膜运输及光形态建成等[98],针对肌醇代谢途径的扰动都可能会影响籽粒和植株的发育[99]。未来的研究应该深入关键基因对植物生长发育具体的调控功能,通过对籽粒中关键基因的时空表达进行定向修饰,而不影响植物其他组织中的肌醇代谢,寻找低植酸性状与植物正常发育的平衡点。如前文所述,利用水稻和大豆的籽粒特异性启动子oleosin18[49]和vicilin[51]沉默植酸合成途径关键酶基因的表达,既能调控植酸的合成又不造成籽粒的发育缺陷。
3.2 发掘优良等位变异,结合新型基因编辑技术予以应用
利用遗传多样性种质资源,高通量分析籽粒植酸磷累积表型,找到能够平衡低植酸和产量等重要农艺性状的遗传材料。随后利用全基因组关联或候选基因关联等策略,挖掘作物基因组内优良的等位变异,这在低植酸大豆育种中已经取得良好进展[64]。通过传统育种如杂交,可将低植酸性状与籽粒高萌发率等农艺性状相结合[100],能显著提高田间出苗率[101],但是存在后代性状分离的缺陷。Rosso等[102]利用分子标记辅助育种开发了针对大豆GmMIPS1基因的良好遗传标记,利用该技术可以将优良等位变异导入到高产品种中予以应用。近年来,以CRISPR/Cas9为代表的新型基因编辑技术发展迅猛,能够实现对特定DNA片段的敲除、插入和替换,具有育种周期短、编辑效率高等优势[103]。在新型基因编辑技术的帮助下,可以精准引入关键基因及优良等位变异,大大加快籽粒低植酸品种的育种。
3.3 针对籽粒低植酸品种的磷营养管理
一般认为,维持作物籽粒的正常萌发和幼苗的早期生长只需要籽粒磷浓度高于1 mg/g即可,剩余的大部分籽粒磷并不是种子萌发和幼苗发育所必需[104]。但相较于野生型,籽粒低植酸品种对外源磷营养的供应更为敏感[105],是造成现存的低植酸品种籽粒的萌发和活力比野生型低的重要原因。因此,可以通过田间磷营养管理来提高低植酸品种籽粒的萌发率,如播种时增施种子启动磷肥或种子包膜,为籽粒低植酸品种进行针对性的田间农艺管理,这也是未来的研究重点。

