多黏菌素抗性基因mcr-4/5/8实时荧光定量PCR检测方法的建立
李一鸣,王少林
(中国农业大学动物医学院,北京 海淀 100193)
抗生素是目前临床上治疗感染性疾病的重要武器之一,但随着抗生素在临床及畜禽生产上的重复使用,耐药菌的种类和数量都在逐年上升,临床上不仅出现了多重耐药菌(Multi-drug resistant bacteria,MDR)、广泛耐药菌(Extensively drug resistant,XDR),还出现了泛耐药菌(Pandrug resistant bacteria,PDR)。一些化合物已经被开发或重新应用于革兰阳性耐药菌的治疗,但有很大的局限性;而革兰阴性多重耐药菌的感染更为可怕,目前临床上还没有可用于这些感染的新药物[1]。多黏菌素是治疗多重耐药革兰阴性菌最重要的药物之一,随着其在人类临床上的广泛运用,多黏菌素耐药基因开始在世界范围内出现,人类临床及兽医临床面临着前所未有的危机和挑战[2]。
目前,多黏菌素耐药基因mcr在世界各地的动物、食物以及人类的肠杆菌科细菌中均有发现,其中包括了北美洲、北非、南洋和欧洲[3-4]。这类耐药基因可以在细菌之间通过质粒传播,加速了多黏菌素耐药基因的传播速度,对人类健康和畜牧业生产造成了严重的威胁,目前急需一种快速检测方法,为未知样品中的mcr基因检测提供依据。相对于传统PCR而言,实时荧光定量PCR具有更高的特异性和敏感性,且操作简便[5-6]。目前,mcr-1/2/3/4/5/8在国内外被多次报道,且具有较高的流行率。本实验室前期已经构建了mcr-1/2/3的实时荧光定量检测方法,而mcr-4/5/8的相关方法还未构建,本试验针对mcr-4/5/8基因建立了相应的实时荧光定量PCR检测方法,以便于对动物以及环境样本中多黏菌素耐药基因进行定性与定量检测。
1 材料与方法
1.1 模板、样本和载体mcr-1/2/3/4/5/8阳性模板由中国农业大学动物医学院基础兽医系药理与毒理研究室保存。24份环境样本来自 2018 年重庆育肥猪场和蛋鸡养殖场,为粪便和土壤样品。5 份mcr-8 阳性菌液和 3 份mcr-8 阴性菌液来自2018 年青岛猪场和鸡场,均为肺炎克雷伯菌。感受态细胞DH5α、pMD19-T载体,均购自宝生物工程(大连)有限公司。
1.2 主要试剂 QIAGEN®Plasmid Mini Kit试剂盒,购自优宝生物科技有限公司;PowerSoil®DNA Isolation Kit试剂盒,购自美国MO BIO公司;2×TaqTMPCR Master Mix,购自宝生物工程(大连)有限公司;PowerUPTMSYBR®Green Master Mix 试剂盒,购自美国 Thermo 公司;Wizard®SV Gel and PCR Clean-Up System试剂盒,购自北京普洛麦格生物技术有限公司。
1.3 主要仪器 荧光定量PCR仪Q7,购自美国ABI公司;NanoDrop,购自美国Thermo公司。
1.4 引物设计和验证 首先在NCBI上下载试验中需要的mcr-4/5/8基因的完整序列,使用Primer3plus系统设计本次试验所需要的实时荧光定量PCR特异性引物(表1),并查看其特异性,之后再通过传统PCR的方式对其特异性进行验证,本次试验所用引物均由北京博迈德有限公司合成。
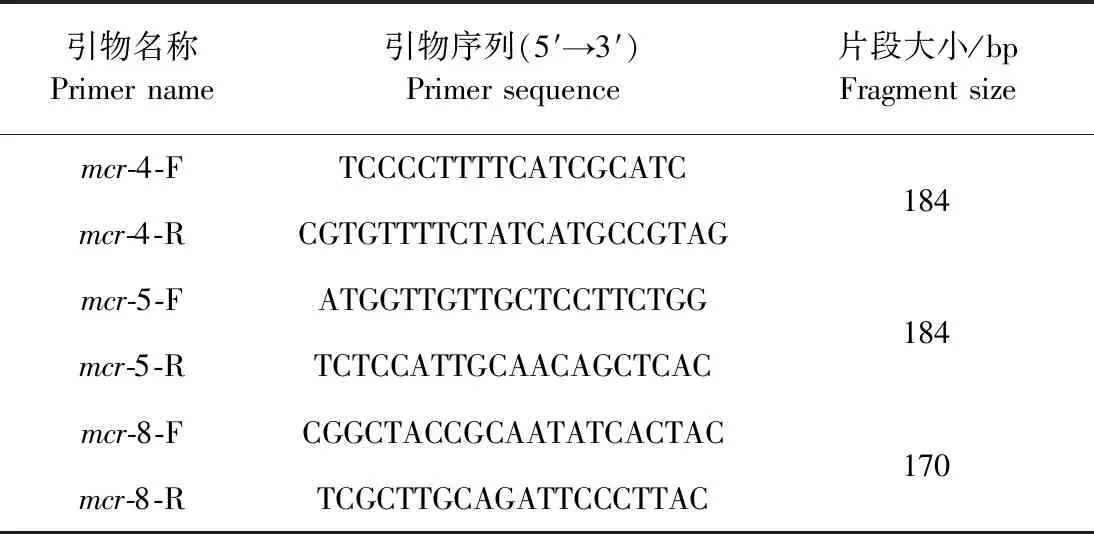
表1 实时荧光定量PCR引物Table 1 Primers of real-time PCR
1.5 基因克隆 利用所设计的特异性引物分别对mcr-4/5/8阳性模板进行PCR扩增。对扩增后的产物进行凝胶电泳并切胶回收。将高质量的胶回收产物与pMD19-T载体连接,构成重组质粒。将重组质粒转化到DH5α感受态细胞中,通过蓝白斑筛选的方式筛选出成功的转化子,并对其进行验证。对转化成功的细菌纯化后进行质粒的提取。
1.6 标准品的制备 使用NanoDrop测定标准质粒的浓度,根据质粒拷贝数计算公式,计算各样品中重组质粒的拷贝数。拷贝数(Copies/mL)=(L×C)/(N×M×109),L为阿伏伽德罗常数,C为重组质粒浓度,N为目的片段加上载体片段的长度,M为每对碱基的平均分子量(660/bp)。
1.7 标准曲线的建立 对标准品进行10倍梯度稀释,取不同稀释度的标准品作为模板。对实时荧光定量PCR反应体系中各组分浓度和退火温度进行优化,以获得最低的Ct值和较高的荧光强度增加值。利用优化好的条件通过SYBR Green Ⅰ实时荧光定量PCR方法构建标准曲线。
1.8 方法特异性的检测 利用建立的方法对1株mcr-4阳性模板、1株mcr-5阳性模板、5株mcr-8阳性菌液以及3株mcr-8阴性菌液(8份菌液为2018年青岛猪场和鸡场分离的肺炎克雷伯菌)进行盲选,观察检测结果是否与之前的测序结果相一致。同时对24份环境样品(样本来自2018年重庆育肥猪场和蛋鸡养殖场,共24份粪便和土壤样本)进行检测,根据检查结果来判定所建立方法的特异性和灵敏度。
2 结果
2.1 引物设计与验证 对所设计的mcr-4/5/8引物的特异性进行验证,结果如中插彩版图1所示,凝胶电泳图中阳性孔有且只有1条明亮的条带,阴性对照未出现条带;熔解曲线均为单峰,表明设计的引物特异性好,可以用于目的基因的定量检测。
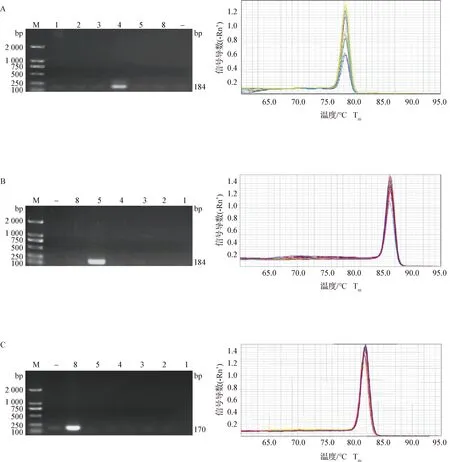
图1 mcr-4/5/8引物特异性验证和熔解曲线Fig.1 Specificity verification of primers and melting curves for mcr-4/5/8M:DNA maker 2 000;A、B、C:mcr-4/5/8;1、2、3、4、5、8:mcr-1/2/3/4/5/8模板;-:阴性对照M:DNA maker 2 000;A,B,C:mcr-4/5/8;1,2,3,4,5,8:mcr-1/2/3/4/5/8 templates;-:Negative control
2.2 重组质粒验证 将转入DH5α感受态细胞的重组质粒通过蓝白斑筛选的方式,最终成功筛选出白色菌落(转化子)。使用所设计的特异性引物以及pMD-19T载体引物M13对获得的转化子进行验证,确定重组质粒是否构建成功。通过mcr-4/5/8引物扩增重组质粒产生的目的片段预期大小为184、184 bp和170 bp;M13引物的扩增产物预期长度为314、314 bp和300 bp。如图2所示,片段大小与预期结果相一致,说明目的基因和T载体成功连接在一起,重组质粒构建成功。
图2 重组质粒验证Fig.2 Verification for recombinant plasmidsA:M13引物扩增;B:mcr-4/5/8引物扩增;M:DNA marker 2 000;4、5、8:mcr-4/5/8重组质粒;-:阴性对照A:M13 primer amplification;B:mcr-4/5/8 primers amplification;M:DNA marker 2 000;4,5,8:Recombinant plasmids of mcr-4/5/8;-:Negative control
2.3 标准曲线的构建 使用上述所制备的重组质粒构建标准品,10倍梯度稀释后构建检测方法的标准曲线,每个梯度3个平行。由表2可知:标准曲线扩增效率接近100%,R2>0.999。从中插彩版图3可知,标准曲线的线性关系良好;扩增曲线平滑且平行性良好;熔解曲线Tm呈单峰,反应过程中扩增产物单一。结果表明本次试验所建立的检测方法特异性好,可用于实际样本中多黏菌素耐药基因mcr-4/5/8的检测。

表2 荧光定量PCR标准曲线相关数据Table 2 Relevant data of real time PCR standard curve

图3 mcr-4/5/8荧光定量检测方法的标准曲线、扩增曲线和熔解曲线Fig.3 Real-time PCR standard curves,amplification curves and melting curves for mcr-4/5/8A:标准曲线;B:扩增曲线;C:熔解曲线A:Standard curves;B:Amplification curves;C:Melting curves
2.4 方法特异性和灵敏度的验证 对24份环境样品进行检测,但样本中mcr-4/5/8的检测结果均为阴性,这可能跟mcr-4/5/8基因在国内的流行特征有关。
同时利用所建立的方法对1株mcr-4阳性模板、1株mcr-5阳性模板、5株mcr-8阳性菌液以及3株mcr-8阴性菌液进行盲选,即分别使用所设计的mcr-4/5/8特异性引物对这些模板和菌液进行荧光定量PCR反应,检测结果见图4,与之前的测序结果100%相一致,证明本次所构建方法特异性好。
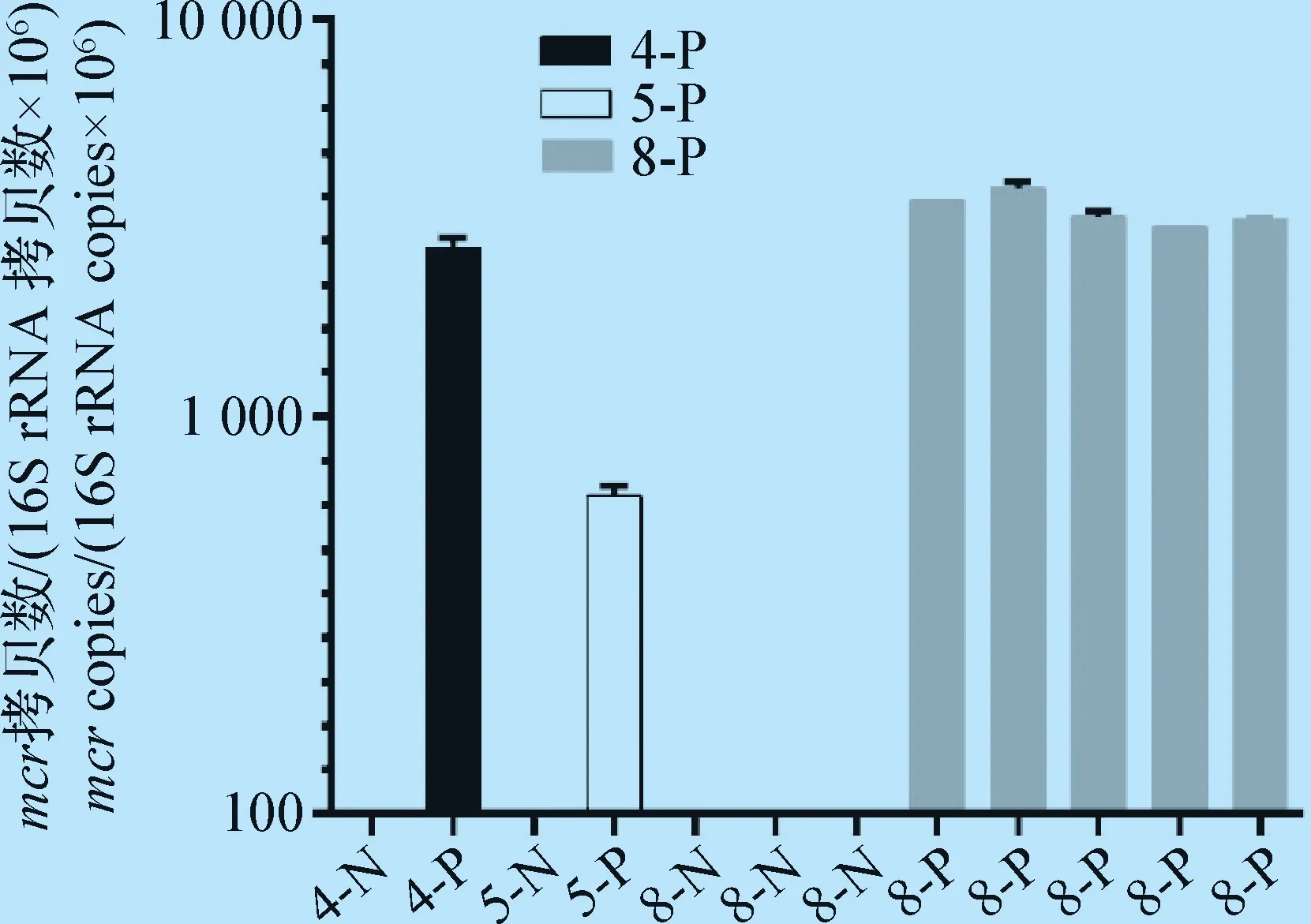
图4 菌液中mcr-4/5/8基因的检测Fig.4 Detection of mcr-4/5/8 genes in bacteria4-N/4-P:mcr-4阴性/阳性样本;5-N/5-P:mcr-5阴性/阳性样本;8-N/8-P:mcr-8阴性/阳性样本4-N/4-P:mcr-4 negative/positive samples;5-N/5-P:mcr-5 negative/positive samples;8-N/8-P:mcr-8 negative/positive samples
3 讨论
本试验采用了一种新型的PCR方法——实时荧光定量PCR,即通过向反应体系中加入一定量的SYBR荧光基团,使反应体系随着基因的扩增增加荧光信号的强度[5]。SYBR荧光基团可以与DNA双链进行特异性结合。只有与DNA双链特异性结合的荧光染料才可以发射出荧光信号,因此,荧光信号的增加和目的基因的增加在整个过程中是完全一致的,由此可实现样本的定量检测[6]。相对于传统PCR来说,具有方便、快捷、准确等优势[5]。该方法目前应用于各个领域,如临床疾病诊断、动物疾病检测、食品安全、科学研究以及相关行业,运用范围广泛。
随着多重耐药革兰阴性菌的广泛增多,多黏菌素在临床上的使用日益增加。2015 年,多黏菌素耐药基因mcr-1 在我国首次被报道[7]。2016年,在芬兰发现了人类临床上首株携带mcr-1 基因的多黏菌素耐药菌[8]。随后,mcr基因的各个变异体开始相继出现(表3),引起了全世界的广泛关注。多黏菌素耐药基因的出现给人类一个严重的警告。因此,构建多黏菌素耐药基因的快速筛选方法十分必要。目前,Li等已经构建了针对mcr-1/2/3的多重实时荧光定量PCR方法,可以从临床和环境样本中快速且有效地检测出耐药基因[9]。Rebelo等开发了一种用于检测mcr-1/2/3/4/5的多重PCR方法,可以单独或组合用于肠杆菌科细菌中的可转移的多黏菌素抗性基因的检测[10]。最近,有一篇关于mcr-8基因的实时荧光定量PCR方法的报道,该方法可以从临床样本中准确、高效地检测出耐药基因[11]。随着多种mcr变体的出现和流行,从不同样品中筛选耐药基因mcr-4/5/8也是十分有必要的。本试验首次构建了针对这3种多黏菌素耐药基因的多重实时荧光定量PCR检测方法,不仅可以在培养的细菌中,还可以直接从粪便和土壤样本中耐药基因mcr-4/5/8进行筛选。试验结果表明,本试验建立的荧光定量检测方法具有非常高的灵敏度,其中,mcr-4/5/8的检测限分别为3.4×100~7.9×108、1.4×101~1.0×109、2.9×101~2.4×108拷贝/μL,检测灵敏度最低可以达到3.4个质粒拷贝数。本次试验未能在环境样本中检测出耐药基因mcr-4/5/8,较难评估mcr-4/5/8在畜禽养殖场中的流行情况,这可能与有限的环境样本数量有关,也可能与这3种基因在全国范围内的流行特点有关。但是,通过标准曲线相关数据以及阳性菌株的验证结果,已经充分证明了本试验所建立方法具有高度的重复性和特异性。
表3 mcr-1及其各变体Table 3 mcr-1 and its variants
mcr-1是国际上首次发现的由质粒介导的多黏菌素耐药基因,该基因的出现加速了多黏菌素耐药性在细菌之间的传播。多黏菌素是目前治疗多重耐药革兰阴性菌的最后手段,mcr-1及其变体的出现和广泛流行给临床治疗感染性疾病造成了严重的威胁。本试验建立了针对耐药基因mcr-4/5/8的快速检测方法,能够更好更快地从临床和环境样本中筛选出这3种耐药基因,为畜牧生产和临床上控制此类耐药细菌传播和相关耐药性研究提供一定的帮助。
总之,本试验所构建的实时荧光定量PCR检测方法,能够快速、特异、灵敏地检测出菌液、粪便以及土壤样本中的mcr-4、mcr-5或mcr-8基因,且该方法适用于任何具有荧光定量PCR仪的实验室,方便快捷、容易操作,可用于评估人类和动物中该药物抗性的流行程度[9]。

