快速液体培养法在结核分枝杆菌分离培养中的应用研究
李青,彭章丽,陈玲△,徐鹏,付雪峰
(1遵义医科大学附属医院呼吸与危重症医学科结核病区,贵州 遵义;2遵义医科大学生命科学研究院 贵州省普通高等学校传染病与生物安全特色重点实验室,贵州 遵义)
0 引言
结核病由结核分枝杆菌感染引起,是目前全球范围内头号传染病杀手,也是全球范围内导致死亡的十大疾病之一。抗酸染色法是临床上最便捷快速的诊断方法[1],但敏感度偏低,且无法区别结核分枝杆菌复合群(mycobacterium tuberculosis complex,MTBC)与 非 结核分枝杆菌(nontuberculous mycobacteria,NTM)。结核分枝杆菌分离培养是确诊结核病最重要的依据,不仅能取得病原学结果,还能提供活的菌株和细菌组DNA,进行传统药敏检测,指导临床治疗,可以进行全基因测序等获取菌株的分子生物学信息[2,3]。目前改良罗氏固相培养法(lowenstein-jensen,L-J)是最流行的培养方法,也是结核病诊断的金标准,但该方法耗时长,给早期诊断和治疗带来巨大阻碍。快速液体培养是新的分枝杆菌培养方法,不但能较快地发现结核分枝杆菌[4],并且具有良好的菌株回收率。为此,本研究对本实验室随机收集的120份标本进行快速液体培养法和改良固体罗氏培养法的对照研究,验证快速液体培养法在结核病诊断中的准确性,评价它的优缺点。
1 资料与方法
1.1 标本来源
本院呼吸医学研究室收集的疑似或确诊结核病患者的痰标本101份,肺泡灌洗液9份,脑脊液2份,胸腔积液7份,腹腔积液1份,共计120份(标本收集符合遵义医科大学附属医院伦理委员会所指定的伦理学标准,并取得该委员会批准,受试者均签署知情同意书)。其中男78例,女42例,年龄14-88岁,中位年龄56岁;其中76份痰标本分别进行抗酸染色(Ziehl—Neelsen,萋-尼法)镜检、改良罗氏(L-J)培养和快速液体培养法;44份标本进行Gene-Xpert MT/RIF、改良罗氏培养法和快速液体培养法。痰标本要求为黏液痰、脓痰、干酪痰或血痰,所有标本体积不少于2ml。
1.2 仪器及试剂
抗酸染色液、快速液体培养试剂由珠海贝索生物技术有限公司提供(抗酸染色液 货号BA-4091;培养管 货号BC9000;NALC法痰消化缓冲液 货号BC1999;分枝杆菌液体培养添加剂 货号BC9003);改良罗氏培养基使用珠海市银科医学工程股份有限公司产品(货号:1912131);Gene-Xpert MTB/RIF样本消化液及反应盒购于美国赛沛公司(货号:1000166397)。相关仪器:离心机(长沙湘仪公司);振荡器(中国上海沪西分析仪器厂);生物安全柜(美国Thermo公司);显微镜(日本Olympμs公司);分枝杆菌荧光检测仪(珠海贝索生物技术有限公司);Gene-Xpert MTB/RIF检测仪器(美国赛沛公司)。
1.3 方法
1.3.1 痰抗酸染色
萋-尼染色镜检:参照《结核病实验室检验规程》抗酸杆菌显微镜检查标准化操作程序及公司说明书进行萋-尼染色和显微镜镜检[5]。
1.3.2 Gene-Xpert MTB/RIF
参照试剂盒说明书,将标本 ( 痰、肺泡灌洗液、脑脊液、胸腔积液、腹腔积液) 与含氢氧化钠及异丙醇的标本处理液按体积比1:2混合,震荡混匀,室温静置15min,待标本完全液化后取2ml混合液转移至反应盒中,置于Gene-Xpert检测仪器进行全自动检测,约2h即可在检测软件窗口直接读取结果。
1.3.3 改良罗氏法[5]和快速液体培养法
试剂配制:标本处理/去污染试剂0.5gNALC加入100ml痰消化缓冲液;分枝杆菌液体培养添加剂培养液1瓶BASO营养剂复1瓶BASO 抑菌剂,每支BASO分枝杆菌液体培养管中加入0.8ml添加剂复溶物。
标本前处理及接种:①将痰抗酸染色或Gene-Xpert MTB/RIF检测剩余的痰、肺泡灌洗液、脑脊液等直接转移至 50ml离心管中,胸腹腔积液均全部离心后取沉淀转移至50ml离心管中,视标本性状加入1-2倍标本体积的新鲜配制的标本处理试剂,旋紧盖子,振荡30-60s,室温静置15 min。②加入1×PBS 缓冲液至45ml,上下颠倒混合均匀,3000×g离心20min后弃上清,加入1×PBS缓冲液1 ml混匀。③取500μl样本接种到液体培养管中并旋紧盖子上下颠倒混匀,取500μl接种到改良罗氏培养基中并使液体均匀分布于培养基中,37℃培养箱培养。
1.4 结果判读
1.4.1 抗酸染色的结果判读
蓝色背景下抗酸杆菌呈红色,外形细长或略弯曲及有分枝生长趋势,结果判断参照《结核病实验室检验规程》。
1.4.2 Gene-Xpert MTB/RIF结果判读
检测软件窗口直接读取结果,包括MTB阳性,检出高;MTB阳性,检出中;MTB阳性,检出低;MTB阳性,检出极低;MTB阴性。
1.4.3 液体培养结果判读
从培养的第2 d开始每24 h使用分枝杆菌荧光检测仪进行检测,荧光值≤12 为阴性,≥13 为阳性,报告阳性后继续培养24 h,再检测确认并进行萋-尼染色复检(从培养管底部吸取部分标本进行涂片抗酸染色,证实为抗酸分枝杆菌后报告分枝杆菌培养阳性,此抗酸染色阴性并确认无脱片等情况后报告污染);标本培养42 d分枝杆菌荧光检测仪检测仍提示为阴性结果时,报告分枝杆菌培养阴性。
1.4.4 改良固体罗氏培养法结果判读
温箱孵育接种后第3d、第7d分别观察菌落的生长情况,以便发现污染情况和非典型性结核分枝杆菌的生长。以后每周观察1次结果,若发现呈菜花状表面粗糙的米黄色或白色菌落生长者,经抗酸染色证实为抗酸分枝杆菌,则报告分枝杆菌培养阳性;若培养60d后仍无菌落生长,则报告分枝杆菌培养阴性。
1.4.5 质量控制
本实验操作人员均参加并通过中国疾病预防控制中心组织的结核病实验室培养及药敏测试和全国结核病分子诊断技术能力验证等培训及考试。
1.5 统计学处理
实验数据采用GraphPad Prism 6软件进行统计分析,分别计算改良罗氏(L-J)培养和快速液体培养法的阳性率、污染率、培养时间,计算两种培养方法与抗酸染色镜检或Gene-Xpert MTB结果的阳性符合率等;计量资料采用配对设计的t检验进行分析,计数资料采用配对设计的卡方检验进行分析,以P<0.05为差异有统计学意义。
2 结果
2.1 两种培养方法的阳性率比较
在所有120份标本中,改良罗氏(L-J)培养和快速液体培养法的阳性率分别为54.39%(62/114)和53.91%(62/115),差 异 无 统 计 学 意 义(χ2=0.0037,P=0.95),联合培养的阳性率为70.83%(85/120),与单独使用一种培养方法比较,差异有统计学意义(P<0.05)。两种方法的污染率分别为5.00%(6/120)和4.17%(5/120),差异无统计学意义(χ2=0,P=1)。
76例(表1)进行痰抗酸染色、改良罗氏(L-J)培养和快速液体培养法的标本中,抗酸染色与两种培养方法的阳性符合率分别为78.26%(36/46)和82.61%(38/46),差异无统计学意义(χ2=0.069,P=0.263);两种培养方法在抗酸染色阳性标本中的结果符合率为82.61%,在抗酸染色阴性标本中的结果符合率为66.67%,总结果符合率为76.32%。44例(表2)进 行Gene-Xpert MTB/RIF、改良罗氏(L-J)培养和快速液体培养法的标本中,Gene-Xpert MTB结果与两种培养方法的阳性符合率分别为48.57%(17/35)和51.43%(18/35),差异无统计学意义(χ2=0,P=1),两种培养方法在Gene-Xpert MTB阳性标本中的结果符合率为62.71%,在Gene-Xpert MTB阴性标本中的结果符合率为100%,总结果符合率为72.73%;改良罗氏(L-J)培养法和快速液体培养法在所有标本中的结果符合率为75.00%,在抗酸染色标本和Gene-Xpert MTB检测标本之间的结果符合率差异无统计学意义(χ2=0.048,P=0.827)。
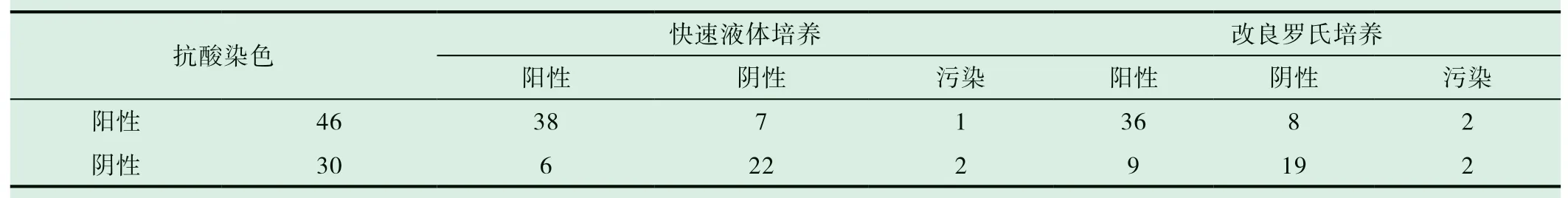
表1 抗酸染色标本的两种培养方法比较(n)
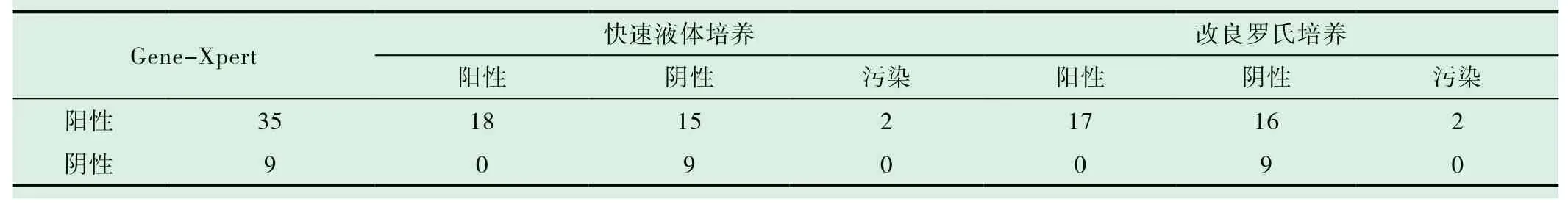
表2 Gene-Xpert MTB标本的两种培养方法比较(n)
2.2 两种培养方法的培养时间比较
在所有120份标本中,改良罗氏(L-J)培养法的平均培养时间为(23.68±1.43)d,快速液体培养法的平均培养时间为(9.74±0.70)d,P<0.0001,差异有统计学意义;在痰抗酸染色阳性标本中,两种培养方法的平均培养时间 分 别 为(21.03±1.87)d和(8.13±0.42)d,P<0.0001,差异有统计学意义;在Gene-Xpert MTB阳性标本中,两种培养方法的平均培养时间分别为(29.88±2.93)d和(13.94±1.93)d,P<0.0001,差异有统计学意义;由于痰抗酸染色阴性标本数量较少,故未做统计分析,两种培养方法在Gene-Xpert MTB阴性标本中均未有阳性结果,故无法计算平均培养时间。
3 讨论
结核分枝杆菌的改良罗氏(L-J)培养法是结核病诊断的金标准之一,但由于培养时间长、阳性率低等原因,不利于患者的及时治疗以及传染源的控制,在基层医疗机构中没有普遍开展[6]。寻求比改良罗氏(L-J)培养法诊断效率更高或培养周期更短的结核菌培养方法一直是结核病诊断的研究热点,此前文献报道了MACTECTM MGITTM 960全自动分枝杆菌快速培养药敏分析系统的阳性率和培养阳性周期均明显优于改良罗氏(L-J)培养法[6,7],但由于设备昂贵,无法在我国普及,尤其是在基层医疗单位和疾控中心。
本研究结果表明,快速液体培养法与改良罗氏(L-J)培养法相比,在阳性率、污染率之间差异无统计学意义;说明快速液体培养法拥有同改良罗氏(L-J)培养法一样的灵敏度和特异度。此外,由于Gene-Xpert MTB的检测灵敏度高于抗酸染色,而检测灵敏度与细菌载量有关,所以两种检测阳性的标本中细菌载量可能不同,因此,分别对抗酸染色或Gene-Xpert MTB标本都进行两种培养方法培养,对结果进行分层分析发现,痰抗酸染色或Gene-Xpert MTB与两种培养方法的阳性符合率之间的差异也无统计学意义,两种培养方法在所有抗酸染色或Gene-Xpert MTB标本中的结果符合率之间的差异同样无统计学意义;但抗酸染色阳性标本的结果符合率高于Gene-Xpert MTB阳性标本,这证明了我们的猜想,无论是固体培养还是液体培养,培养阳性率都可能与标本中细菌载量有关。
我们还发现联合培养的阳性率达70.83%,与单独使用其中一种培养方法的阳性率相比均明显提高了阳性率,差异均具有统计学意义,高于此前Somoskövi A 等所报道的结果,且我们的研究未出现两种培养方法同时污染的标本,有效降低了污染率,这说明联合两种方法进行培养既可以提高阳性率,也能有效降低污染率,提高了菌株回收率,能为进一步的药敏试验或全基因组测序等提供更多的标本,有利于患者的诊断和治疗。
与改良罗氏(L-J)培养法相比,快速液体培养法无论是在所有标本中,还是在抗酸染色阳性或Gene-Xpert MTB阳性标本中都大大缩短了培养时间(平均缩短2周左右),差异有统计学意义,这为临床及早诊断、制订个性化治疗方案提供了更加及时、准确的临床依据,该结果与此前报道的多数相关研究相似。除培养阳性率与标本中细菌载量有关外,培养阳性结果检出时间也与之相关。
病原学检测是结核病诊断的金标准,抗酸染色法是临床上最便捷快速的诊断方法,但敏感度低且无法区别MTB与NTM;GeneXpert MTB/RIF和环介导等温扩增法均为分子检测手段,检测时间短,能较快地进行分枝杆菌核酸检测[8-10],GeneXpert MTB/RIF还能获得利福平耐药信息,但这两种方法不能获得MTB菌株,也不能进一步进行其他抗结核药物的耐药性检测及全基因测序等深度分析;分枝杆菌培养的优点是可以获得患者不同时期的菌株并可以进行大多数抗结核药物的耐药性检测及进行全基因组测序[2,3],可以对菌株的进化及疾病的发生发展传播等提供有力依据,并且有文献报道,分枝杆菌培养技术在痰和肺泡灌洗液中的阳性检出率高于痰抗酸染色和GeneXpert MTB/RIF[11],但分枝杆菌培养的缺点也很明显,就是检测时间长,尤其是改良罗氏(L-J)培养,培养时间长达4-8周,严重影响了患者当前的诊断和治疗。因此,探索既能保留分枝杆菌培养的优点,又能实现快速检测的方法是当前结核病诊断技术开发的重要研究方向。
本实验采用的快速液体培养法是我国自主研发的手工荧光读数仪,操作简单,方便易行,目前已在国内多个省份的基层医院和疾控中心中推广,因此,快速液体培养法是一种比较理想的分枝杆菌快速培养方法,设备简单、操作便捷,与改良罗氏(L-J)培养相比同样具有敏感度高、特异性强、符合率高的特点[12]。是一种快速、经济、实用、有效的检测方法,适合在基层结核病防治结构推广应用。

