以制度护航伦理:美国大学科研立项的准入制度研究
李函颖,李 娜
(华中科技大学教育科学研究院,湖北 武汉 430074)
0 引言
科学研究从来不只是学术界的内部活动,整个研究过程中所涉及的研究人员、研究对象及其之间的交往都应遵循社会责任,即受科研伦理的约束。2019年美国兰德公司在 《科学研究中的伦理》中指出,世界各国在不同时期、不同文化背景下对研究伦理的标准表述和执行监督本就存在差异,旁观者风险、大数据、公众参与科学等新兴议题的出现又将进一步推动科研伦理规范的变化。基于此,兰德公司明确指出,科学研究应警惕 “伦理规避”隐患,即指在伦理道德准则严格的国家接受培训的研究人员到伦理道德准则和监管松散的国家进行研究活动,其目的不是研究当地人民,而是绕开本国的法律法规、政策或程序[1]。在中国,虽然不少高校也设有伦理审查委员会,但此类建制的系统性不强,多集中在研究型大学;覆盖学科领域不全,多集中在医学、生物学等学科领域;审查内容覆盖范围有限,仍主要关注受试者保护,存在诸多领域空白[2]。随着高等教育国际化的推进,高校师生的跨境流动已是常态,科学研究的国际合作程度持续提升,但科研管理制度的国际性尤其是其伦理监督功能仍有待进一步提升。为此,本文对美国大学的科研立项准入制度展开研究,以期为中国研究者开展他国实地调查提供制度准备,同时也为中国高校科研管理制度的改进提供借鉴。
科研立项准入制度是保障科研伦理的重要前提,在学术规范化的过程中发挥了巨大的作用。实地调查研究强调研究者与被调查者之间的对话和互动,研究者如何在有序开展研究的同时保护研究对象的权利与隐私至关重要。美国是最早建立科研审查机构的国家之一,具备较为完善的科研审查制度。依据联邦通用准则,各大学里的研究人员在从事以有生命体为被试的生物医学、社会和行为研究时必须接受院校审查委员会 (Institutional Review Board,IRB)的审查和监督。IRB的审查对象不仅局限于获得经费资助的研究项目,还包括基于个人兴趣的自由探索项目,是实地调查研究的重要制度保障。具体而言,IRB的身影贯穿科研项目的始终,包括项目申请前的教育与培训、申请时的材料审核与评估、申请后的过程监管。
1 项目申请前的教育与培训
科学研究的前提条件是遵守学术伦理。在美国,学术伦理并不仅是研究者间的 “公约”,更是有专门的机构及制度予以护航,各类科研基金及高校在审核涉及人类被试的科研项目时都有学术伦理方面的强制性要求。这种制度环境催生了多种以学术伦理为主要内容的教育与培训,如美国卫生部人类研究保护办公室 (Office for Human Research Protections,OHRP)与其下属的教育与发展司 (Division of Education and Development,DED)开发的免费课程,迈阿密大学医学院与福瑞德哈金森癌症研究中心共同开发的营利性课程CITI (Collaborative Institutional Training Initiative)项目等。其中,CITI项目被应用得最为广泛,其在美国甚至全球受到2200多家科研机构和医疗学术机构近160多万人的认可[3]。
1.1 CITI项目的课程类型与内容
CITI培训项目初创于2000年,早期主要关注人类研究 (Human Subjects Research,HSR)中的保护措施,其具体培训内容由来自迈阿密大学、华盛顿大学、达特茅斯学院等机构的诸多专家共同开发。2004年,其培训人群扩展至社会与行为科学的研究者,具体培训内容由来自美国心理学会、哥伦比亚大学、杜克大学等机构的专家开发。目前,CITI的培训内容囊括近二十几个学科领域 (如动物护理与使用、临床研究协调员、灾害规划、出口管制、信息隐私与安全、责任行为研究等),培训对象涉及科研人员、IRB成员与主席、院校办公室员工等群体[4]。
在多个课程模块中,HSR最先设立且影响最广,也是从事教育类实地调查的科研人员必须要通过的指定课程。HSR主要提供有关人类研究的基础培训,包括人类研究保护的历史发展、相关伦理问题、现行规章以及指导信息等内容,旨在帮助相关组织和个人了解人类研究的保护措施。具体而言,HSR主要指向两类学科领域:生物医学 (Biomedical)及社会-行为-教育 (Social-Behavioral-Educational,SBE),每类学科领域均由基础课程和进阶课程组成,生物医学领域共3门进阶课程,SBE则是2门[5]。基础课程是强制性课程,是科研项目正式立项的敲门砖。进阶课程并非强制性要求,而是由研究者所在机构决定,一般是在基础课程结束后的一定时间内完成。本文主要以杜克大学团队主导开发的SBE基础课程为例进行说明。目前SBE基础课程共包括15个知识模块,其中10个属于必修模块,另外5个知识模块可根据科研项目的特殊性选修 (见表1)[6]。
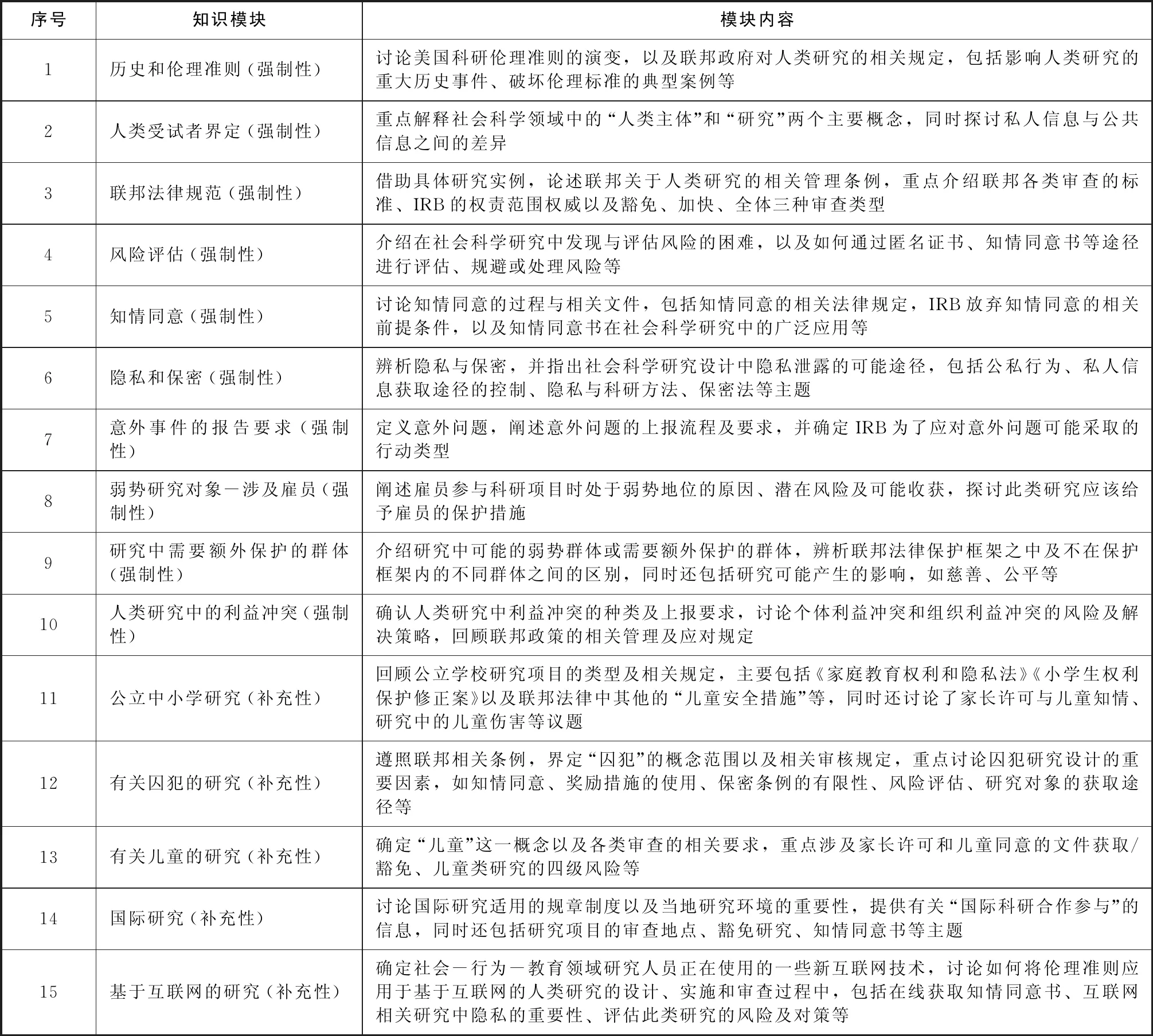
表1 SBE基础课程
基础课程与进阶课程的目标人群除了科研项目成员外,也包括IRB成员。作为IRB成员,除了应对有关社会行为课程的科研规范与知识有一定的储备外,还要熟知IRB的运作程序以及审查议程,以求能够正确运作这些规则[7]。基于此,CITI为IRB成员开设了从事科研审查的专业培训课程——院校官员课程和IRB主席课程。院校官员课程主要包括学院及大学、IRB机构、研究场地等机构的组织架构介绍,院校官员的角色与职责,人类研究保护项目的相关规定等方面。IRB主席课程则更关注IRB中各成员的角色与职责、IRB会议的职责、主席在IRB会议之外的角色等相关内容[8]。
1.2 CITI项目的授课方式
能够真正结合学习者的需求,灵活、人性化地进行课程的讲授与培训,这是CITI培训项目的突出特点。CITI课程主要以在线自学为主,在开课之前,CITI会发电子邮件提醒学生在规定时间内进行相关课程学习。具体而言,每个模块的学习内容不一,注重文字、图片、案例等多形式呈现,每个模块都会有一个小考,通过小考才算完成学习。通常,研究者完成一个模块学习需花费10~20分钟。未通过小考的模块内容可以不限次数地重复学习,每次小考的内容不全相同。以SBE基础课程为例,该课程的整体学习时长为2~3小时,所有模块小考的总成绩达到80分以上 (满分100分)的研究者才能获得CITI课程合格证。每门课程的合格证都有一定的有效期,基础课程的合格证一般每隔3年更新一次,进阶课程的合格证一般每隔5年更新一次。
CITI课程内容非常丰富,每门课程都有对应的价格与学分。研究者如果以个人身份参与CITI培训,则需缴纳一定的课程费用,若所在高校或科研机构已经以组织身份购买课程使用权限,研究者个人则无须缴纳任何费用。
2 项目申请时的材料审核与评估
完成科研伦理类课程的培训表明研究人员已经具备一定的科研意识,是研究者有资格从事科学研究的第一步。美国联邦卫生与公共服务部 (DHHS)的45CFR46条例规定,科研项目正式立项还需研究者通过立项机构所设立的IRB评估。美国几乎所有的研究型大学都设有校内IRB,负责审查涉及自己学校的科研项目。一些学校甚至设有多个IRB,分别负责审核不同领域的科研项目。例如,斯坦福大学共有8个IRB,其中7个负责生物医学审查,1个负责社会科学领域的审查[9]。哈佛大学共有大学区、医学院和公共卫生学院3个IRB[10]。此外,一些文理学院甚至社区学院也接受了联邦范围认证,设有本学院的IRB。
根据联邦通用准则,每个IRB至少由5名成员构成,其中至少1名为科学家、1名为非机构成员。此外,考虑到种族、性别、文化背景以及敏感性等多样性问题,IRB不得完全由同一性别或者同一职业的成员构成。当科研项目超出IRB成员的研究领域时,IRB也会邀请相应领域的专家作为顾问,但顾问专家不具投票权[11]。当然,IRB在遵行联邦政策法规的同时,也可以根据学校情况做出相应调整。斯坦福大学规定,IRB委员会中应该包括1名由斯坦福大学学生会 (ASSU)选出的具有研究经验的高年级学生和1名州政府官员,且该校有2个IRB要求至少有6个以上的成员[12]。
就具体项目审查而言,虽然有些大学 (如佐治亚大学)明确要求项目负责人 (Principle Investigator,PI)必须出席全体审查 (可以电话或视频形式)[13],但大部分学校的IRB成员很少能够与项目申请者直接接触。因此,科研项目最终能否顺利立项主要通过研究者提交的申请材料进行判断[14]。申请材料主要包括研究目的、研究方法、研究者人员资格、知情同意书、受试者选择、研究中涉及风险及利益等内容,其中研究人员资格、知情同意书以及研究内容是IRB的审查重点。
2.1 研究人员资格
研究人员资格是科研立项审查的首要环节。目前,美国大学的IRB主要对校内正式教职工、学生以及国外访问学者三类人员开展科学研究做了资格规定。对于校内教职工,IRB直接认可教授、副教授、助理教授、高级讲师等校内研究人员独立开展科学研究的能力,但普通讲师等职称较低的教职工则必须经过分管科研的副校长或者科研院长的批准或有教师顾问 (Faculty Adviser)指导才具有研究资格[15]。对于校内学生群体,多数学校都明确规定学生不能独立申请科研项目,他们必须有专任教师作为PI[16]。一般而言,PI都是对科研规范较为熟知、学术能力较强的研究者,但各校要求并不一致。例如,哈佛大学明文规定学校能够担任PI的学者只能是教授、副教授、助理教授、科研教授以及高级讲师,兼职教授或者普通讲师则没有资格[15]。而佐治亚大学对于PI的资格则控管宽松,几乎只要与学校有聘任关系的雇员 (全职以及兼职)都能担任PI[17]。PI主要负责监督所有研究人员遵守学校以及联邦法律法规、帮助研究者熟知科研审批程序、增强其科研伦理意识,保障科研项目的顺利开展。对于国外访问学者/学生,多数学校的要求与校内学生一样,即他们在开展科研项目时必须有本校教师作为PI或者教师顾问。若他们能够得到分管科研的副校长或科研院长的批准,则有资格独立开展科学研究[18]。
IRB也有针对跨机构合作研究的规定,即分属不同学校的研究人员进行合作研究时,须分别向其所在学校的IRB提交审批申请。若一方学校的IRB要求研究人员更改申报材料,研究人员需及时向另一所大学的IRB呈报[19]。属于某大学内部的研究人员在国外进行人类研究项目时,其研究仍受本校的科研管理条款、联邦法律和联邦下属工作机构指导方针的约束。
2.2 知情同意
知情同意是联邦法律明确规定的、IRB在审查过程中必不可少的审查项,是保障被试知情权的重要途径。知情同意包括为参与者提供有关研究的充足信息,确保参与者理解这些信息并且充分考虑是否参加研究。知情同意的载体多为知情同意书,知情同意书一般包括8个方面的内容:研究目的、时间、进行方式;研究风险;受访者权利;可能的利益;记录的保密性;研究结果的发布方式;未成年人特定约束条件;联系信息以及知情同意书副本[20]。另外,知情同意的内容和呈现方式必须考虑被试的理解能力。例如,加州大学伯克利分校规定,知情同意书的文字表达要清晰易懂,最好不能超过8年级学生的阅读水平,否则知情同意书将不会被IRB认可[21]。
2.3 研究内容与审查类别
研究内容是科研立项审查的核心工作,涉及研究对象、研究方法等。研究内容直接关系着科研项目接受IRB审查的类别。IRB的审查类别共有三种:豁免审查 (exempt review)、加快审查 (expedited review)和全体审查 (full board review)。
根据联邦准则45CFR46 101 (b)的相关规定,符合正常的教育实践 (如对某种教学法的实证考察)、公开的数据搜集 (对年满18岁及以上人员的工作满意度调查)、教育测试 (认知、诊断、能力、成就等)、公共行为的观察、食品质量评价、消费者口味研究以及仅限于教育测试而不涉及被调查者的个人隐私这六种类型的研究都可以通过豁免审查,但涉及弱势群体的研究 (儿童、孕妇、囚犯等)除外[22]。各大高校IRB除了遵循六大豁免类型外,也可以依据学校实际情况有所调整。密歇根大学规定焦点访谈、观察与数据收集以及由密歇根州主办的研究和示范项目也都在豁免审查之列[23]。需要指出的是,尽管豁免审查不需要IRB的监督,但是科研项目能否获得豁免审查的资格不由研究人员自行决定,而是取决于IRB的研判。
加快审查属于非全体IRB委员审查,是由IRB主席指定部分有经验的IRB成员完成程序性审查和主题性审查。若被指定的IRB成员无法完成主题审查时,IRB会从校内或校外特聘1位相关领域的专家协助完成研究方法、目标群体、理论框架等内容的审查。符合加快审查的研究项目主要是仅仅给被试带来最低风险,并且符合美国卫生和人类服务部与食品药品管理局提出的七类加快审查类别之一的研究。七类研究中社会科学研究主要涉及三类:对现有或未来数据的二次收集,如分析学生的教育记录,不同经济和民族背景与学生学业成绩之间的关系;为研究目的收集来自语音、视频、数字或图像记录的数据,如通过视频录像对商业组织中员工沟通方式进行观察的研究;使用调查、访谈、口述史等方法对个体或团体的行为特征进行研究,如中学教师和学生使用小组讨论来评估学校的社会课程[24]。一般而言,加快审查耗时2周左右,但也可能会因科研项目的材料质量或审查意见不一等因素有所差异。
全体审查的对象主要是不符合以上两类审查的科研项目,或研究中涉及易受伤害的人群,或研究过程中有关信息可能会公开发表等,如教师行动研究、社区参与式研究、生物医学领域的临床试验等。一些专为研究生开设的定性研究方法课程也需要全体审查,且需要三个多月才能顺利获批[25]。全体审查是教育研究审查中最常见的类型,IRB的全体审查会一般每月召开一次,与会成员必须超过半数。若某一领域的专家缺席会议,那么,相关领域的科研申请须另择期审查。项目审查时长一般是6~8周,当然还需根据IRB的工作量和其他规定而定,如佐治亚大学规定校内全体审查前必须进行初审,初审与全体审查之间至少间隔3周[13]。
上述三类审查均可能出现以下四类结果:批准、有条件批准、延期、反对。有条件批准与延期一般要求项目申请者根据反馈意见做相应调整或补充更多信息,直至最终通过IRB审查。密歇根大学、杜克大学等学校的IRB审查标准都基本遵循以下原则:被试选择合理;研究获得被试知情同意书;研究保证被试隐私;对孕妇、儿童、犯人等弱势群体都有额外保护;对被试产生的研究风险最小[26]。
3 项目立项后的过程监管
科研项目顺利通过IRB的初步审查后就基本获得能够进入实地调查现场的 “许可证”,但许可证并非终身制。一般来说,接受联邦资助的研究项目需要每年至少接受1次定期审查,非联邦资助项目则至少每3年被审查一次。也就是说,科研项目在开展过程中仍需接受IRB的实时监管,以确保被试在研究环境改变时仍能被保护合法权益,未通过过程监管的研究项目随时有可能被取消研究资格。
IRB主要采用两种监管方式:中期变更监管和定期监管。中期变更监管是指在许可证的有效期内,凡是涉及研究协议变更及不良事件、研究对象或内容变动等变更,研究者都需要及时书面通知IRB,详述变更原因,重新接受IRB的审查。对于事先没有经过IRB审批的科研项目,研究项目可能会被终止且失去获得联邦资金拨款的机会,研究人员也可能面临解雇的风险,出版此类研究的期刊或者相关文献机构也会面临严重的制裁,因此,违规行为的风险较大[27]。定期监管则主要是指IRB对许可证即将失效但研究项目仍未完成的项目,如持续搜集或分析被试的个人信息,或者被试持续增加的长期项目,甚至数据采集工作已彻底完成等情形,在许可证失效前进行的再次审查[28]。
4 美国大学科研项目准入制度的成功经验
从最初生物医学领域的运用到现在社会科学领域的普及,科研准入制度的作用领域已不仅局限于科研伦理的审查,其同时涉及研究方法、理论框架等知识性审查,是在美国境内开展实地调查需要跨越的重要门槛。不可否认,大学科研立项的准入制度保障了科研项目的规范性运作,值得中国学习。
4.1 以法律条例护航科研准入制度的伦理基石
科研准入制度最初也是最核心的任务就是保障科研伦理。继 《纽伦堡法典》 《赫尔辛基宣言》后,美国卫生、教育和福利部 (Department of Health,Education,and Welfare)也于1978年公布了适用于生物医学、社会科学领域的 《贝尔蒙报告:保护参加科研的人体实验对象的道德原则和方针》,提出有关人体试验的三大普适性原则:尊重、合乎善行、体现公平[29]。为了践行 《贝尔蒙报告》的主张,各级政府出台了多项相关法律条例。例如,联邦卫生与公共服务部的45CFR46条例;联邦食品和药品管理局 (Food and Drug Administration,FDA)专门针对生物医药领域出台了21CFR50、21CFR56条例;联邦教育部制定的 《学生权利保护修正案》 (Protection of Pupil Rights Amendment)和 《家庭教育权利和隐私法》 (Family Educational Rights and Privacy Act)第99部分也是科研审查过程中重要的法律依据。此外,密歇根州卫生与公众服务部 (Michigan Department of Health and Human Services)还针对IRB出具专门的指导规范,从州政府层面明确规范研究机构科研审查程序以及审查类型[30]。
4.2 以经济杠杆助推科研准入制度的参与度与程序完善
法律形式之外,科研经费也是联邦政府发动大学参与科研立项审核的助推工具。在美国,联邦政府的科研经费投入一直在高等教育科研经费投入总额中居于高位 (虽自2011年来占比份额逐年下降,但仍保持在53%以上)[31],2011年以来,其下属的6个职能部门 (卫生部、国家科学基金委、农业部、能源部、宇航局、国防部)的科研经费支出总额占联邦政府资助的科研支出经费份额的91%[32]。大学有无设立IRB或者IRB是否获得联邦范围认证 (FWA)的承诺书,将会影响到联邦政府对该大学科研经费的拨款力度。基于这一链条关系,多种类型的大学均积极参与到科研准入制度的构建过程中。例如,密歇根大学为使研究者尽快熟知研究申请流程专门出台了 《人类研究保护计划操作手册》,对IRB功能、实施情况、协议书写作、审查前的科研培训进行了详细说明[33]。著名的文理学院——阿姆斯赫特学院 (Amherst College)也针对人体研究项目发布了IRB审查指南,对IRB的运作及被试保护等信息做了明确规定[34]。而历来以教学为重心的社区学院也因为教师科学研究项目的开展,开始陆续设置IRB审查机构,2014年时全美已设立IRB的社区学院共有112个[35]。
4.3 以第三方参与提升科研准入制度的专业性与客观性
美国大学的科研立项准入制度在多个环节都十分强调专业性,如前期的人员教育与培训、研究许可证的审查,甚至整个IRB机构的认证与审查。在市场化体制下,不少专业的第三方机构参与到这一过程中来。以前期培训课程为例,联邦教育与发展司免费为研究人员和审查委员会成员提供伦理培训的视频教材 (少于15分钟),定期开展网络研讨会等[36]。密歇根大学也开发了服务校内研究项目的在线培训课程,课程有效期为3年[37]。本文重点介绍的CITI课程就是由第三方机构开发的专业培训课程,以系列课程的形式提升研究人员以及IRB评审双方的伦理意识和权责意识。此外,以美国人体研究保护项目认证协会 (Association for the Accreditation of Human Research Protection Programs,AAHRPP)为代表的第三方认证机构也积极参与到研究机构的认证与评估中,他们以高伦理、高科学为标准,以现场调研、专家评估为主要评价方式。截至2021年2月,AAHRPP已完成257个组织的认证,其中有44个组织来自美国以外的地区。超过60%的美国研究型大学和超过65%的美国医学院不是通过了AAHRPP认证,就是已经开始了接受认证的过程[38]。可以说,第三方机构的加入有力地保障了科研审查的专业性与客观性,同时这种监管与约束也有利于提升公众的科研信任度。
4.4 以专业人士保障科研准入制度的科学性
随着大学科研准入制度的日臻完善,科研伦理已不再是其唯一的评价内容,研究方法、理论基础等涉及科学性的内容评价的重要性逐步彰显。为此,不少IRB都组建了专家评审委员会,分别对来自不同研究领域的科研项目进行内容审核。以俄亥俄州立大学为例,虽然为了体现IRB成员在种族、性别、文化等方面的多样性,该校规定每次的IRB会议必须有1名非学术人员列席,但非学术人员主要是负责审核知情同意书、研究资料等材料的文字表达。学校规定,3个IRB的绝大多数成员是来自各个学科的教师代表,对申请立项的研究项目的科学性进行审查是IRB必须完成的任务。如果IRB成员认为研究设计有问题,且研究风险大于可能的收益,则可以直接否决这一申请。目前,学校肩负主要审核责任的9位IRB主席和副主席也都为终身轨教师[39]。此外,不少大学还采用匿名制来保护IRB成员信息,以使其更无后顾之忧地行使专业权力。
5 美国大学科研项目准入制度面临的挑战
必须承认,美国大学科研项目的准入制度并不完善,其自身存在的审查程序机械化、评审专业程度受质疑等问题不容忽视。与此同时,市场化制度下商业科研审查机构对传统院校科研审查所形成的现实冲击也是客观审视整个美国科研立项准入制度的重要视角。
5.1 IRB自身审批程序的僵化
美国大学科研项目准入制度发展至今日趋成熟,但随着IRB审查范围的扩大、审查职责的变化,其过于规范化的审批程序也遭遇越来越多的挑战。就审查时长而言,从提出申请到正式获得调查许可证,申请人通常需要等待几周甚至数月。在未获得IRB正式许可前,研究人员不能开展相关研究,这对于项目进度的延误是显然的,特别是对某些追求时效性的研究[40]。就审查方式而言,IRB审查所需材料均有固定的格式要求,项目申请人必须花费较长时间填写冗长且内容固定的申请表单,如佐治亚大学的申请表就长达30页,且表单中并非所有内容都具有普适性。许多申请人都对IRB审批中这种僵化的行政管理模式怨声载道。就审查内容而言,作为IRB固定审查项目之一的知情同意书在实际操作过程中出于各种原因很容易受到被试的抵制,从而影响整个研究进度。例如,当涉及某些敏感性主题时,许多受访者感到自己处于弱势地位,往往在知情同意书的签订上容易犹豫不决[20]。某些受访的精英人士或其他有权力的人,不是拒绝在知情同意书上签名,就是签名后采取其他方式来避免调查人员洞察受访者真正的观点[20]。Bradford与Robert证实,知情同意程序最常被修改,近25%的研究人员认为使用知情同意书本身就会对研究进展有所限制[40]。
5.2 社会与行为科学领域审查的专业性有待提高
考虑到学科间的差异性,不同领域的科研立项申请会被送往不同的IRB进行审查。美国大学中IRB的设立原则上是依据学科大类划分,不同学校的IRB数量会因学校规模、管理理念等因素有所不同。相较于生物医学领域,社会与行为科学领域IRB审查的专业性受到了更多的质疑。一方面可能是因为这一领域的IRB制度本就建立较晚,且现行的通用规则也多是遵循生物医学领域而设,因而在实际操作过程中容易出现 “不兼容”现象。例如,2003年时口述史访谈类研究因不属于联邦DHHS所规定的研究类型而被排除在IRB的监督之外,这一决定引起了许多学者的争论[20]。另一方面可能与社会与行为科学等诸多 “软学科”的学科标准本就不如 “硬学科”明确有关。IRB成员多样性的另一面则是他们的学科素养参差不齐,一些成员很少或者完全不了解部分新兴理论 (女性主义理论、种族理论、后殖民主义),容易出现外行评价内行的问题[25],很多研究人员抱怨真正熟悉社会科学研究且了解这一学科领域的评审专家比较缺乏[41]。
5.3 研究自由与科研伦理之间存在矛盾
学术自由与大学自治一直是美国大学标榜的重要理念,然而,随着IRB审查范围的扩大,这两大理念之间的矛盾也愈发凸显。一方面,作为学校重要科研管理部门的大学IRB虽然奉行的是委员会审查制,但其运作过程都烙刻了管理主义逻辑;另一方面,在联邦法规之下,但凡涉及到生命体的科研项目都必须接受IRB的审查,崇尚自由探索的科研活动会在一定程度上受到限制,尤其在 “伦理”准绳被误用之时。诸多组织和学者都质疑指导IRB的联邦法规违反了美国宪法第一修正案赋予的言论自由和研究自由,其中以美国大学教授协会 (American Association of University Professors)最具代表性。该组织从20世纪80年代起就发布系列报告批评IRB对研究自由的侵犯,极力主张改革或豁免某些类型研究的伦理审查与监管[41]。尤其是社会科学研究者认为IRB官僚化的审查影响了他们的研究自由[42]。
5.4 商业科研审查机构通过市场机制带来的挑战
目前美国主要有两大类科研审查机构,一类是附设于大学、科研机构、医院等组织的非营利性科研审查,由IRB执行;另一类则是独立的科研审查机构,多为营利性组织。在很长一段时间内,非营利性IRB在科研项目审查中占据绝对优势。1995年,独立的科研审查机构所颁发的研究许可证也被联邦政府认可,研究者可以此申请联邦科研基金。此后,独立的科研审查机构凭借其自身优势发展迅猛,给大学内部的IRB带来了直接挑战。例如,独立科研审查机构的成员多为专职聘用,审查效率更高,其平均审查周期为11天,远低于非营利性IRB的37天[43]。某些商业科研审查机构为了 “取悦客户”,在市场化的环境中立足,会采用较为 “宽松”的审核标准。相应的,某些科研项目的申请人也可能会选择 “IRB寻购”——申请人为了使项目顺利获批,主动寻找最可能同意该方案的科研审查机构进行审查,或者在方案被否决后选择其他科研审查机构进行审查,直到方案通过为止[43]。这些现象无疑会对大学IRB提出挑战,更会对整个科研审查环境造成冲击。

