帕金森病伴疼痛患者接触性热痛刺激诱发的脑功能磁共振成像研究
彭乔君,涂敏,王晓明,,杨双凤,侯昌月,包娜娜
(1.川北医学院附属医院神经内科;2.川北医学院神经疾病研究所,四川 南充 637000)
帕金森病(parkinson disease,PD)是常见于中老年人的中枢神经系统变性疾病,其临床症状包括运动症状和非运动症状(nonmotor symptoms,NMS)。NMS包括焦虑抑郁、认知功能障碍、嗅觉减退、疼痛等[1]。疼痛是PD最常见的非运动症状之一,其严重影响患者生活质量,并加重家庭经济负担[2]。目前,帕金森病伴疼痛患者(patients with PD and pain,PDP)的疼痛病理生理机制尚不清楚,国内尚未见PDP与帕金森病不伴疼痛患者(patients with PD but no pain,nPDP)在大脑对伤害性刺激感受处理方面是否存在差异的报道。接触性热痛刺激(contact heat stimulation,CHS)指利用接触皮肤的可以在一定范围内升高温度的探头来刺激皮肤的感觉神经末梢进而刺激神经系统的电生理技术,其可与神经影像技术及脑电(包括诱发电位)融合,本课题组前期已对相关疾病进行了探讨[3-6]。本研究采用CHS和MRI成像技术联合,痛觉刺激同步脑功能磁共振成像(functional magnetic resonance imaging,fMRI)观察大脑痛觉相关脑区的激活情况,探索PDP痛觉病理生理机制,以期为PD临床分型及治疗等提供参考。
1 资料与方法
1.1 一般资料
选取2019年2月至2020年4月在川北医学院附属医院26例神经内科住院及门诊确诊为PD的患者为研究对象,根据是否伴疼痛分为PDP组(n=11)和nPDP组(n=15)。另选17名年龄、文化程度、性别相匹配健康志愿者为NC组。纳入标准:(1)符合英国脑库制定的帕金森病诊断标准及2016年中国帕金森病的诊断标准;(2)至少大于4周的持续规律服用帕金森药物史;(3)根据国际疼痛协会对慢性疼痛的定义,PDP组疼痛持续时间≥3个月;(4)利右手;(5)行头颅MRI扫描前需停用相关帕金森药物12 h;(6)所有被试均签署知情同意书,愿意参加本次研究。排除标准:(1)帕金森综合征及帕金森叠加综合征;(2)合并周围神经病变及其他原因导致的疼痛;(3)有神经精神病病史;(4)有认知障碍及痴呆病史,使用镇静、抗精神类等药物者。
1.2 方法
1.2.1 接触性热痛电位诱发 采用的接触性热痛诱发电位刺激器(contact heat evoked potentials stimulus,CHEPS)由Medoc公司生产。CHEPS的探头是直径为27 mm(面积573 mm2)的圆形,并带有加热的热箔,表面覆盖着25 μm厚的导热塑料,能以最高70℃/s的速度加热。热刺激方式是由电脑控制并发出的单次脉冲刺激,CHEPS电极与右前臂背侧皮肤直接接触,所有刺激均从基线温度32℃到目标温度51℃进行。采用事件相关设计的任务态实验方式,即在整个fMRI扫描过程中同步给予51℃接触性热痛脉冲刺激(刺激部位:右侧上肢前臂背侧皮肤),为了避免暗示作用,刺激间隔时间随机(16 s或20 s或24 s),共刺激20次[3]。在数据采集过程中,要求参与者闭眼放松,不要入睡。试验结束后,采用视觉模拟评分(visual analogue scale,VAS)对受试者的温度刺激的感受程度评分。
1.2.2 fMRI数据采集 所有数据获取均在川北医学院附属医院3.0T磁共振室进行,所有受试者均采用美国GE3.0 T超导性磁共振扫描仪,32通道相控阵头颅线圈接受信号完成图像采集。扫描时首先进行常规T1WI、T2WI扫描,若颅内未见任何形态学异常,然后接着进行任务态fMRI(fMRI扫描参数:采用梯度回波平面成像技术,周期时间=2 000 ms,回波时间=30 ms,翻转角=90°,扫描层数=33层,层厚=4 mm,平面分辨率=64×64像素,视野=240 mm×240 mm)扫描,成像覆盖全脑。fMRI采集连续扫描430 s。为了避免开始扫描时机器纵向磁化强度不稳定的影响,剔除掉前5个时间点的图像,即在整个fMRI成像的过程中采集210个时间点。
1.3 统计学分析
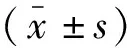
2 结果
2.1 三组对象一般资料比较
PD组共26例患者纳入本研究,通过对PD患者是否伴躯体疼痛行VAS评分将PD患者分为两个组:PDP组(男性5例,女性6例,年龄58~75岁)和nPDP组(男性6例,女性9例,年龄53~79岁)。NC组纳入17位符合条件的受试者(男性8例,女性9例,年龄54~73岁)。PDP组和nPDP组年龄、性别比例、病程、MMSE、HAMD、HAMA、H-Y分级、UPDRSⅡ、UPDRSⅢ、LED比较,差异无统计学意义(P>0.05);PDP组和nPDP组在VAS(躯体疼痛)量表评分比较,差异有统计学意义(P<0.001)。CHS刺激后,三组对象VAS疼痛量表比较,差异有统计学意义(P<0.05)。见表1。
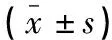
表1 PDP组、nPDP组与NC组人口学及临床资料统计分析
2.2 脑激活区分布情况比较
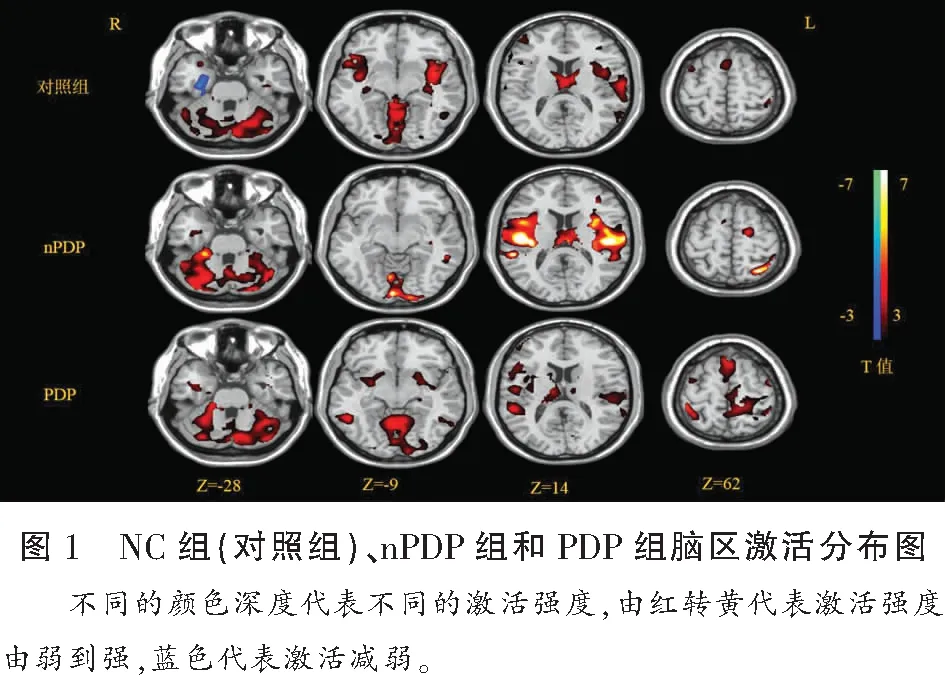
2.2.1 单样本t检验 NC组CHS-fMRI激活脑区包括双侧丘脑、双侧舌回、双侧中央沟盖、双侧脑岛、双侧小脑、双侧颞上回、双侧补充运动区、双侧尾状核、双侧缘上回、双侧楔叶、双侧眶部额下回、双侧中扣带回等(P<0.05)。nPDP组CHS-fMRI激活脑区包括双侧小脑、双侧梭状回、双侧丘脑、双侧中央沟盖、双侧颞上回、双侧顶下缘角回、双侧补充运动区、双侧中央后回、双侧颞下回、双侧岛盖部额下回等(P<0.05)。PDP组CHS-fMRI激活脑区包括双侧中央后回、双侧丘脑、双侧小脑、双侧脑岛、双侧中央前回、双侧顶下缘角回、双侧补充运动区、双侧旁中央小叶、双侧颞下回、双侧颞中回(P<0.05)。NC组、nPDP组和PDP组脑区激活分布情况见图1。
2.2.2 全脑激活情况的组间差异 PDP组与nPDP组相比,PDP组激活程度增强脑区包括右小脑、右海马旁回、右舌回、右背外侧额上回、右眶部额上回,激活程度减弱的脑区包括双侧颞下回、双侧脑岛、左中央沟盖、左顶上回、左顶下缘角回(P<0.05)。PDP组与NC组相比,PDP组激活程度增强的脑区包括双侧小脑、左颞下回、右海马旁回、右梭状回、右海马、右舌回、左丘脑、左颞上回、右脑岛、右中央沟盖、左颞上回、双侧中央前回、左中央后回、左补充运动区,未见激活降低的脑区(P<0.05)。见图2和表3。nPDP组与NC组相比,nPDP组激活程度增强的脑区包括:双侧小脑、双侧中央沟盖、双侧梭状回、双侧脑岛、左顶下缘角回、右颞下回、右海马旁回、左丘脑、左颞上回、左中央前回、左中央后回、右海马、左补充运动区、左颞横回、左顶上回(P<0.05),未见激活降低的脑区。见图2、表2-表4。


表2 PDP组与nPDP组比较激活有差异的脑区具体解剖位置、所在MNI坐标、团块体素、T峰值

表3 PDP组与NC组比较激活有差异的脑区具体解剖位置、所在MNI坐标、团块体素、T峰值

表4 nPDP组与NC组比较激活有差异的脑区具体解剖位置、所在MNI坐标、团块体素、T峰值
3 讨论
疼痛是一种复杂的心理与神经生理现象,在涉及外侧和内侧疼痛系统的神经网络中进行处理。外侧疼痛系统包括穿过外侧丘脑并主要向感觉皮层区域投射的脊髓丘脑束,主要涉及处理感觉辨别、定位和疼痛强度;内侧疼痛系统主要包括脊髓网状丘脑束,通过丘脑内侧与认知和情感相关的区域(例如,前扣带回皮层)进行投射,主要与情感改变和认知评估方面有关[7]。随着神经影像技术的发展,已有研究表明,多个脑区共同参与痛觉形成及处理,存在复杂的痛觉网络[8]。已报道与痛觉相关的脑区包括:初级感觉皮质、次级感觉皮质、丘脑、岛叶皮层、前扣带回皮质、辅助运动区、小脑、前额叶皮质、基底节区等[9-10],本研究通过CHS与fMRI相结合的方式(即CHS-fMRI),可记录痛觉的客观反映,并同步记录脑功能活动的动态变化,与既往研究基本一致,支持痛觉相关脑网络。
有证据表明,多巴胺能在调节疼痛感知和镇痛中起着核心作用。实际上,疼痛的感受可以通过多巴胺信号传导的直接或间接失调被调节。多巴胺失调可以直接增强或减少伤害性信号的传播,并间接影响情感和认知过程,后者参与伤害感受信号的体验和解释。与多巴胺过度神经传递有关的疾病的特征是对疼痛的敏感性低(如精神分裂症),相反,与多巴胺缺乏症相关的疾病特征是痛觉过敏(如情绪障碍和PD)[11]。PD的疼痛感可能与纹状体多巴胺能功能障碍不直接相关,但可能反映出纹状体多巴胺能功能障碍,在感觉和情感性脑伤害感受途径之间存在失衡[12]。背外侧前额叶皮层与运动皮层等相关联,并且从黑质致密部和腹侧被盖区接收多巴胺投射,它是下行疼痛调节系统中的关键区域,在期望、奖励和决策中起着重要作用[13]。眶额皮层与纹状体和多巴胺能神经核紧密相连,并参与期望和奖励,可将几种刺激与其主观情绪和情感价值或在抑制疼痛过程中联系起来[14]。本研究结果中PDP组与nPDP组相比,PDP组激活程度强于nPDP组的脑区包括:右小脑、右海马旁回、右舌回、右背外侧额上回、右眶部额上回,激活程度弱于nPDP组的脑区包括:双侧颞下回、双侧脑岛、左中央沟盖、左顶上回、左顶下缘角回。提示PD的疼痛与多巴胺能区域前额叶皮层过度激活有关,岛叶、颞叶和小脑等其他非多巴胺能区域也显示功能的变化,这可能与疼痛的感觉运动和情绪反应有关,与既往研究一致[15-16]。
诸多研究[17]表明,PD患者对疼痛的敏感性增加,对PD患者采用不同类型的疼痛刺激(电刺激、冷/热刺激)的研究结果提示其疼痛耐受性下降、痛觉阈值下降,但上述研究均未对PD患者是否伴疼痛进行分组。因此,为进一步探索PD与疼痛的相互作用机制。在本研究中,PD患者运用VAS评分评估躯体疼痛程度,所有受试者运用VAS评分评估试验期间接受的热痛刺激强度。试验性热痛刺激评分分别为:PDP组(4.77±1.02)分、nPDP组(3.88±0.62)分、NC组(3.11±0.74)分,差异有统计学意义(P<0.001)。表明PDP组、nPDP组与NC组相比热痛阈值均降低。这可能与PD中重要的一条抗伤害通路(中脑边缘系统通路)的多巴胺耗竭所致疼痛调节系统功能障碍有关,其引起疼痛信号放大,导致中枢敏化[18],值得进一步研究。
nPDP组与NC组相比,nPDP组激活强度强于对照组的脑区包括双侧小脑、双侧中央沟盖、双侧梭状回、双侧脑岛、左顶下缘角回、右颞下回、右海马旁回、左丘脑、左颞上回、左中央前回、左中央后回、右海马、左补充运动区、左颞横回、左顶上回,未见激活降低的脑区。提示PD患者即使还未出现疼痛,但其疼痛相关脑网络已发生改变,与既往研究基本一致[7]。此外,nPDP组VAS评分明显高于NC组,提示nPDP疼痛敏感性增加、痛觉阈值下降,亦支持对应痛觉相关脑区激活增强的结论。
由于研究方法较单一、样本含量相对较少,VAS评分尚不能客观、全面的评估患者的躯体疼痛症状。在未来的研究中需进一步扩大样本含量,运用如国王帕金森疼痛量表评分等对PDP进行综合评估,联合定量感觉测定等方法客观评估痛觉阈值,对PDP细分疼痛亚型,进一步探索PDP不同疼痛类型痛觉相关脑网络。

