高丹草多倍体的诱导与鉴定
王 炜,陈 琛,葛玉彬,罗俊杰
(1.甘肃省农业科学院 生物技术研究所,兰州 730070;2.甘肃省农业科学院 作物研究所,兰州 730070)
高丹草(Sorghumbicolor×S.sudanense)是一年生禾本科饲草作物,具有分蘖力及再生性强、营养价值高、适口性好、抗逆性强及适应性广等优点,在畜牧草业领域具有广阔的开发应用前景[1-2]。
植物多倍化在进化过程和新物种的形成中起着重要作用[3-4]。与原二倍体植物相比,多倍体一般表现为生物量大、抗逆性强、生长旺盛等特点,在遗传上具有更大的可塑性及生理上具有更强的适应性,因此人工诱导进行植物多倍体材料创制及育种已成为重要研究方向之一[5-8]。植物多倍体可通过物理、化学诱导等方法产生[9]。其中物理方法主要是采用辐射、变温、机械损伤等干扰使植物细胞的正常分裂受阻,导致植株的染色体加倍[10-11];化学诱导主要采用秋水仙素、除草剂类、异生长素类等化学诱变剂处理种子、实生苗生长点、腋芽等,抑制纺锤丝的合成使有丝分裂中断,阻止染色体向两极移动,从而形成两套染色体[7,9]。物理诱变多倍体因其诱变效率较低、嵌合体产生的频率高、且会产生基因突变,近年来应用逐渐减少。化学诱变尤其是采用秋水仙素诱导多倍体目前已成为最常用的方法[9],在林果[12-14]、蔬菜[15-16]、中草药[17-18]及部分禾本科植物[19-21]中得到广泛应用。多倍体可通过表型测定、根尖染色体法、表皮气孔保卫细胞法、流式细胞仪以及分子标记等方法进行鉴定[12-15]。然而,目前国内外高丹草多倍体诱导研究相对较少,国内外仅有房永雨等[22]和周亚星等[23]对秋水仙素处理高丹草F1种子诱变效果和染色体加倍效应进行研究分析,而对于后续如何获得稳定高丹草多倍体材料鲜有报道。鉴于此,本研究采用秋水仙素对高丹草进行处理,通过根尖染色体法和表皮气孔保卫细胞鉴定法,结合表型观察鉴定高丹草多倍体材料,通过逐代鉴定筛选,以期获得高丹草新种质,并为相关研究提供参考及基础材料。
1 材料与方法
1.1 供试材料
供试高丹草品种‘大卡’(‘Big Kahuna’),为光敏型和褐色中脉型,来源于美国。
用于多倍体诱导和鉴定的设备及试剂:奥林巴斯显微镜BX51;秋水仙素(分子式C22H25NO6,分子量 399.44)购于Sigma公司;苯酚品红染液、卡诺固定液、1 mol/L盐酸、0.002 mol/L 8-羟基喹啉、1% I-KI染色液等试剂购自于兰州艾尔维科学仪器有限公司;WYT型糖度计由成都豪创光电仪器有限公司生产;育苗基质为鲁亿牌育苗基质(有机质35%~45%,腐殖酸15%~25%),山东鲁亿育苗基质有限公司生产。
1.2 方 法
1.2.1 秋水仙素母液的配制 取秋水仙素1 g,先用少许95%酒精助溶,溶于100 mL蒸馏水中,配成1%秋水仙素溶液。放入棕色玻璃瓶内,置于4 ℃冰箱保存,用时再稀释到所需浓度。
1.2.2 诱导方法 分别采用浸种法和滴生长点法两种方法进行秋水仙素诱导高丹草多倍体的技术研究。浸种法:秋水仙素浓度设7个梯度,分别为0.02%、0.04%、0.06%、0.08%、0.10%、0.12%、0.14%,对照为蒸馏水,处理时间均为 24 h。选取颗粒饱满的高丹草大卡种子,用2%的次氯酸钠溶液消毒10 min,无菌水冲洗3次,每次3 min。消毒过的种子用无菌双层滤纸吸干表面水分后,随机取45粒,放入灭菌过的100 mL三角瓶中,加入相应浓度的秋水仙素溶液5 mL静置24 h。处理结束后,用自来水冲洗30 min,再用蒸馏水冲洗3次,每次3 min;吸干种子表面水分后,移至消毒过的铺有双层滤纸、直径为6 cm的培养皿内,置培养箱内23 ℃下暗培养3 d,转入25 ℃光照培养箱中培养,光强度45 μmol/m2、光周期14 h。每天在培养皿加入1~2 mL蒸馏水。7 d后统计每个处理组合下的发芽数,计算发芽率。将幼苗移栽入花盆,继续培养20 d后,统计每个处理组合下诱变苗存活数,计算致死率,并将幼苗移栽入温室。
发芽率=发芽种子数/处理种子总数×100%
移栽成活率=诱变苗存活数/移栽时的幼苗数×100%
致死率=(1-诱变苗移栽成活率/对照移栽成活率)×100%
滴生长点法:秋水仙素浓度设为6个梯度,分别为0.01%、0.02%、0.04%、0.06%、0.08%、0.10%,对照为蒸馏水。在花盆中点播高丹草种子,每浓度点播10盆,每盆15粒种子。待苗高 1 cm左右时,每个花盆留选长势大小大体一致的幼苗10株,在每个幼苗的生长点部位放置大小相同的脱脂棉球,早晚各滴相应浓度的秋水仙素溶液20 μL,连续处理7 d;15 d后统计幼苗成活率,并将存活幼苗移栽入温室花盆中。
1.2.3 高丹草多倍体材料的诱导 以致死量达到50%左右作为适宜的秋水仙素诱导高丹草多倍体处理24 h的浓度。2015年3月下旬,将 5 000粒高丹草种子分为两部分:其中2 500粒用浸种法,秋水仙素处理种子后播种于育苗穴盘中。每穴点播诱变处理后的高丹草种子2粒,浇足水后置于温室中(温度15 ℃~28 ℃),自然光照射,每天适量喷洒浇水。另外2 500粒先期播种后用滴生长点法处理,方法同上。
1.2.4 诱变后代材料的种植及高丹草多倍体的逐代鉴定筛选 诱变后成活的M1代高丹草材料移栽于甘肃省农业科学院兰州基地大田,大田覆膜,行长6.4 m,株距0.4 m,每12行设一对照(2行),按常规育种方式管理。开花前套袋自交,成熟后全部按单株收获。M2~M5代按株行育苗移栽,大田覆膜,常规育种方式管理,生育期内表型观察鉴定,选择叶片、茎粗、分蘖、生物量等较野生型对照‘大卡’显著增加的,采用表皮气孔保卫细胞大小鉴定法进行多倍体鉴定,选择经鉴定为多倍体的材料套袋自交,成熟后按单株收获;待诱变后代表型性状稳定后,采用表型鉴定、表皮气孔保卫细胞大小鉴定法及根尖染色体法鉴定多倍体。
表型鉴定:移栽后参照何振富等[24]的方法观察统计出苗率、中脉颜色、叶片大小、穗型等表型性状,测定株高、单株鲜质量等;采用游标卡尺测定茎粗;采用WYT糖度计测定含糖量。
染色体倍性鉴定:①根尖染色体鉴定法:将待鉴定的高丹草种子置于铺有2层无菌滤纸、直径为9 cm的培养皿中,培养皿内加适量蒸馏水使滤纸湿润;常温发芽,待根长1.0~1.5 cm时,于 9:00-10:00剪下根尖;浸入0.002 mol/L 8-羟基喹啉,处理时间为2 h;取出根尖,冲洗干净后放入卡诺固定液12 h;转入70%乙醇中,放入4 ℃冰箱保存;将固定好的根尖放入1 mol/L盐酸中60 ℃水浴解离10 min;将解离完成的根尖用蒸馏水冲洗干净后,置于载玻片上,滴一滴苯酚品红染液使根尖被完全浸润,静置10 min;盖上盖玻片,用滤纸吸去多余染液,用玻璃棒轻轻敲击盖玻片,使根尖细胞均匀散开;显微镜下观察。原野生型对照‘大卡’为二倍体(2n=2x=20),因此染色体为40条的为多倍体(四倍体,2n=4x=40)。②表皮气孔保卫细胞大小鉴定法:于9:00-10:00选取同一生长时期的植株自上而下第5片叶,在叶片中部剪大约0.5 cm2大小部分,用刀片轻轻刮去叶片上表皮及叶肉细胞,将下表皮冲洗干净,置于载玻片上,滴加I-KI染色液使叶片表皮完全浸于染液中,染色2 min,盖上盖玻片后置于显微镜下观察。每张片子随机选取10个保卫细胞,测量保卫细胞长度并统计。气孔的长宽、保卫细胞长宽等较野生型对照‘大卡’显著增加的认为是多倍体[25-27]。
2 结果与分析
2.1 秋水仙素浓度对高丹草种子发芽和幼苗生长的影响
采用浸种法时,在处理时间均为24 h时,不同浓度秋水仙素对高丹草种子发芽率、移栽成活率有显著影响,随秋水仙素浓度提高,发芽率和致死率升高(表1),表现出较强的浓度依赖性;当浓度达到0.10%以上时,移栽成活率均为0。以移栽成活率计算,浓度0.06%时致死率为48.80%,接近半致死剂量,因此以0.06%处理24 h作为浸种法时的秋水仙素诱导高丹草多倍体的处理 参数。
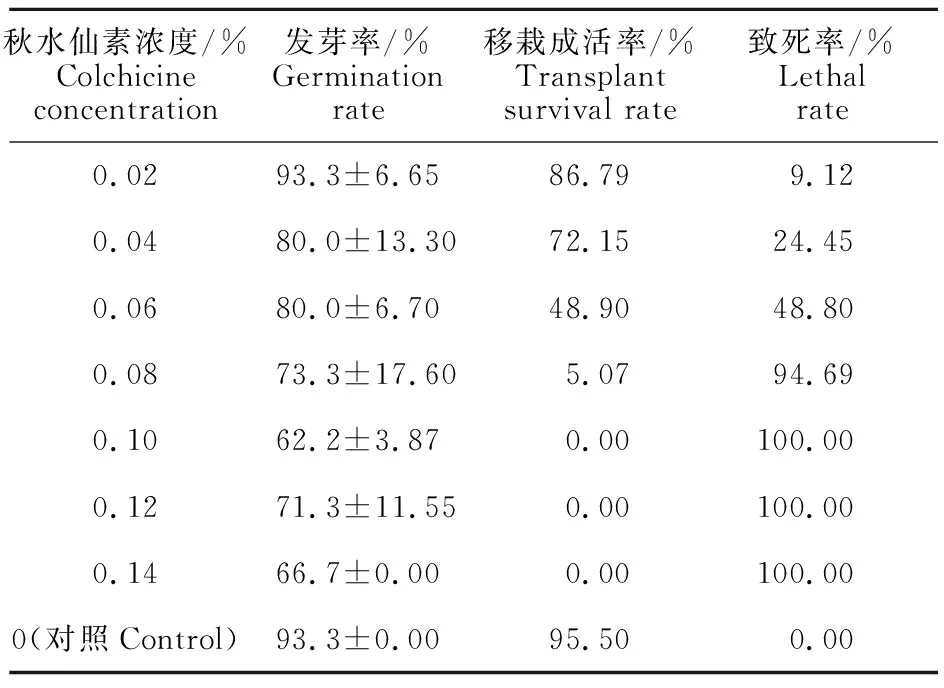
表1 不同浓度秋水仙素浸种处理24 h高丹草种子发芽及移栽成活率
由表2可以看出,利用滴生长点法时,随着秋水仙素浓度增高,存活幼苗数逐步降低,当秋水仙素溶液浓度达到0.10%时,所有被处理后的种子无一发芽,致死率为100%;在秋水仙素浓度为 0.02%时,超过一半的种子不能发芽,致死率为52%,接近于半致死量,因此以0.02%作为滴生长点法时诱导高丹草多倍体的秋水仙素处理 浓度。

表2 不同浓度秋水仙素处理高丹草幼苗生长点7 d 幼苗存活率和致死率
2.2 秋水仙素处理高丹草诱变M1~M2情况
采用浸种法处理共出苗1 211株,移栽至覆膜大田后成活962株;采用滴生长点法处理后幼苗存活 1 107株,移栽至覆膜大田后成活803株。因此总计获得秋水仙素M1代诱变植株1 765株,由于存在大量畸形苗以及生育期明显延长的诱变株共812株未能获得种子,10月下旬收获时仅结实953株。
M2代时将953株育苗后按株行全部移栽于覆膜大田。随机选取117份材料的株高、生育期、茎粗、叶长、含糖量、鲜质量等6个指标进行测定(表3)。结果表明,所测定材料的平均值均低于对照材料,尤其是生育期较对照平均提前24 d,株高较对照平均降低51 cm,这可能与M1代一部分晚熟材料未能结实而自然淘汰,同时大部分株高较高的材料也晚熟等因素相关。生育期内根据表型观察鉴定,39株在叶片、茎粗、分蘖、生物量等较野生型对照‘大卡’显著增加,对这些材料采用表皮气孔保卫细胞大小鉴定法进行多倍体鉴定,结果27株为多倍体,套袋自交后收获结实单株12株。
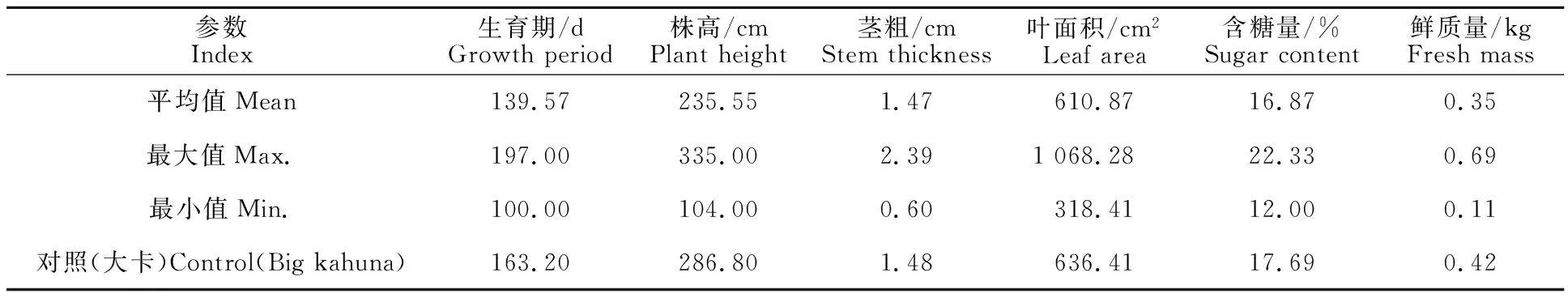
表3 高丹草M2代诱变材料部分性状鉴定
2.3 高丹草多倍体的获得
M3~M5代按M2代的方法继续进行高丹草多倍体鉴定,其中M3代获得经鉴定为多倍体单株2份,分别为DB1和DB2,M4~M5代按株行种植时表型稳定,其生育期、株高、茎粗、叶面积和鲜质量等指标均较对照有显著提高(表4);作为品质指标之一的含糖量与对照相比无显著性差异。
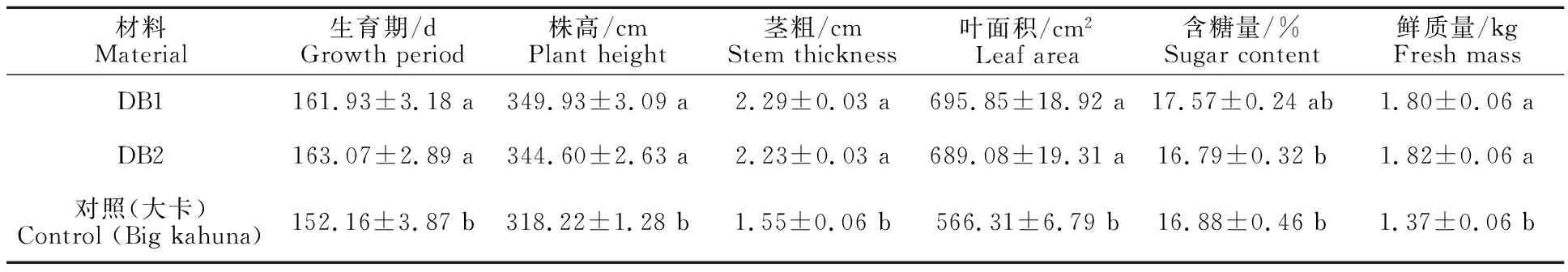
表4 高丹草多倍体材料DB1和DB2在M5代时的性状鉴定
每份随机选取10株分别采用表皮气孔保卫细胞大小鉴定法和根尖染色法进行了鉴定。结果表明,DB1和DB2的气孔长度、气孔宽度、保卫细胞长度和保卫细胞宽度均显著高于对照(表5);根尖染色的结果说明(图1),原野生型对照对照大卡的染色体数目为20条,为二倍体(2n=2x=20),DB1和DB2则为40条,为四倍体(2n= 4x=40)。

表5 高丹草多倍体的表皮气孔保卫细胞法鉴定
因此,通过表型性状、表皮气孔保卫细胞大小及根尖染色体鉴定相互印证,可以确定DB1和DB2为多倍体。
3 讨论与结论
3.1 高丹草多倍体的诱导
近年来,因全国种植业结构的调整及农业供给侧改革的推进[28],草食畜牧业得到空前的重视和发展,其中优良饲草种质资源创制及品种培育是重要的基础性工作。高丹草作为一种新型的优质牧草,其生物量的遗传改良尤为重要。由于多倍体通常具有巨大型器官、株高增加、茎杆粗壮、生物量大、抗逆性强等优点,因而人工诱导多倍体已经被用于大量作物育种中,其中以秋水仙素作为诱导剂最为常见[29-32]。本研究采用浸种法中对高丹草处理24 h时的秋水仙素半致死浓度为 0.06%(表1)。房永雨等[22]采用浸种法对两份高丹草材料进行多倍体诱导的研究表明,适宜的处理浓度和时间组合分别为0.10%/24 h和 0.05%/36 h。结果有所不同的原因可能与供试材料不同相关。对于不同植物,甚至同一植物的不同品种,最适宜的处理方式和最适宜的浓度时间组合参数不尽相同[33-36]。但已有的研究表明,秋水仙素的处理浓度及时间在某一区间内可以有效诱导多倍体的产生,浓度的进一步提高和处理时间的延长会导致植株畸形苗和嵌合体增加、致死率显著上升,多倍体诱导率反而可能下降[36-38]。本研究中滴生长点法中秋水仙素半致死浓度为0.02%(表2),与浸种法相比浓度差距较大的原因有两点:其一是浸种法中因种皮的阻隔使得秋水仙素直接作用于种子内部成分的力度减弱且时间延缓,而滴生长点法则是秋水仙素直接作用于生长点;其二是浸种法中秋水仙素处理时间为 24 h,而滴生长点法则每天早晚各一次,连续处理 7 d,显然作用时间更长,因此较低的浓度即可使致死率达到与浸种法相同的结果。本研究采用常见的毒理学研究中的半致死浓度[25]作为诱导高丹草多倍体的处理参数,用浸种法和滴生长点法分别处理了 2 500粒高丹草大卡种子和2 500粒种子所产生的幼苗,通过逐代鉴定筛选,至M5代时获得了两份高丹草多倍体材料DB1和DB2,其株高、叶面积、茎粗和生物量等于对照相比有显著提高,而反映其品质的指标之一含糖量与对照相比无显著性差异(表4)。可见,这两份多倍体材料可能具有较好的开发利用前景,除了可直接作为种质资源使用外,经进一步培育有望作为品种推广应用。由于在逐代鉴定筛选过程中,一部分诱变株因畸形、生育期延后而未能收获到种子;另外一部分则因是嵌合体,其多倍体性状不能稳定遗传而被淘汰;因此,最终实际多倍体诱导率仅为2/5 000=0.04%。
3.2 高丹草多倍体的鉴定
多倍体鉴定通常先通过表型测定,再结合根尖染色体法、表皮气孔保卫细胞法、流式细胞仪以及分子标记等方法进行鉴定[4,37-40]。流式细胞仪和分子标记鉴定为高通量的多倍体鉴定方法,然而前者对于实验设备的要求较高,而高丹草多倍体分子标记尚未开发出来。在M1~M3代时,由于存在嵌合体等原因诱变植株正在分离,遗传性状尚未稳定,因此采用根尖染色体法鉴定多倍体有诸多不便。故而,本研究对于M1~M3代时株高、叶片大小、茎粗等较原野生型对照‘大卡’有显著提高的诱变株,采用表皮气孔保卫细胞法进一步进行多倍体鉴定;鉴定后为多倍体的植株下一代按单株种植继续鉴定筛选,至性状稳定的 M4~M5代时,采用表型测定、表皮气孔保卫细胞法和根尖染色体法三者相结合的方式进行了多倍体鉴定。从以创制高丹草多倍体种质材料的目的来看,这种方式能够有效减轻工作量,提高效率。

