含不同链长的羧酸咪唑盐类聚离子液体的制备及生物性能*
郑群 ,狄海萍, 周超,姜彦△
(1.常州大学材料科学与工程学院,常州 213164;2. 郑州市第一人民医院烧伤科,郑州 450004;3. 常州大学药学院 医学院(筹),常州 213164)
1 引 言
聚离子液体不仅具有离子液体的特殊性质,如热稳定性,高离子导电率以及高化学稳定性[1-4]等,还兼具聚合物的一些性质,如可加工性[5- 6],较高的机械强度[7]以及较好的柔韧性[8]。因此,它在很多领域都有应用,比如精细化工的催化方面[9-10],电化学领域[11-13],天然产物的分离方面[14],生物医用领域[15]等。
咪唑盐类聚离子液体不仅具有高效的抗菌性能和较高的生物相容性[16],而且不产生耐药性,因此,受到国内外科研人员的关注[17]。其抗菌机理在于聚合物所携带的咪唑盐阳离子通过静电作用吸附在带负电的细菌细胞壁上,而后通过其疏水性链段扰乱细胞膜,破坏菌体的完整性,达到灭杀细菌的效果[18]。Smith等[19]探究了可在水中降解的硫代咪唑鎓盐类聚离子液体抗菌剂,该聚合物可以有效灭杀细菌,且能够在碱性条件下降解。严锋等[20]采用n—溴—1—烷基醇和1—乙烯基咪唑合成了溴代3— (1—羟烷基) —1—乙烯基咪唑(IL—Cn—OH),并制备了相应的聚合物膜,该研究表明制备的聚离子液体膜材料具有良好的生物相容性以及抗菌性能。
目前大多数咪唑盐类聚离子液体采用卤素作为阴离子,而卤素在生物体内富集,长时间使用会对细胞造成潜在的伤害,因此限制了咪唑盐类聚离子液体在生物医学领域的应用[21-22]。为了降低卤素阴离子的负面影响,本研究选用不同羧基作为咪唑盐类聚离子液体的阴离子,通过采用“醛-胺”缩聚“一锅法”[23-24]反应制备了五种不同侧链长度的羧酸盐类咪唑盐类聚离子液体,该法较之于传统的制备方法更加简单快捷,且效率更高。通过上述方法研究了不同侧链长度的羧基对聚离子液体抗菌性能和细胞毒性的影响。
2 实验部分
2.1 原料
乙二醛(40%,国药集团化学试剂有限公司);甲醛(40%,国药集团化学试剂有限公司);1,4-丁二胺(AR,上海阿拉丁生化科技股份有限公司);乙酸(AR,上海申博化工有限公司);丙酸(AR,上海阿拉丁生化科技股份有限公司);正丁酸(AR,上海阿拉丁生化科技股份有限公司);正戊酸(GC,上海阿拉丁生化科技股份有限公司);正己酸(AR,上海阿拉丁生化科技股份有限公司);氢氧化钠(AR,国药集团化学试剂有限公司);去离子水;透析袋(MWCO=1 KD,光谱医学,美国);MH、LB和YPD培养基(索莱宝公司,美国);磷酸盐缓冲溶液(PBS)和Cell Counting Kit-8(CCK8)试剂盒(碧云天生物技术有限公司,中国)。
2.2 实验仪器
傅里叶变换红外光谱仪(NICOLET IS 10,Thermo Fisher SCIENTIFIC,美国);核磁共振波谱仪(AVANCE II 500M,Bruker,德国);激光粒度仪(ZEN 3600, Malvern Instruments Ltd,英国);酶标仪(Infinite F50,Tecan,瑞士)。
2.3 样品制备
乙酸盐咪唑聚离子液体的合成:取1,4—丁二胺(1.98 g,0.0225 mol)溶于11.25 mL的去离子水中,在冰浴环境下将乙酸(2.6 mL,0.045 mol)滴加到上述丁二胺的水溶液中。滴加完成后,往溶液中先加入乙二醛(2.97 mL,0.0225 mol),溶液呈现金黄色,再加入甲醛溶液(1.58 mL,0.0225 mol),滴加完成后,加热升温至100 ℃,升温过程中溶液颜色逐渐加深,最后转变成黑色。升温完成后使用NaOH水溶液调节溶液的PH值至7左右。反应36 h。全程在搅拌状态下进行。反应完成后采用透析袋(MWCO:1 KD, Spectra/Por©6,美国)透析18 h左右,透析完成后-80 ℃冷冻干燥(2.5 L 冷冻干燥系统,LABCONCO,美国)处理。
采用类似方式制备了丙酸盐咪唑聚离子液体,丁酸盐咪唑聚离子液体,戊酸盐咪唑聚离子液体,己酸盐咪唑聚离子液体。合成路线见图1。
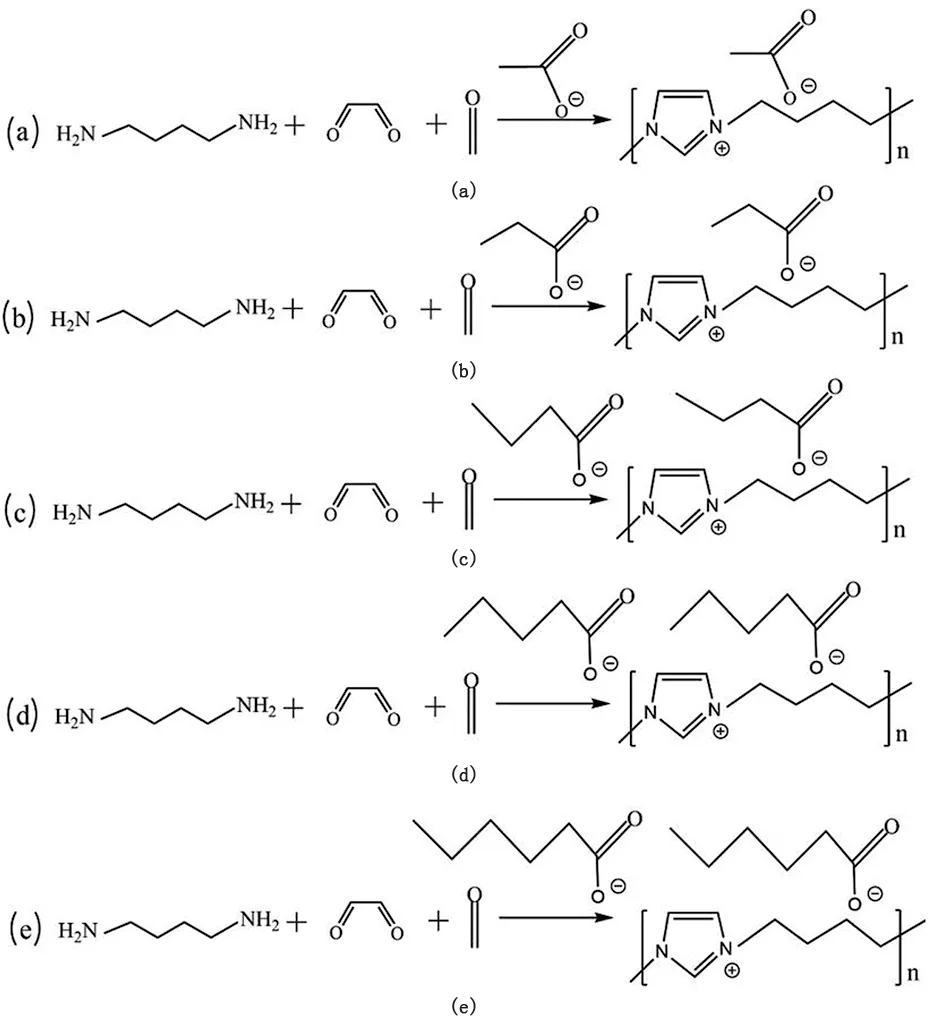
图1 (a). 聚丁基咪唑乙酸盐的合成;(b). 聚丁基咪唑丙酸盐的合成;(c).聚丁基咪唑丁酸盐的合成;(d). 聚丁基咪唑戊酸盐的合成;(e). 聚丁基咪唑己酸盐的合成
2.4 结构表征与性能测试
2.4.1红外光谱(FT-IR)测试 采用压片法进行检测,取少量样品混合在溴化钾粉末中,压制成片,使用傅里叶变换红外光谱仪(NICOLET IS 10,Thermo Fisher SCIENTIFIC,美国)进行测定,其分辨率为4 cm-1,扫描16次,扫描范围为400~4 000 cm-1。
2.4.2核磁共振 (1HNMR)测试 将少量纯化的样品充分溶于D2O中,采用核磁共振波谱仪(AVANCE II 500M,Bruker,德国)进行1HNMR的检测。
2.4.3Zeta电位测试 将五种聚离子液体分别溶于PBS配制成0.036 g/mL的溶液,再分别将这五种溶液稀释10倍与100倍,得到三组样品溶液,对这三组样品采用激光粒度仪(ZEN 3600, Malvern Instruments Ltd,英国)进行Zeta电位测试。
2.4.4粒径分布的测试 将五种聚离子液体用PBS缓冲液稀释至0.036,0.0036,0.00036 g/mL ,利用激光粒度仪(ZEN 3600, Malvern Instruments Ltd,英国)分别测定五种聚离子液体的平均粒径。
2.4.5最小抑菌浓度(MIC)测试 MIC是指能使细菌的发育受到阻滞并被观察到的抗细菌药物的最小浓度。MIC在诊断实验室里是抗细菌药物对细菌抵抗力的一个重要的指标[25]。本研究采用酶标仪(Infinite F50,Tecan,瑞士)测试了五种不同的咪唑盐类聚离子液体的最小抑菌浓度,先将三种菌液分别加入三种培养基中,大肠杆菌加入LB培养基(105CFU/mL),金黄色葡萄球菌加入MH培养基(105CFU/mL),白念球菌加入YPG培养基(105CFU/mL),放入台式恒温振荡器中,在37 ℃,200 r/h的条件下摇匀16~18 h,得到所需的菌液培养基。随后分别取三个96孔板,编号为1号、2号和3号,先在3个孔板的每个孔中分别加入LB液体培养基,MH液体培养基以及YPD液体培养基各100 μL,在第1行分别加入500 μg/mL的单体溶液,采用二倍稀释法依次稀释,然后在三个孔板的每个孔中分别加入100 μL大肠杆菌悬液,金黄色葡萄球菌悬液以及白念球菌悬液,混匀后(各行抗菌剂质量浓度分别为500、250、125、62.5、31.25、15.625 μg/mL)放入37 ℃恒温培养箱培养16~18 h。随后用酶标仪(Infinite F50,Tecan,瑞士)测量三个孔板上各孔的OD值,见式(1),杀菌率公式通过与初始浓度值的比较,计算得出聚离子液体对大肠杆菌,金黄色葡萄球菌以及白念球菌的最小抑菌浓度。
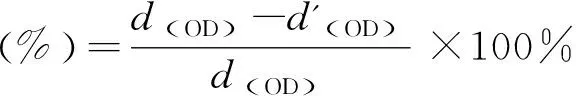
(1)
2.4.6细胞毒性测试 首先,将五种聚离子液体(聚丁基咪唑乙酸盐、聚丁基咪唑丙酸盐、聚丁基咪唑丁酸盐、聚丁基咪唑戊酸盐)溶于PBS中配置成13.5 mg/mL的溶液。其次,取上述五种配好的溶液(100 μL)加入96孔板中,与100 μL人皮肤成纤维细胞悬浮液(5×104cells/mL)混合,并在37 ℃,5% CO2气氛中孵育24~48 h,并以100 μL的1×PBS为空白对照;接着,向上述混合溶液中加入10 μL的CCK-8溶液,在37 ℃下继续培养1 h;然后使用酶标仪(Infinite F50,Tecan,瑞士)测量450 nm处的OD值。细胞存活率见式(2):
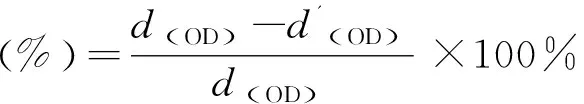
(2)
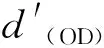
3 结果与讨论
3.1 红外光谱分析
由图2可知,所制备的五种咪唑盐类聚离子液体在1 564 cm-1处为咪唑环的伸缩振动峰,在1 160 cm-1出现的C=O的伸缩振动,和在3 427 cm-1出现的较宽的—OH的伸缩振动表明羧酸咪唑盐类聚离子液体被成功制备出来。图2(b)—(e)在2 967 cm-1处亚甲基吸收峰的强度逐渐增强是由于不同链长的羧酸阴离子与咪唑聚离子液体成盐,羧酸的链长越长,吸收峰的强度越高。

图2 (a).聚丁基咪唑乙酸盐的红外光谱;(b).聚丁基咪唑丙酸盐的红外光谱;(c).聚丁基咪唑丁酸盐的红外光谱;(d).聚丁基咪唑戊酸盐的红外光谱;(e).聚丁基咪唑己酸盐的红外光谱
3.2 核磁波谱分析
五种聚离子液体的1HNMR谱图见图3,在化学位移0.74 ppm处为侧链所接的羧酸末端甲基上的质子特征峰峰,1.0~2.0 ppm为与羧酸相邻的亚甲基质子特征峰,4.1 ppm以及1.4 ppm是烷基主链上的亚甲基吸收峰,7.4 ppm为咪唑环上的两个质子特征峰,由于亚甲基的数量不同,因此会有更多以及面积更大的峰出现。谱图上峰的位置和面积与结构式中氢的位置和数量相互对应。证明不同的羧酸成功接枝到了含有咪唑环的烷基链上。

图3 (a).聚丁基咪唑乙酸盐的核磁氢谱;(b).聚丁基咪唑丙酸盐的核磁氢谱;(c).聚丁基咪唑丁酸盐的核磁氢谱;(d).聚丁基咪唑戊酸盐的核磁氢谱;(e).聚丁基咪唑己酸盐的核磁氢谱
3.3 Zeta potential电位和平均粒径分析
采用ZEN 3600型激光粒度仪对五种聚离子液体进行了Zeta电位和平均粒径的分析,测试结果见图4。由粒径分析图中可以看出,所制备的羧基咪唑盐聚离子液体粒径分布较均匀,而且随着接入羧酸链烷基数目的增加,其粒径也逐渐增大。而由图4(b)可知,聚离子液体所带的正电荷也随着粒径的增大而增强。
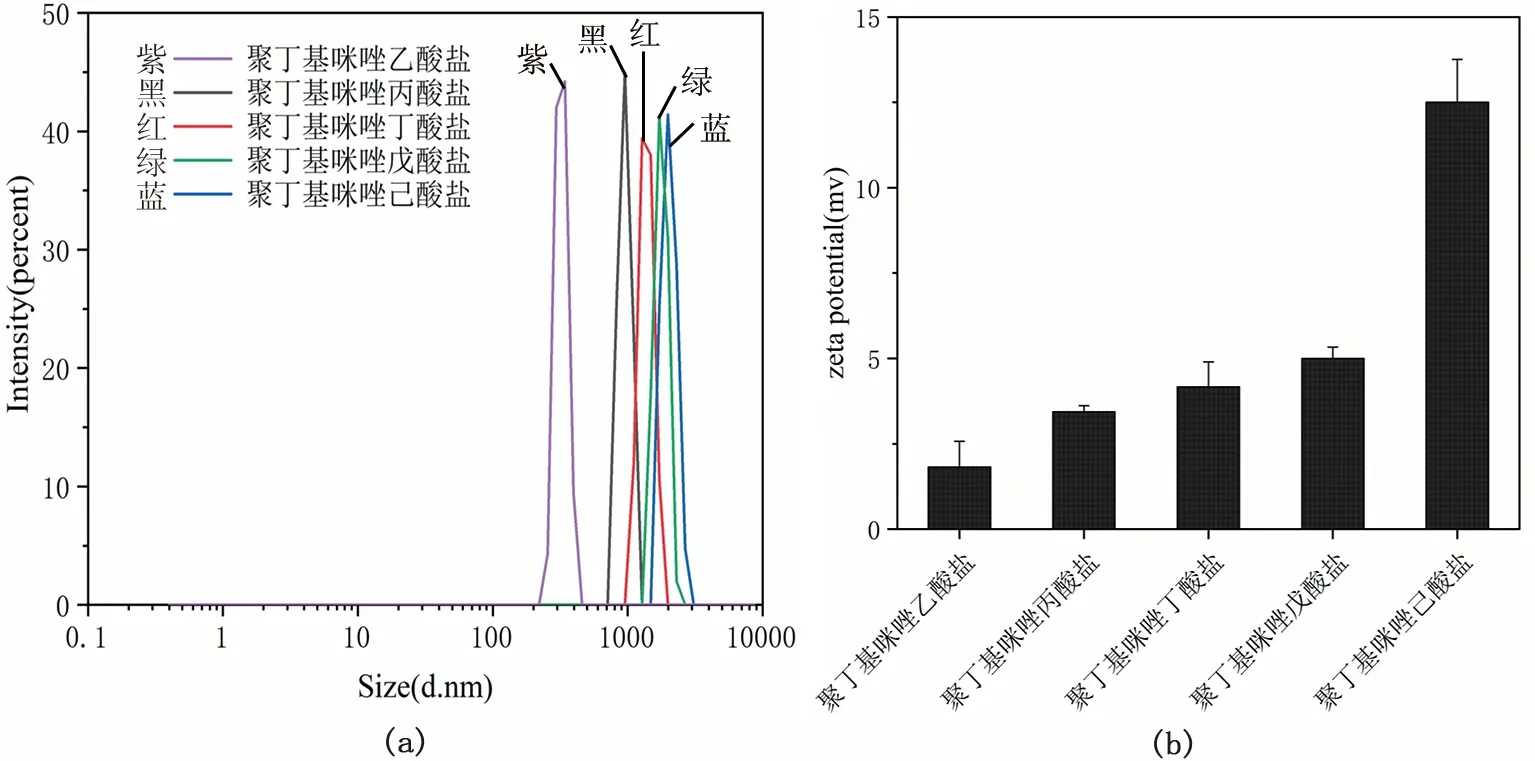
图4 五种聚离子液体的平均粒径分析和zeta电位(a). 平均粒径; (b). zeta电位Fig. 4 Zeta potential and analysis of average particle size of five poly(ionic liquids) (a) .average particle size; (b) .zeta potential
3.4 最小抑菌浓度测试
五种聚离子液体的最小抑菌值,见表1。从表中数据可以看到,聚丁基咪唑戊酸盐和聚丁基咪唑己酸盐的三种细菌的最小抑菌浓度普遍低于其余几种聚离子液体。这是由于,一方面随着聚离子液体正电荷的密度的增加,通过电荷吸引细菌的数量也在增加;另一方面,随着羧基链上烷基数目的增加,疏水链段增加,破坏细菌细胞壁的概率增加。此外,本研究还发现同一种聚离子液体对于白念球菌的抑菌效果要低于金黄色葡萄球菌和大肠杆菌,这是因为白念球菌相对于金黄色葡萄球菌和大肠杆菌繁殖力更强。
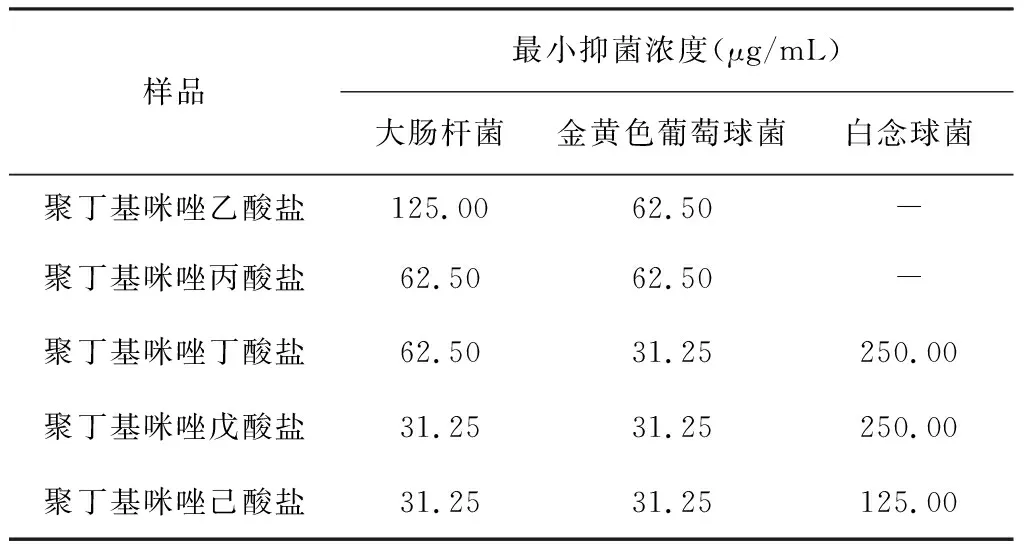
表1 五种聚离子液体的最小抑菌浓度测试
图5为通过OD值,并根据杀菌率公式所得出的五种聚离子液体分别对三种细菌的杀菌率,图中可以定量地看出五种聚离子液体对三种不同细菌的抑制效果,图5(a)随着聚合物浓度的升高,五种聚离子液体对大肠杆菌的杀菌率逐渐升高,其中聚丁基咪唑戊酸盐和聚丁基咪唑己酸盐的杀菌效果最好,它们在浓度较低的情况下对大肠杆菌的灭杀率已经达到了90%左右,而其余三种聚离子液体也能在后续浓度增加的情况下达到90%左右的杀菌率。由图5(b)可知,随着聚合物浓度的提高,五种聚离子液体对于金黄色葡萄球菌的抑制率也逐渐提升,最终达到了90%左右,并且对金黄色葡萄球菌的抗菌率要明显高于对大肠杆菌的抗菌率。图5(c)表明了五种聚离子液体对白念球菌的杀菌率,分子量较低的聚离子液体对白念球菌的灭杀率不太明显,在较高浓度时仍然没有很好的杀菌效果。
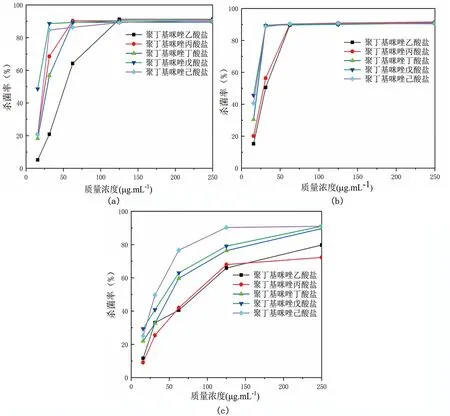
图5 (a).对大肠杆菌的抗菌率;(b).对金黄色葡萄球球菌的抗菌率;(c).对白念球菌的抗菌率
3.5 细胞毒性测试
通过对五种聚离子液体的细胞毒性测试,观察它们在抗菌方面的效果,细胞存活率见图6。随着接入羧酸的分子量不断增大,细胞的存活率呈现下降趋势。虽然细胞毒性逐渐增大,但细胞存活率的下降趋势较为缓慢,总体成纤维细胞的存活率要高于80%。 表明五种抗菌剂对细胞活性的影响不大,在生物医用方面有着良好的用途。
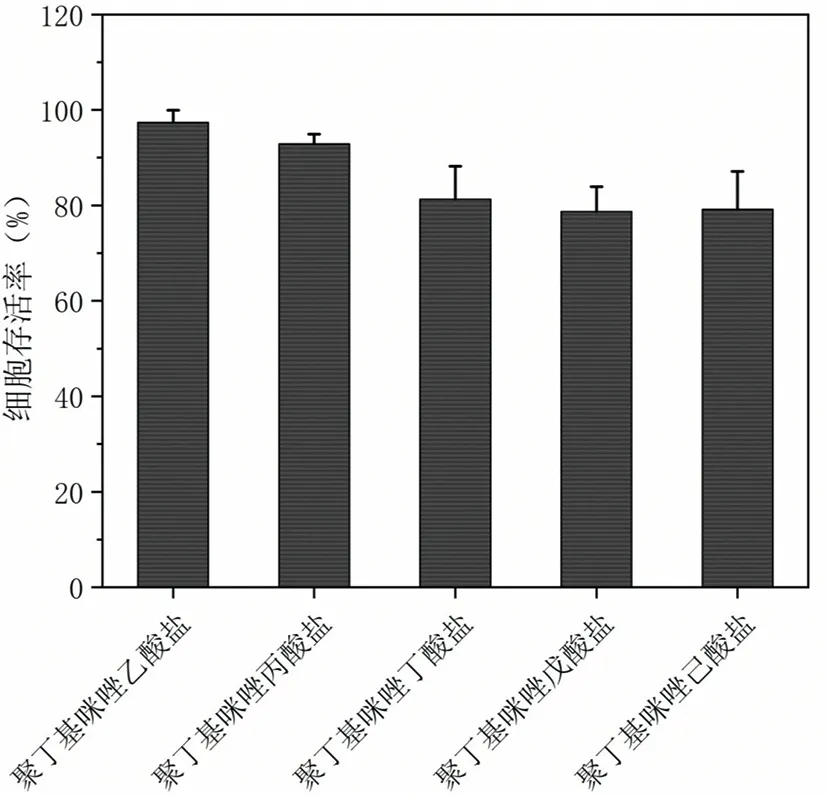
图6 五种聚离子液体的细胞毒性
4 结论
本研究以1,4—丁二胺,乙二醛,甲醛,乙酸,丙酸,正丁酸,正戊酸,正己酸为原料,采用“一锅法”制备出了五种含不同侧链的羧酸咪唑盐类聚离子液体,并通过红外光谱和核磁共振氢谱分析表征了其结构特征,而后对它们的抗菌性能进行了测试。随着羧基链上烷基数目的不断增加,所制备的羧酸咪唑盐类聚离子液体的抗菌性能逐渐提高,而细胞毒性虽然也呈上升趋势,但总体上对于细胞的存活率影响不大,可作为一种新型聚合物抗菌剂应用于生物医用材料中。

