内质网核糖体结合蛋白1表达上调对肝癌细胞迁移与侵袭的影响*
熊 兰,周晓榕,刘 丹,刘国晨
空军军医大学第二附属医院 疼痛科 (西安 710038)
内质网是真核细胞内参与物质运输、代谢与蛋白质合成等调控的重要场所[1]。越来越多的研究[2]表明,各种原因导致的细胞内质网应激与肿瘤的发生发展密切相关。内质网核糖体结合蛋白1(endoplasmic reticulum ribosome-binding protein 1,RRBP1)是内质网膜上参与内质网非蛋白折叠反应的重要蛋白之一,既往在结肠癌[3]、肺癌[4]、乳腺癌[5]等多种恶性肿瘤中证实了RRBP1表达的异常上调,但目前RRBP1在肝癌中的表达模式及生物学作用尚不十分清楚。本研究分别用基于TCGA公共数据库的生物信息学分析与免疫组化实验,分析RRBP1在肝癌尤其是转移性肝癌中的表达变化,并进一步通过体外细胞迁移与侵袭实验分析RRBP1在肝癌转移中的调控作用。
1 材料和方法
1.1 材料
肝癌HLF细胞购买自日本癌症研究资源库(Japanese cancer research resources bank, JCRRB)细胞库,细胞培养用加入10%血清的DMEM培养液,培养箱内温度设定为37 ℃,CO2浓度设定为5%。RNA提取试剂盒、RNA反转录试剂盒、荧光定量PCR反应96孔板、PCR试剂与PCR引物均购自上海生工生物公司。Transwell小室购自美国Corning公司,基质胶购自美国BD公司,所有抗体均购自武汉三鹰生物公司。
1.2 方法
1.2.1 RRBP1表达的生物信息分析 利用基于癌症基因组图谱(the cancer genome atlas,TCGA)的在线肿瘤基因表达分析工具UALCAN[6],对RRBP1在正常肝组织、未转移肝癌组织与转移肝癌组织中的表达进行分析。
1.2.2 免疫组化实验 选取2012~2019年空军军医大学第二附属医院(唐都医院)普外科收集的36对肝癌原发灶与转移灶组织,组织依次经4%多聚甲醛固定、石蜡包埋与切片后,进行免疫组化染色。实验步骤为:将切片置于 67 ℃温箱内加热1 h,之后依次置于3个重复的二甲苯、无水乙醇、85% 乙醇、70% 乙醇与3% H2O2的玻璃缸中浸泡,柠檬酸高压修复10 min后,用BSA封闭10 min,之后加入稀释过的RRBP1抗体在4 ℃孵育12 h,PBS缓冲液清洗3次,随后依次加入免疫组化试剂盒中的二抗、三抗与DAB。最后,用苏木精对细胞核进行衬染并对切片进行脱水、透明与封片。
1.2.3 细胞转染siRNA 将处在对数生长期的肝癌HLF细胞消化、离心并计数,随后按2×105个/孔的密度接种至6孔板内,细胞培养8 h贴壁后进行换液,随后用Lipofectamine 3000为转染介质,向肝癌HLF细胞内转染靶向RRBP1(siRRBP1)或对照(siCtrl)siRNA片段,转染8 h后为细胞更换新鲜培养液并继续培养24 h。siRRBP1序列为:5′-GCU CUGUAGUGAAUUCCAUTT-3′(正向)与5′-AU GGAAUUCACUACAGAGCTT-3′(反向);siCtrl序列为:5′-UUCUCCGAACGUGUCACGUTT-3′(正向)与5′-ACGUGACACGUUCGUAGAATT-3′(反向)。
1.2.4 RT-PCR实验 首先,用Trizol裂解液提取不同处理组肝癌细胞的总RNA,随后将RNA反转录合成cDNA,最后将反转录合成的cDNA进行实时荧光定量PCR。各目的基因扩增引物序列如下:RRBP1:正向:5′-TACGACACTCAAACCTTG GGG-3′;反向:5′-GTTGGCTAGGGCTTCTTCA TA-3′。E-cadherin:正向:5′-ATTTTTCCCTCG ACACCCGAT-3′;反向:5′-TCCCAGGCGTAGAC CAAGA-3′。N-cadherin:正向:5′-AGCTCCATTC CGACTTAGACA-3′;反向:5′-CAGCCTGAGCAC GAAGAGTG-3′。ZO -1:正向:5′-CGACCAGATC CTCAGGGTAA-3′;反向:5′-TCCATAGGGAGA TTCCTTCTCA-3′。Vimentin:正向:5′-GACGCC ATCAACACCGAGTT-3′;反向:5′-CTTTGTCGT TGGTTAGCTGGT-3′。内参β-actin:正向:5′-TC GCCTTTGCCGATCCG-3;反向:5′-ATGATCTG GGTCATCTTCTCG-3′。最后,用2-△△CT法计算各组细胞中目的基因的相对表达水平。
1.2.5 蛋白质印迹技术实验 首先,将不同处理组的肝癌细胞用含蛋白酶抑制剂的RIPA 裂解液于液冰上裂解0.5 h,随后将细胞裂解液转移至1.5 mL的离心管中,4 ℃,离心力14 000 r/min,离心半径13.5 cm,20 min后收集上清,加入5×loading buffer煮沸6 min,各组细胞所提的蛋白样品经聚丙烯酰胺凝胶分离后转印至PVDF膜上,将膜置于脱脂牛奶封闭1 h后加入稀释过的一抗(RRBP1),4 ℃孵育12 h后用缓冲液PBS洗膜3次,加入二抗于室温下孵育1.5 h,PBS洗膜3次后加入DAB显色。
1.2.6 细胞划痕实验 将不同处理组的肝癌细胞用胰酶消化、离心收集并计数,然后将2×105个细胞接种至6孔板内,培养12 h后待细胞铺满培养孔底面积约90%时,用枪头在直尺协助下划线,PBS洗去划痕处未脱落细胞,随后在显微镜下对划痕进行拍照,将培养板置于培养箱中培养48 h后,再次置于显微镜下对划痕进行拍照。最后,用Image J图像分析软件分析各组细胞划痕愈合程度。
1.2.7 Transwell细胞迁移与侵袭实验 将不同处理组的肝癌细胞用胰酶消化、离心收集并计数,迁移与侵袭实验分别用不带基质胶或带有基质胶的Transwell小室进行。用移液器将0.2 mL浓度为2×105个/mL的细胞悬液接种至Transwell小室内,小室下部加入0.5 mL含15%胎牛血清的 DMEM 培养液,将小室置于细胞培养箱中培养24 h(迁移实验)或48 h(侵袭实验)后取出。用棉签擦去上室内未发生迁移与侵袭的细胞,将迁移或侵袭至小室膜另一侧的细胞用4%多聚甲醛固定10 min后,随后加入结晶紫染色15 min,PBS清洗3次后,将小室置于通风橱内晾干,最后在显微镜下拍照和计数。
1.3 统计学方法

2 结果
2.1 RRBP1在肝癌转移灶中的表达
利用基于TCGA公共数据库的UALCAN在线分析工具,对RRBP1在正常肝组织、未发生转移的肝癌组织与发生转移的肝癌组织中的表达进行了分析,结果显示,RRBP1表达在正常肝组织中最低,其次为未发生转移的肝癌组织,而在发生转移的肝癌组织中表达最高(正常vs原位癌,P<0.001;原位癌vs转移癌,P<0.001),这提示RRBP1在促进肝癌发生与转移过程中发挥了重要作用(图 1)。

为验证公共数据分析所得结果,用免疫组化实验检测了36对肝癌原发灶组织与转移灶组织中RRBP1的表达,结果发现,RRBP1阳性染色主要集中在细胞浆中,并呈颗粒状着色(图2A)。与原发灶肝癌相比,RRBP1在转移灶肝癌组织中的表达升高(t=6.324,P<0.001)(图2B),进一步提示RRBP1在促进肝癌转移中发挥调控作用。
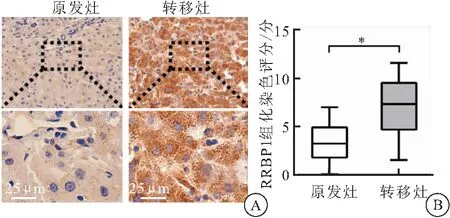
图2 免疫组化检测36对肝癌原发灶组织与转移灶组织中RRBP1的表达
2.2 下调RRBP1表达对肝癌细胞运动与迁移能力的影响
RRBP1在肝癌转移灶组织中表达高于原发灶,提示其可能在肝癌转移过程中发挥调控作用,因此在体外肝癌细胞中通过下调RRBP1表达,用划痕实验、Transwell迁移与侵袭实验分析了对肝癌细胞运动、迁移与侵袭能力的影响。
设计合成了靶向RRBP1表达的siRNA,并将其转入肝癌HLF细胞内,随后用RT-PCR与蛋白质印迹技术实验对RRBP1表达干涉效率进行了分析,结果发现,转染靶向RRBP1的siRNA 24 h后,肝癌细胞HLF中的RRBP1表达在mRNA(t=17.012,P<0.001)与蛋白水平中均明显降低,表明所构建RRBP1表达下调肝癌模型可满足后续细胞运动、迁移与侵袭实验的要求(图3)。
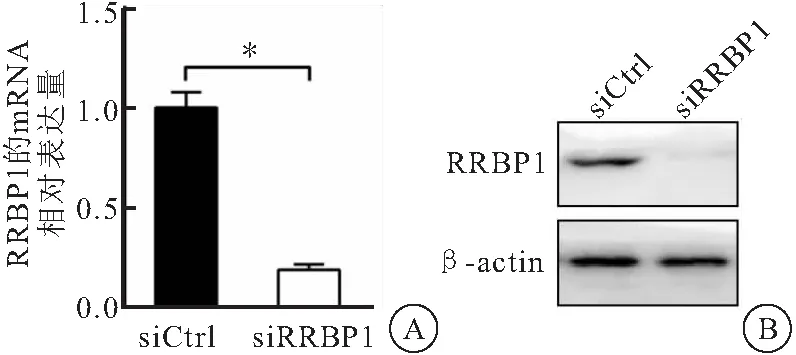
图3 转染siRNA对RRBP1表达的干涉效率鉴定
用细胞划痕实验分析了RRBP1在肝癌细胞运动中的调控作用,结果发现,与siCtrl组相比,siRRBP1组肝癌细胞的运动迁移距离变短(t=6.216,P=0.003),表明下调RRBP1抑制了肝癌细胞的运动能力(图4)。

图4 划痕实验分析下调RRBP1对肝癌HLF细胞运动能力的影响
与划痕实验结果一致,Transwell迁移实验同样发现,与siCtrl组相比,siRRBP1组的肝癌细胞由小室上侧迁移至小室下侧的细胞数目变少(t=8.674,P<0.001),进一步表明下调RRBP1抑制了肝癌细胞的运动迁移能力(图5)。
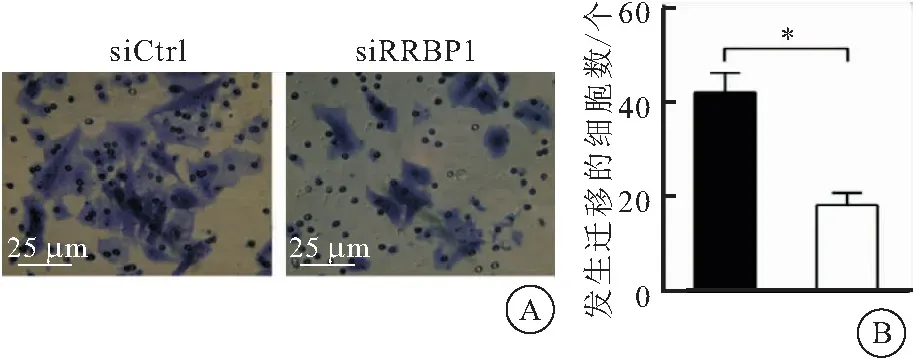
图5 Transwell迁移实验分析下调RRBP1对肝癌HLF细胞迁移能力的影响
2.3 下调RRBP1表达对肝癌细胞侵袭能力的影响
利用Transwell侵袭实验分析了下调RRBP1对肝癌细胞HLF侵袭能力的影响,结果发现,与siCtrl组相比,siRRBP1组肝癌细胞由基质胶一侧侵袭至另一侧的细胞数变少(t=4.426,P=0.012),表明下调RRBP1同样抑制了肝癌细胞的侵袭能力(图6)。

图6 下调RRBP1对肝癌细胞侵袭能力的影响
2.4 下调RRBP1表达对肝癌细胞上皮间质转化(epithelial-mesenchymal transition,EMT)的影响
EMT是肿瘤细胞获得迁移侵袭能力的重要机制,为分析RRBP1是否参与肝癌细胞的EMT,本研究用RT-PCR与蛋白质印迹技术实验分析了干涉RRBP1对EMT标志分子表达的影响,结果发现,干涉RRBP1表达上调了上皮标志E-cadherin(t=9.733,P=0.001)与ZO -1(t=24.380,P<0.001)的mRNA与蛋白表达,下调了间质标志N-cadherin(t=14.643,P<0.001)与Vimentin(t=12.368,P<0.001)的mRNA与蛋白表达,表明下调RRBP1抑制了肝癌细胞由上皮向间质的转化(图7)。

图7 干涉RRBP1对肝癌细胞EMT标志分子表达的影响
3 讨论
内质网是细胞内调控物质运输、生化反应与蛋白质合成等生物学过程的细胞器[1]。大量研究[7]表明,压力环境导致的内质网应激及其介导的蛋白质非折叠反应在多种恶性肿瘤的发生发展过程中发挥了重要作用。RRBP1是位于内质网膜上参与内质网非蛋白折叠反应的重要蛋白之一,可能在促进肿瘤恶性进展中发挥作用,但目前RRBP1在肝癌中表达与生物学作用,尤其是其在促进肿瘤转移中的作用尚不清楚。本研究利用生物信息学分析与免疫组化实验发现,RRBP1在肝癌组织中表达高于正常肝组织。尤为重要的是,RRBP1表达在发生转移的肝癌组织中高于未发生转移的肝癌组织,表明RRBP1与肝癌转移密切相关。与本研究所得结果类似,既往在膀胱癌中的研究[8-9]同样发现,与正常膀胱组织相比,膀胱癌组织中RRBP1 表达上调。该研究还发现,RRBP1表达水平与膀胱癌患者是否发生淋巴转移呈正相关。此外,宫颈癌[10]、前列腺癌[11]与食道癌[12]中的研究也均表明,RRBP1表达上调与淋巴结转移呈正相关。
转移是恶性肿瘤致死的最主要原因[13],本研究中发现,RRBP1在肝癌转移灶组织中表达高于原发灶,提示其可能在促进肿瘤转移中发挥作用。因此,分别用划痕实验、Transwell迁移与侵袭实验分析了RRBP1在肝癌运动、迁移与侵袭中的调控作用,结果发现,下调RRBP1抑制了肝癌的运动、迁移与侵袭,表明RRBP1表达上调促进了肝癌的转移。在膀胱癌的研究[8]中发现,下调RRBP1可抑制膀胱癌细胞的迁移与侵袭。子宫内膜癌的研究[14]也证实,RRBP1高表达与肿瘤在肌层浸润深度和淋巴结转移中均呈正相关。在肝癌的研究[15]中发现,糖尿病患者的高血糖可促进肝癌细胞的增殖与转移,而RRBP1表达上调是高血糖诱导肝癌生长与转移的主要机制,进一步说明RRBP1在促进肝癌进展中发挥了重要作用。EMT是肿瘤细胞获得迁移侵袭能力的重要机制[16-17],但目前各种类型肿瘤中RRBP1表达上调是否参与EMT过程尚不清楚。在肝癌研究中[15]发现,干涉RRBP1后肝癌上皮标志分子E-cadherin与ZO-1表达上调,间质标志N-cadherin与Vimentin表达下调,表明下调RRBP1抑制了肝癌细胞由上皮样向间质样的转化,提示RRBP1促进肿瘤细胞的迁移与侵袭可能是通过诱导细胞发生EMT。
综上所述,RRBP1在转移性肝癌组织中表达上调,并促进了细胞的迁移与侵袭,提示RRBP1是潜在抑制肿瘤转移的分子靶标。

