99Tcm-利妥昔单抗SPECT/CT 乳腺癌前哨淋巴结显像的临床评价
林秀艳 于丽娟 熊亮 蒋海壮 王玉君 李雪艳
海南省肿瘤医院(海南医学院附属肿瘤医院)核医学科,海口 570311
乳腺癌是威胁女性生命健康的常见恶性肿瘤之一。早期乳腺癌主要通过淋巴结转移。准确的淋巴结分期对于患者的预后和治疗方案的制定至关重要。前哨淋巴结(sentinel lymph node,SLN)活检作为早期可手术切除的乳腺癌患者腋窝淋巴结转移情况的评价标准,在国内外已达成共识[1]。乳腺癌患者在术前行SPECT/CT SLN 显像可以帮助临床医生更准确地确定SLN 的位置及数目。99Tcm-利妥昔单抗(99Tcm-Rituximab)作为新型淋巴结显像剂,在早期乳腺癌SLN显像研究中已被证实安全、有效[2-3]。因其具备无第Ⅱ、Ⅲ级淋巴结显影、显像成功率高、假阴性率低等特点,有着较好的应用前景。本研究回顾性分析99Tcm-利妥昔单抗 SPECT/CT 在乳腺癌SLN 中的诊断效能,旨在更好地指导临床医师术中准确检出SLN。
1 资料与方法
1.1 一般资料
回顾性分析2019 年7 月至2020 年7 月于海南省肿瘤医院经组织病理学检查证实的22 例女性乳腺癌患者的临床资料,年龄37~73 岁(中位年龄50.5岁)。纳入标准:(1)经组织病理学检查证实为乳腺癌;(2)临床触诊无肿大淋巴结;(3)彩超或其他影像学检查无可疑淋巴结转移或远处器官转移。排除标准:(1)合并其他恶性肿瘤;(2)接受过放疗、化疗、靶向治疗或免疫治疗。
所有患者均在检查前签署了知情同意书。本研究符合《赫尔辛基宣言》的原则。
1.2 方法
1.2.1 显像剂的制备及给药
使用利妥昔单抗-SH 示踪剂前体(北京大学肿瘤医院研究所核医学科赠予)与本科室钼锝发生器淋洗得到的高锝酸盐标记获得99Tcm-利妥昔单抗,经PD-10 层析柱分离纯化,放射化学纯度>95%。
手术前1 d 在患者乳腺肿块周围组织或肿瘤病灶表皮下注射示踪剂99Tcm-利妥昔单抗,注射点为12、3、6、9 点的位置,总注射剂量37 MBq(0.5 mL)。注射后16~18 h 行SLN 显像。
1.2.2 显像设备及图像采集
采 用 美国GE 公 司Discovery NM/CT 670 型SPECT/CT 仪进行显像。SPECT/CT 平面显像采集条件:低能高分辨平行孔准直器,能峰140 keV,窗宽10%,矩阵256×256,放大倍数1,采集计数约300 k。采集范围自颈根部至横膈水平。SPECT/CT 断层显像的采集条件:矩阵128×128,放大倍数1,每6°采集一帧,共采集60 帧,每帧采集16 s;同机CT 的采集条件:管电流150 mA,管电压120 kV。
1.2.3 图像分析
采用美国GE 公司Xeleris 3.1 工作站分析图像。由2 名具有5 年以上工作经验的核医学科医师在Xeleris 后处理工作站共同阅片,意见不一致时协商取得一致。阳性病灶的诊断标准:平面显像或断层显像除注射点以外的高于本底的放射性浓聚点为阳性,即诊断为SLN。通过SPECT 平面图像和SPECT/CT 融合图像共同确定SLN 数量并精准定位。
1.2.4 γ 探测器术中探测
22 例患者均于SPECT/CT SLN 显像后1~2 h进行手术,术中采用便携式γ 探测器(美国强生公司生产的麦默通NEOPROBE 型)探测腋窝或锁骨下SLN,当淋巴结的放射性计数达到注射点计数的10% 以上时,即确定为SLN。术中切除的SLN,如确诊为淋巴结转移者术中需要接受腋窝淋巴结清扫(axillary lymph node dissection,ALND),淋巴结未转移者不接受ALND。术后进行SLN 石蜡切片组织病理学检查进一步明确诊断。
2 结果
22 例女性乳腺癌患者,肿瘤长径为0.5~4.7(1.7±1.1) cm,其中cT1 期(肿瘤长径≤2 cm)19 例,cT2 期(2 cm<肿瘤长径≤5 cm)3 例。其他临床资料详见表1。

表1 22 例女性乳腺癌患者的临床资料Table 1 Clinical data of 22 female patients with breast cancer
22 例患者中,99Tcm- 利妥昔单抗 SPECT/CT 显像检出SLN 共67 枚,其中,1 枚者5 例(23%)、2 枚者6 例(27%)、3 枚者4 例(18%)、4 枚者4 例(18%)、5 枚者2 例(9%)、12 枚者1 例(5%);SPECT/CT 检出SLN 数量1~3 枚者居多(15 例,68%),位于腋窝者有20 例(91%),同时位于腋窝及锁骨下者有2 例(9%)。术中γ 探测器检出SLN 共81 枚,其中1 枚者1 例(5%)、2 枚者6 例(27%)、3 枚者5 例(23%)、4 枚者5 例(23%)、5 枚者3 例(14%)、6 枚者1 例(5%)、12 枚者1 例(5%);术中检出SLN 数量2~4 枚者居多(16 例,73%)。以患者为单位,99Tcm- Rituximab 显像的灵敏度为100%(22/22)、总符合率为100%(22/22);以淋巴结为单位,灵敏度为83%(67/81)、阳性预测值为100%(67/67)、总符合率为83%(67/81)。
22 例患者中,有5 例患者组织病理学检查结果发现SLN转移(23%),术中行ALND;17 例患者未发现SLN转移(77%),未行ALND,仅行SLN 切除活检及全乳房切除术。典型病例见图1。
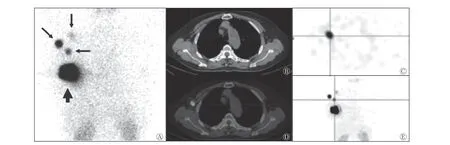
图1 乳腺癌患者(女性,55 岁)99Tcm-利妥昔单抗 SPECT/CT 前哨淋巴结显像 发现右侧乳腺肿物3 个月,彩超诊断为乳腺癌,乳腺影像报告和数据系统 5 级,右侧腋窝未见肿大淋巴结,术前SPECT/CT 显像检出前哨淋巴结3 枚,术中检出前哨淋巴结3 枚。A 为前哨淋巴结SPECT 平面显像图,细箭头为前哨淋巴结显影,粗箭头为注射点;B~D 分别为前哨淋巴结CT、SPECT、SPECT/CT 融合图像;E 为最大密度投影图。Rituximab 为利妥昔单抗;SPECT 为单光子发射计算机断层显像术;CT 为计算机体层摄影术Figure 1 99Tcm-Rituximab SPECT/CT imaging of sentinel lymph nodes in a breast cancer patient(female,55 years old)
3 讨论
我国乳腺癌的发病率和病死率逐年上升,并且呈年轻化趋势。外科手术是治疗乳腺癌的主要手段,手术方式的演变经历了局部切除、根治术、扩大根治术、改良根治术和现在的保乳术。乳腺癌根治术、扩大根治术和改良根治术都需要进行ALND,目的是为了对淋巴结进行更好的分期,准确的淋巴结分期对于乳腺癌患者的预后和治疗至关重要。但术中行ALND 容易损伤周围的腋窝神经、血管和淋巴管,导致术后患侧上肢淋巴水肿、疼痛、活动受限等并发症的发生,严重影响患者的生活质量。乳腺癌手术的发展越来越注重保护患侧肢体的功能,尽可能避免术中创伤。相关研究发现,乳腺癌SLN 活检是一种有效的腋窝淋巴结分期方法,对于腋窝SLN未发生转移的早期乳腺癌患者,可以免去ALND,避免了上肢淋巴水肿等并发症的发生,研究结果表明,SLN 活检组的总生存率和无事件生存率与ALND 组之间的差异无统计学意义[4-6]。另外,《中国抗癌协会乳腺癌诊治指南与规范(2019 年版)》[7]指出,SLN 活检是早期浸润性乳腺癌腋窝淋巴结分期的标准手段,对于SLN 阴性或1~2 枚影像可疑转移的患者,SLN 活检可安全替代ALND。显然,早期乳腺癌患者常规进行SLN 活检在国内已达成共识。
有关乳腺癌SLN 显像的研究较多,如何选择合适的示踪剂指导SLN 活检是临床研究的热点。临床常常使用的乳腺癌SLN 示踪剂主要有蓝染料、核素示踪剂、荧光示踪剂和纳米碳等。《中国抗癌协会乳腺癌诊治指南与规范(2019 年版)》[7]推荐联合使用蓝染料和核素示踪剂指导术中淋巴结活检。单独使用蓝染料法进行SLN 活检具有较高的假阴性率[8]。荧光法联合蓝染法使用使得乳腺癌SLN 的检出率和准确率有所提高[9-11],但由于吲哚菁绿颗粒较小,Ⅱ级或Ⅲ级淋巴结也可显像,且其穿透距离有限,深部的淋巴结难以探测,使得显像结果不稳定。有研究者尝试将利妥昔单抗与吲哚菁绿进行偶联,创新研发一种新型荧光靶向示踪剂(吲哚菁绿-利妥昔单抗),初步的小鼠模型研究结果显示,新型示踪剂在注射6 h 内从未出现Ⅱ级或Ⅲ级淋巴结显像,推测其具有重要临床价值,但目前该研究尚缺乏临床数据证实[12-13]。袁泉和王伟[14]通过比较纳米炭联合亚甲蓝示踪法、单纯亚甲蓝示踪法和单纯纳米炭示踪法用于乳腺癌SLN 活检的结果显示,3 种方法的检出率均高于90%,其中联合方法的检出率最高。由于纳米炭在术中的注射时间不好掌控且价格相对较高,未能普遍应用。新型靶向型99Tcm-利妥昔单抗作为乳腺癌SLN 示踪剂在早期研究中获得了较高的成功率和较低的假阴性率[15],且Wang 等[16]通过对2947 例SLN 阴性、未行ALND 的乳腺癌患者进行动态随访,结果显示肿瘤复发率较低,在临床应用方面取得较为满意的效果。然而,受设备、场地、放射性及人员技术等条件的限制,使用99Tcm-利妥昔单抗的医疗单位较少,目前该示踪剂仍处于推广阶段。
利妥昔单抗是一种针对B 淋巴细胞膜表面CD20分子而制成的人鼠嵌合型单克隆抗体,B 淋巴细胞在淋巴结内分布广泛,淋巴结内所有B 细胞均表达CD20 抗原,尤以生发中心内的B 淋巴细胞为著,因此,放射性核素标记的利妥昔单抗通过与淋巴结内的CD20 抗原相结合可以使SLN 显影[2]。与常规颗粒型示踪剂相比,99Tcm-利妥昔单抗具有结合紧密,不易脱落,可使 SLN 在较长时间范围内显影(24 h 内),而淋巴结内靶结合位点CD20分子充足,SLN 对示踪剂99Tcm-利妥昔单抗摄取的饱和阈值较大,因此,当注射抗体量低于SLN 上CD20 结合位点的饱和量时,几乎无第Ⅱ、Ⅲ级淋巴结显影的问题[17]。
本研究纳入的22 例早期乳腺癌患者均接受了术前99Tcm-利妥昔单抗 SPECT/CTSLN 显像和术中γ 探测器探测,结果显示,99Tcm-利妥昔单抗作为乳腺癌SLN SPECT/CT 显像剂,其检出灵敏度、总符合率均较高,显像效果满意。其中17 例未发生SLN 转移患者均未接受ALND,避免了上肢淋巴水肿等并发症的发生。研究中部分SPECT/CT显像检出的SLN 数量与γ 探测器检出的淋巴结数量不一致,分析其原因可能是由于多个小淋巴结聚集或紧邻,SPECT/CT 判读时误将多个聚集小淋巴结当成一个淋巴结统计,导致显像结果与术中检出的SLN 数量不符。
综上,99Tcm- 利妥昔单抗作为新型乳腺癌SLN显像剂,其显像效能高,术前SPECT/CT SLN 显像可以帮助临床医生术中更准确地寻找淋巴结,此外,乳腺癌SPECT/CT 显像还能更好地显示除了腋窝以外的SLN(如锁骨下、内乳区等),为制定个体化手术方案提供了重要依据。
利益冲突本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明林秀艳负责数据的收集、论文的撰写;于丽娟负责方法的建立、论文的审阅;熊亮、蒋海壮、王玉君负责临床的试验、图像的采集;李雪艳负责数据的统计与分析。

