栀子黄对淀粉消化酶的抑制动力学及相互作用研究
任顺成,万 毅,李林政,潘天义
(1 河南工业大学 河南省天然色素制备重点实验室 郑州450001 2 河南中大恒源生物科技股份有限公司 河南漯河462600)
糖尿病是一种多病因综合作用导致的代谢性疾病,其特点是慢性高血糖,伴随因胰岛素分泌不足和(或)作用障碍引起的糖、脂肪、蛋白质代谢紊乱。世界卫生组织将糖尿病主要分为两类:Ⅰ型糖尿病,主要原因是胰腺β-细胞遭到破坏,导致血浆胰岛素水平低下;Ⅱ型糖尿病,是一种非感染性慢性代谢综合征,其特点是胰岛素分泌受损和靶组织对胰岛素作用的抵抗而导致的高血糖[1]。据统计,Ⅱ型糖尿病是世界范围内最常见的糖尿病,占所有糖尿病患者的90%以上,被认为是主要的公共卫生问题[2]。预计2030年糖尿病将成为人类第七大致死因素,被公认为 “无声杀手”。预计到2035年,受影响的人数将增加到5.92 亿[3]。世界卫生组织最近公布的统计数据显示,全世界大约有15 亿成年人超重和肥胖,这使他们具有患糖尿病的潜在风险[4]。
在食物消化过程中,淀粉被α-淀粉酶和α-葡萄糖苷酶共同作用水解成单糖,抑制这些酶的活性可显著降低餐后血糖升高[5-6]。抑制淀粉水解和葡萄糖的吸收是预防Ⅱ型糖尿病的有效途径。近些年来,膳食活性成分在预防慢性疾病中的作用受到广泛关注。据统计,目前有800 余种植物提取物可能对糖尿病的治疗起积极的作用[7]。关于植物提取物作为淀粉消化酶抑制剂的研究成为热点。栀子是我国治疗糖尿病传统药物,是一种含有多种有效活性成分的药食两用资源,具有抗炎、抗氧化、保护神经等多种药理作用[8-10]。肖小华等[11-12]报道栀子黄含量为1.67 g/kg 时能显著降低不同糖负荷的小鼠血糖,后续研究发现栀子提取物对α-葡萄糖苷酶产生抑制作用的有效部分可能是环烯醚萜和栀子黄色素类。Zhou 等[13]通过研究栀子对治疗Ⅱ型糖尿病的动物实验粪便组学从侧面证实了栀子黄的降糖效果。李春英等[14]报道栀子黄抑制α-葡萄糖苷酶活性,然而,具体作用机制不详。本研究探讨栀子黄对α-淀粉酶和α-葡萄糖苷酶的影响及其作用动力学,通过光谱特征分析两种淀粉消化酶结构变化,揭示栀子黄对餐后血糖升高的抑制作用机制,以期为糖尿病患者功能产品的开发提供试验依据。
1 材料与方法
1.1 材料与试剂
栀子黄(色价500),河南中大恒源生物科技有限公司;小麦淀粉(含水量12.89%),泰州市好食惠调味品有限公司;α-淀粉酶(50 U/mg),美国Sigma 公司;α-葡萄糖苷酶(7 000 000 U/mL),上海源叶生物科技有限公司;4-硝基苯基-α-D-吡喃葡糖苷(PNPG),麦克林生化科技有限公司;3,5-二硝基水杨酸,国药集团化学试剂有限公司。其余试剂均为分析纯,天津科密欧化学试剂有限公司。
1.2 仪器与设备
UV-1600B 紫外可见分光光度计,上海美谱达仪器有限公司;FA1004 电子分析天平,上海上平仪器公司;Multiskan FC 96 孔酶标仪,赛默飞世尔仪器有限公司;G9800A 荧光分光光度计,安捷伦科技有限公司;MVS-1 旋涡混合器,北京金北德工贸有限公司;SHZ-82 数显水浴恒温振荡器,金坛华峰仪器有限公司。
1.3 方法
1.3.1 栀子黄对α-淀粉酶抑制动力学研究 使用米氏方程(Michaelis-Menton)和Lineweaver-Burk 方程确定栀子黄对α-淀粉酶的抑制方式[15]。以小麦淀粉溶液作底物磷酸盐缓冲液溶解后在80 ℃的水浴锅中糊化30 min。淀粉质量分数为0.5%,1.0%,1.5%,2.0%。栀子黄溶液质量浓度定为0.5,0.7 mg/mL。向具塞试管中先加入不同浓度栀子黄溶液250 μL,再添加250 μL α-淀粉酶溶解液37 ℃振荡10 min,再加入500 μL 不同浓度的底物溶液,每隔5 min 取出相对应的试管并加入2.0 mL DNS 显色剂沸水中加热5 min 后冷却至室温,定容至25 mL,540 nm 处测量其吸光度。
1.3.2 栀子黄对α-葡萄糖苷酶抑制动力学研究α-葡萄糖苷酶与α-淀粉酶的试验方法大致相同。栀子黄溶液浓度仍然为0.5,0.7 mg/mL,试验中需要将作为底物的PNPG 溶液的浓度范围设定为0.5~5.0 mmol/L。向96 孔酶标板中先加入80 μL 磷酸盐缓冲溶液按设定加入20 μL 不同浓度的栀子黄溶液和60 U/mL 的α-葡萄糖苷酶溶液,37 ℃气浴振荡10 min 后加入20 μL PNPG 底物溶液,每隔5 min 取出酶标板并加入100 μL 的0.2 mol/L 的碳酸钠溶液终止反应,用96 孔酶标仪在405 nm 处测定吸光度。具体的方程计算情况与上述的α-淀粉酶的过程相一致。
1.3.3 α-淀粉酶荧光光谱测定 探究不同浓度栀子黄对α-淀粉酶的荧光猝灭光谱。在磷酸盐缓冲液中配置质量浓度0.025,0.1,0.3,0.5,0.7,1 mg/mL 的栀子黄;将α-淀粉酶(300 U/mL)溶解到pH 6.8 的磷酸盐缓冲液中,在3 mL 的α-淀粉酶的溶液中加入0.2 mL 不同浓度的栀子黄漩涡振荡2 min 定容至10 mL。将混合液分别在30 ℃和37 ℃的水浴条件下恒温振荡30 min。以等量的栀子黄溶液为空白参比,激发波长278 nm,发射波长290 nm,狭缝宽度5 nm,在290~500 nm 波长范围内进行荧光发射光谱扫描。
1.3.4 α-葡萄糖苷酶荧光光谱分析 α-葡萄糖苷酶荧光光谱分析与α-淀粉酶类似,其中α-葡萄糖苷酶的酶活力大小为180 U/mL 激发波长278 nm,发射波长290 nm,狭缝宽度5 nm,在290~450 nm 波长范围下进行荧光发射光谱扫描。其中的对照试验与上述α-淀粉酶的方法与操作相同。
同步荧光光谱试验与1.3.3 节过程大致相同,在上述荧光猝灭试验基础上,将参数改变为:α-淀粉酶,α-葡萄糖苷酶均在波长200~400 nm 范围内,通过设定激发波长间隔和发射波长间隔在△λ=15~60 nm 的设定下进行荧光光谱扫描[16]。
酶的抑制动力学可以通过以下方程表示:
Michaelis-Menton 方程:

Lineweaver-Burk 方程:

不同I下的双倒数直线得出斜率Slope。利用I和Slope 再次作图得出Kic。方程如下:
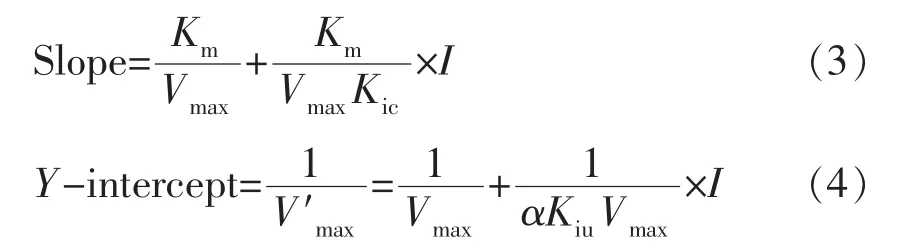
将斜率(Slope)或截距(Y-intercept)与I的二次重绘图并进行线性拟合。式(1)、(2)、(3)、(4)中:V——初始反应速度,mg/mL/min;S——底物质量浓度,mg/mL;Vmax——最大初始反应速度,mg/mL/min;I——抑制剂质量浓度,mg/mL;α——表观系数;Km——米氏常数;Kic——竞争性抑制常数;Kiu——非竞争性抑制常数。
荧光猝灭通过Stern-Volmer 方程描述:

式(5)中:F0和F——分别为不存在和存在猝灭剂时荧光物质的荧光强度;Ksv和Kq——分别为Stern-Volmer 猝灭常数和受扩散过程控制的双分子荧光猝灭速率常数;[Q]——猝灭剂质量浓度,mg/mL;τ0——荧光分子平均寿命(α-淀粉酶的τ0为2.97 ns,α-葡萄糖苷酶的τ0为10-8s)。
1.3.5 结合常数和结合位点数的计算 结合常数结合位点通过以下方程[17]描述:

式(6)中:Ka——栀子黄与α-淀粉酶和α-葡萄糖苷酶的结合常数;n——结合位点数。
1.3.6 热力学参数评价 小分子与生物大分子之间可通过疏水键、静电引力、范德华力和氢键等发生相互作用。热力学参数焓变ΔH和熵变ΔS可根据Van’t Hoff[15]方程确定:

式(7)中:R——大气常数,其值为8.314 J/(mol·K);T——反应温度(303 和310 K);Ka——结合常数。自由能ΔG由下式计算:

ΔH和ΔS的值由lnKa对1/T的线性图的斜率和截距计算。
1.3.7 栀子黄与淀粉消化酶相互作用的结合距离以水为参比,在300~500 nm 波长范围内扫描栀子黄的紫外光谱,并根据α-淀粉酶和α-葡萄糖苷酶的荧光光谱和栀子黄的紫外吸收光谱的重叠图谱计算结合距离。荧光共振能量转移(FRET)是一种距离依赖的相互作用,它是由供体分子(蛋白质)向受体分子(药物)非辐射传递的激发能。能量传递效率可以用来评价配体与蛋白质中色氨酸残基之间的距离[18]。
非辐射能量转移将发生在供体(α-淀粉酶或α-葡萄糖苷酶)和受体栀子黄之间,而条件是(a)供体可产生荧光;(b)供体的荧光发射光谱和受体的吸收光谱有部分重叠;(c)供体和受体之间的距离约小于8 nm。根据Förster 非辐射能量转移理论[19],能量转移效率(E)不仅与受体和供体之间的距离(r)有关,而且与临界能量转移距离(R0)有关,即:

式(9)中:R0——转移效率为50%时的临界距离,nm;r——受体与供体之间的距离,nm。

式(10)中:K2——供体与受体各项随机分布的空间取向因子;N——介质的折射率;φ——不存在受体的情况下供体荧光量子产率;J——供体荧光发射光谱和受体吸收光谱之间的重叠积分;其计算公式如下:
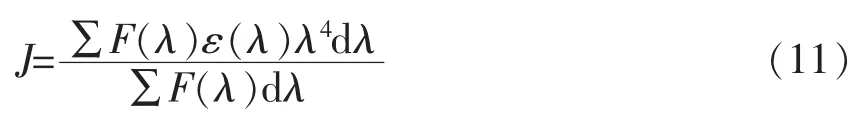
式(11)中:F(λ)——荧光供体在波长λ 的荧光强度;ε(λ)——受体在波长λ 下的摩尔吸光系数。能量转移效率E计算公式为:

式中:F0和F与方程式(5)中的相同。
1.3.8 统计分析 使用origin2017 作图,使用SPSS 21 统计软件包分析所有数据,结果表示为平均值±标准偏差(n=3)。P<0.05 被认为是显著差异。
2 结果与讨论
2.1 抑制动力学研究
本研究用淀粉和pNPG 作为底物得到α-淀粉酶和α-葡糖苷酶的Lineweaver-Burk 图,并确定其抑制类型,结果见图1 和表1。对α-淀粉酶和α-葡萄糖苷酶来说最大速度(Vmax)值为0.52 和3.11×10-2mg/(mL·min)保持不变,不同浓度的栀子黄存在均使米氏常数(Km)增加表明:栀子黄在两种酶(α-淀粉酶和α-葡萄糖苷酶)分子上与酶-底物结合位点竞争结合并形成复合物,继而通过减少底物与酶的结合来降低酶促速率。即栀子黄与α-淀粉酶以及α-葡萄糖苷酶的活性中心结合,从而产生对酶蛋白活性的影响。这与多酚类物质抑制淀粉消化酶类似[20]。竞争性抑制常数Kic是抑制剂-酶复合物的解离常数,因此,1/Kic代表抑制剂与酶的缔合常数;Kic值较低意味着抑制剂与酶活性位点的结合亲和力较高[21]。栀子黄对α-淀粉酶的Kic(1.47)大于α-葡萄糖苷酶Kic(0.58),意味着栀子黄对α-葡萄糖苷酶的结合亲和力更高。

图1 栀子黄对α-淀粉酶(a)和α-葡萄糖苷酶(b)抑制作用的Lineweaver-Burk 曲线Fig.1 Lineweaver-Burk curve of inhibitory effect of gardenia yellow on α-amylase(a)and α-glucosidase(b)

表1 栀子黄对α-淀粉酶和α-葡萄糖苷酶的抑制动力学参数Table 1 Inhibitory kinetic parameters of gardenia yellow on α-amylase and α-glucosidase
2.2 荧光光谱分析
图2、图3 反映了不同浓度的栀子黄在不同温度下对α-淀粉酶和α-葡萄糖苷酶之间的荧光光谱图。随着栀子黄浓度的增大,α-淀粉酶和α-葡萄糖苷酶的荧光强度呈现不同程度的降低,即荧光猝灭现象。此外,图2 和图3 发现α-淀粉酶和α-葡萄糖苷酶的最大发射峰所处的波长发生红移,说明栀子黄与两种淀粉消化酶发生相互作用。为了阐述作用机制,使用Stern-Volmer 方程分析荧光数据。
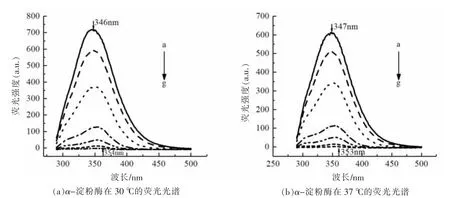
图2 栀子黄对α-淀粉酶荧光光谱图Fig.2 The fluorescence spectrum of gardenia yellow to α-amylase
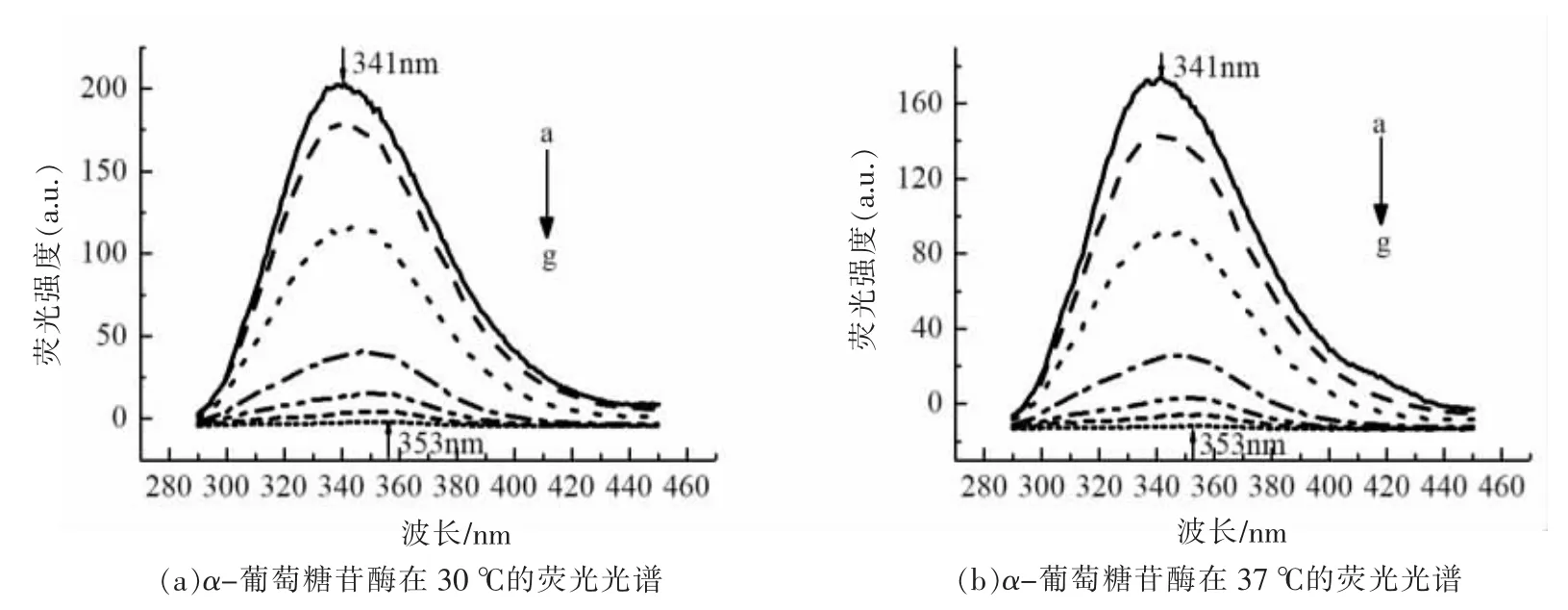
图3 栀子黄对α-葡萄糖苷酶荧光光谱图Fig.3 The fluorescence spectrum of gardenia yellow to α-glucosidase
图4 的Stern-Volmer 图可以看到栀子黄对α-淀粉酶和α-葡萄糖苷酶的Stern-Volmer 的曲线是向y轴弯曲的曲线。荧光测量提供了有关发色团分子附近分子环境的信息。蛋白质荧光强度的降低称为蛋白质荧光猝灭,这种猝灭可通过不同的机制,碰撞猝灭(动态猝灭)是激发态荧光团与溶液中的其它分子(猝灭剂)接触而失活时发生。静态猝灭为荧光团与猝灭剂形成非荧光配合物[22]。线性Stern-Volmer 曲线表明蛋白质中有一类荧光团以相同的方式与淬灭剂相互作用,并且只有一种淬灭机制(动态或静态)发生。然而,当淬灭程度较大时,经常观察到方程的正偏差。在这种情况下,F0/F与[Q]描述了一条向上的曲线,向y轴凹陷。通常,向上弯曲表明有几种机制负责蛋白质中荧光团的猝灭效应(既有动态猝灭又有静态猝灭),或者它表明存在“作用域”(作用范围[22]),即表观静态猝灭[23]。描述这种情况的Stern-Volmer方程的修改形式如下[20]:

图4 栀子黄对α-淀粉酶(a)和α-葡萄糖苷酶(b)荧光淬灭Stern-Volmer 图的影响Fig.4 Influences of gardenia yellow on fluorescence quenching Stern-Volmer graphs of α-amylase(a)and α-glucosidase(b)

将此方程两边取自然对数,作ln(F0/F)与[Q]的图,得到一条直线,该直线斜率即为表观静态常数KSV即:

生物高聚物在不同的猝灭剂最大动态猝灭常数是2×1010mol-1s-1,表2 中栀子黄对α-淀粉酶的猝灭常数(1.40×1011mol-1s-1/1.26×1011mol-1s-1)和α-葡萄糖苷酶的荧光猝灭常数(2.92×1011mol-1s-1/5.10×1011mol-1s-1)远大于2×1010mol-1s-1,说明了猝灭方式是静态猝灭为主,此外,猝灭常数反映了猝灭剂与生物高聚物的亲和性[16,24],α-葡萄糖苷酶的猝灭常数大于α-淀粉酶,说明栀子黄对α-葡萄糖苷酶有更好的亲和力。也印证了2.1 节抑制动力学上栀子黄对α-葡萄糖苷酶有着更好的抑制作用。

图5 栀子黄对α-淀粉酶(a)和α-葡萄糖苷酶(b)荧光淬灭Stern-Volmer 图修改图的影响Fig.5 Influences of gardenia yellow on modified fluorescence quenching Stern-Volmer charts of α-amylase(a)and α-glucosidase(b)

表2 α-淀粉酶和α-葡萄糖苷酶的Stern-volmer 方程及参数Table 2 Stern-Volmer equation and parameters of α-amylase and α-glucosidase
2.3 结合常数和结合点数
栀子黄对α-淀粉酶和α-葡萄糖苷酶的结合常数Ka和结合点数n如表3所示,随着温度的变化,两种淀粉消化酶的结合常数和结合点数都发生了一定的变化,侧面反映了温度是栀子黄对两种酶作用的重要因素,随着温度的升高,α-淀粉酶的Ka值下降,表明了栀子黄对α-淀粉酶的作用随着温度的升高,其亲和力下降。而α-葡萄糖苷酶随着温度的升高其与栀子黄的亲和力逐渐上升(30~37 ℃之间)。n值略大于1 说明了栀子黄对于两种消化酶的作用可能有着超过一个或者一类的结合位点[16]。也从数据可以看出在37 ℃的条件下α-葡萄糖苷酶的Ka大于α-淀粉酶,表明α-葡萄糖苷酶与栀子黄的亲和力在同等条件下大于α-淀粉酶,与之前抑制动力学结果类似。

表3 α-淀粉酶和α-葡萄糖苷酶结合常数及结合点数Table 3 Binding constants and binding points of α-amylase and α-glucosidase
2.4 热力学参数计算
热力学分析为了确定在上述基础上栀子黄与淀粉消化酶相互作用的主因。表4 计算了α-淀粉酶的ΔH和ΔS的值为分别-43.22,-34.01 kJ/mol;α-葡萄糖苷酶ΔH和ΔS分别为234.882,0.874 kJ/mol。可以根据表5 中ΔH、ΔS取值情况推导出配体和生物分子之间作用力类型[25]。结果表明,栀子黄与淀粉消化酶(α-淀粉酶和α-葡萄糖苷酶)的ΔG均为负值,表明结合过程是自发发生的。如表5所示,范德华力是栀子黄-α-淀粉酶相互作用过程中的主要驱动力。疏水作用力是栀子黄-α-葡萄糖苷酶相互作用过程中的主要驱动力[26]。

表4 α-淀粉酶和α-葡萄糖苷酶热力学参数计算Table 4 Calculation of thermodynamic parameters of α-amylase and α-glucosidase

表5 热力学参数分析Table 5 Thermodynamic parameter analysis
2.5 同步荧光测量
由图可知,随着栀子黄的加入α-淀粉酶和α-葡萄糖苷酶的两种氨基酸残基发生荧光猝灭,当Δλ=15 nm 时,α-淀粉酶的酪氨酸残基最大发射波长从297 nm 蓝移至284 nm。α-葡萄糖苷酶的酪氨酸残基最大发射波长从292 nm 蓝移至287 nm。蓝移和红移分别代表荧光载体(Tyr 和Trp)周围疏水性和极性环境的增强[25]。可能由于栀子黄与α-淀粉酶和α-葡萄糖苷酶相互作用,引发酶的内部结构发生改变,导致两种淀粉消化酶酪氨酸残基疏水性增加,所处微环境的极性有所减弱。当Δλ=60 nm 时,可明显看出α-淀粉酶的色氨酸残基最大发射波长从287 nm 红移至290 nm,而α-葡萄糖苷酶的色氨酸残基变化不大,该结果阐明了α-淀粉酶因栀子黄的加入使色氨酸残基所处微环境的极性,也一定程度反映了随着在栀子黄加入对α-淀粉酶酪氨酸残基和色氨酸残基附近都会产生构象的变化,而栀子黄对α-葡萄糖苷酶的影响主要是在酪氨酸残基附近。

图6 α-淀粉酶同步荧光光谱图Fig.6 Synchronous fluorescence of α-amylase

图7 α-葡萄糖糖苷酶同步荧光光谱Fig.7 The synchronous fluorescence spectrum of α-glucosidase
2.6 栀子黄与淀粉消化酶结合距离计算
栀子黄与α-淀粉酶和α-葡萄糖苷酶的结合距离见表6。从表6 可以看出栀子黄与α-淀粉酶与α-葡萄糖苷酶的结合距离r分别为4.77 nm 和5.19 nm,均小于8 nm,且都满足0.5R0<r<1.5R0的条件,表示栀子黄与两种淀粉消化酶之间可以发生相互作用且极可能发生能量转移[27-29]。

图8 栀子黄与α-淀粉酶和α-葡萄糖苷酶重叠光谱图Fig.8 Overlapping spectra of gardenia yellow with α-amylase and α-glucosidase

表6 栀子黄与α-淀粉酶和α-葡萄糖苷酶的结合距离Table 6 Binding distance between gardenia yellow and α-amylase and α-glucosidase
3 结论
栀子黄通过竞争性抑制的方式能显著抑制α-淀粉酶、α-葡萄糖苷酶的活性。相比于α-淀粉酶,栀子黄对α-葡萄糖苷酶的亲和力可能更高。栀子黄通过自发的范德华力、疏水作用力分别对α-淀粉酶和α-葡萄糖苷酶发生相互作用。栀子黄能够引起两种酶氨基酸残基的构象改变,主要作用两种酶的酪氨酸残基和色氨酸残基。非辐射能量转移在栀子黄与两种消化酶之间发生概率很大,进一步印证了栀子黄与两种消化酶相互作用的可能性。该研究表明栀子黄可能对糖尿病患者症状改善具有积极的作用,这为筛选淀粉消化酶抑制剂及相关功能食品的开发奠定了理论基础。

