高原早熟禾根际促生菌分离筛选及特性研究
赵树栋, 李建宏
(甘肃农业大学草业学院, 草业生态系统教育部重点实验室, 甘肃 兰州 730070)
甘南草原是指我国青藏高原东北部甘肃省甘南藏族自治州境内的天然草地,具有很强的草地畜牧业生产优势,被誉为“亚洲第一牧场”,也是黄河首曲最大的生态湿地,是我国西部地区重要的生态屏障和水源涵养地。但是近年来,受气候变化和人类活动的双重影响,甘南草原退化明显,有数据显示,甘南草原退化面积已达到总面积的56.6%左右[1],草原保护与治理刻不容缓。前人研究发现,甘南草原退化主要体现在草地植被的退化和草地土壤质量下降2个方面[2]。近些年学术界以及草原管理部门尝试了多种不同的草地治理措施,如轮牧、封育、施肥、划破草皮、人工补播等[6],这些措施在一定范围内取得了积极的效果,为退化草地治理工作积累了宝贵的经验[7]。对于退化较为严重的草地,目前使用较多的治理措施是人工补播和施肥,但是,补播植物的种子发芽率、成活率以及生长状况受外界因素影响很大,且草地施肥成本高、对生态系统扰动大[7-8],因此,提高补播植物的发芽及生长能力,绿色、高效的提高草地土壤肥力,是目前退化草地治理的重要工作。植物根际促生菌技术的出现为解决这一问题提供了新的思路。
研究表明,在植物的根际定殖着一大类对植物生长有益的细菌,被称为植物根际促生菌(Plant growth promoting rhizobacteria,PGPR),这类细菌生活在植物根际系统中(定殖于根系表面或生活在根际土壤中),具有固氮、溶磷、解钾、拮抗病原菌或产生植物激素等功能[9]。PGPR是宝贵的功能微生物资源,也是微生物肥料和微生物农药的重要原料,对于农业技术的提高和农业可持续发展具有重要的意义[10-14]。研究表明,植物根际促生菌不仅可以促进植物的生长,更能改良土壤质量、提高土壤肥力。对于解决退化草地补播植物的生长问题和草地土壤肥力问题具有积极意义,已有学者进行了此方面的尝试并取得了富有价值的成果,如何敏[15]从藏北高原土著植物根际分离筛选了促生菌,并以其为材料,研究促生菌对植物及其土壤的影响,结果发现,促生菌可以提高植物对不良环境胁迫的耐受能力,促进植物生长,并能改良土壤微生物群落结构,提高土壤活性。马骢毓等[16]则从阿里地区高寒草地披碱草(ElymusnutansGriseb.)根际分离筛选了促生菌,并尝试将其制成菌剂,结果表明该菌剂不仅能促进披碱草的生长,更能提高披碱草的饲用价值。因此,利用植物根际促生菌进行退化草地修复具有很强的可行性。
高原早熟禾(PoapratensisL.)是重要的饲草作物,是甘南草原高寒草地优势牧草之一[17],具有重要生态及经济价值,也是甘南地区退化草地人工补播的常用草种之一,但作为禾本科植物,其对氮、磷元素需求量较大,而退化草地氮、磷素较为缺乏,成为了早熟禾生长的限制因素。因此,提高土壤中有效氮、磷元素的含量就是一项十分重要的工作,植物根际促生菌在此方面有巨大的应用潜力。但目前,对于早熟禾根际促生菌的研究尚较为欠缺。鉴于此,为了探索和发掘新的生物资源,为退化草地的治理作出积极探索。本研究从甘南草原高寒草地高原早熟禾根际分离筛选促生菌,并对其特性进行研究和评价,以期为进一步开发利用打下基础。
1 材料与方法
1.1 研究区概况
采样区位于甘肃省甘南藏族自治州碌曲县,位于甘肃西南部(101°35′36″~102°58′15″E,33°58′21″~34°48′48″N),甘肃、青海、四川三省交界处,青藏高原东部边缘,地形以山地和盆地为主,地势西高东低,平均海拔3 500 m,其气候呈现春秋短促、长冬无夏、阴湿高寒的特点,属青藏高原气候带高原湿润气候区,年降水量633~782 mm,平均气温 2.3℃,无绝对无霜期,年总日照时数2 357.8 h,太阳总辐射量 51 983.9 J·cm-2[18]。草场面积较大,达39.4万hm2,占全县土地总面积的83.3%,高原早熟禾是其优势牧草之一。
1.2 样品采集与处理
于2020年7月在研究区围栏内休牧草地采集生长旺盛、无病虫害的高原早熟禾根际样品(包括植物根系和土壤),将取得的样品装入无菌聚乙烯袋中,低温运输至实验室立即进行菌株分离。
分离时为了方便研究细菌在植物根际的分布,将根际分为根际土壤(Soil adhering to roots,RS)、根系表面(Rhizoplan or surface of roots,RP)与根内(Histoplan or interior of roots,HP)3个区域[19-20]。
1.3 高原早熟禾根际促生菌的分离与纯化
1.3.1联合固氮菌的分离与纯化 在无氮培养基(Nitrogen free medium,NFM)[19-20]表面运用涂布平板法分离纯化联合固氮菌。分别取已制备的3个区域的10-3,10-4,10-5稀释液50 μL接种于NFM固体培养基上。每个区域的每个梯度稀释液各重复 3次,用无菌涂布器均匀涂抹到培养基表面,28℃的培养箱中培养3 d后计数,计算固氮菌的数量[19-20]。
NFM培养基配方为:苹果酸 5.0 g,KOH 4.5 g,K2HPO40.5 g,CaCl2·2H2O 0.02 g,NaCl 0.1 g,NaMoO4·2H2O 0.002 g,MgSO4·7H2O 0.2 g,生物素 10 μg,0.5%溴麝香草酚蓝5 mL,琼脂 2%,总体积 1 000 mL,pH值 7.0。
1.3.2溶磷菌的分离与纯化 溶解无机磷菌株运用平板涂布法在无机磷培养基(Pikovaskaia's,PKO)[9]表面分离纯化。溶解有机磷菌株运用平板涂布法在蒙金娜有机磷培养基[21]表面分离纯化。用移液器分别取已制备的3个区域的10-3,10-4,10-5稀释液50 μL接种于灭菌的选择性PKO无机磷与蒙金娜有机磷固体培养基上。每个区域的每个梯度稀释液在培养基上各重复3次,用无菌涂布器均匀涂抹到培养基表面,28℃的培养箱中培养5 d后,观察并计数菌落周围能形成溶磷透明圈的单个菌落。分别测量并记录溶磷圈直径(D)、菌落直径(d),并计算溶磷圈直径和菌落直径的比值(D/d),记录溶磷菌的数量[21]。
PKO无机磷培养基配方:Ca3(PO4)25.0 g,葡萄糖 10.0 g,NaCl 0.2 g,(NH4)2SO40.5 g,MgSO4·7H2O 0.1 g,KCl 0.2 g,MnSO4·H2O 0.002 g,琼脂18.0 g,酵母膏 0.5 g,FeSO4·7H2O 0.002 g,总体积 1 000 mL,pH值7.0±0.2。
蒙金娜有机磷培养基配方:葡萄糖 10.0 g,(NH4)2SO40.5 g,NaCl 0.3 g,KCl 0.3 g,FeSO4·7H2O 0.03 g,MnSO4·4H2O 0.03 g,蛋黄卵磷脂 0.2 g,CaCO35.0 g,酵母膏 0.4 g,琼脂18.0 g,总体积 1 000 mL,pH值7.0~7.5。
1.4 菌株特性研究
以分离筛选的菌株为材料,根据初筛结果,从中挑选特性较好的菌株(溶磷培养基上D/d的值大于1.5或在固氮培养基上菌落明显,生长较快的菌株)进行进一步的特性研究。
菌株固氮能力的测定采用乙炔还原法(Acetylene reduction assay,ARA),以固氮酶活性表示;溶磷能力的测定采用钼蓝比色法(Molybdenum blues colorimetry,MBC);菌株分泌植物激素IAA能力测定采用高效液相色谱法(High performance liquid chromatography,HPLC);菌株抑制植物病原菌能力的测定采用平板对峙法,根据抑菌圈的直径计算抑制率[19-21]。
1.5 种子发芽率、发芽指数、幼苗活力指标的测定
挑选饱满、无破损的高原早熟禾种子(由甘肃农业大学草业学院提供),0.5% H2O2消毒10 min,无菌水冲洗5次,处理组分别用不同待测菌株的菌悬液(培养24 h后离心获得,悬浮于无菌生理盐水,108CFU·mL-1)浸种1 h,用无菌生理盐水做对照,每个处理设4次重复,每个培养皿中摆放50粒种子,25℃恒温培养,光照12 h,湿度80%,每日补充蒸发损失的水分,统计种子的发芽数,直至发芽结束,高原早熟禾发芽周期参照《国家草种子检验规程》[22]。发芽结束后统计正常种苗数,并测定高原早熟禾幼苗的根长、芽长、根鲜重和芽鲜重。
参考Williamson等[23]和李钰莹等[24]的方法,分别计算不同处理下高原早熟禾的发芽率、发芽指数、幼苗活力指数等指标,计算公式为:
发芽率(Germination percentage,GP):GP(%)=(Gn/N)×100%。
式中,Gn为截止发芽周期最后一天正常发芽的种子总数,N为供试的种子总数。
发芽指数(Germination index,GI):GI= ∑(Gt/Dt)
式中,Gt为第t天种子的发芽数,Dt代表相应的发芽天数。
幼苗活力指数(Seeding vigor index,SVI):SVI=GI×S。式中,S为发芽周期结束时的芽长。
1.6 高原早熟禾生长指标的测定
栽培用土的准备:将准备好的混有蛭石的土壤过3 mm的土壤筛,辐照灭菌(委托兰州绿源辐照有限责任公司完成),装入已消毒的花盆(直径18 cm,深19 cm)备用。
种子的催芽及栽培:种子消毒(同1.5)后催芽处理,发芽后挑选长势一致的幼苗进行栽培。每盆栽培15株,栽培7 d后间苗,留下长势一致的幼苗,每盆留苗10株。
菌液处理:将活化后的待测菌株接种于LB培养液,180 r·min-1,28℃培养,血球计数板检验菌体浓度,待菌体浓度达到108CFU·mL-1时终止培养,用移液枪吸取培养液,滴加到幼苗根部,每苗加2 mL,灭菌的LB培养液作对照,每处理4次重复。置于室温、自然光下培养,定期浇水。
指标测定:第30 d测定高原早熟禾的株高、根长、地上生物量、地下生物量等指标。
1.7 菌株分类
菌株表型特征观察:活化菌株,进行菌落形态观察、芽孢染色、革兰氏染色。
16S rRNA基因分析:用试剂盒(OMEGA)提取菌株总DNA,琼脂糖凝胶电泳法分析DNA的纯度,紫外分光光度法测定DNA纯度。引物选用16S rRNA基因扩增通用引物27F-1492R[25],序列分别为:27F:5-AGAGTTTGATCCTGGCTCAG-3,1492R:5-GGTTACCTTGTTACGACTT-3,均由上海派森诺生物科技股份有限公司合成。PCR扩增反应体系和扩增反应程序参照李建宏[25]的方法。扩增产物检测合格后直接送交测序,测序工作委托上海派森诺生物科技股份有限公司完成。获得序列后登陆NCBI数据库,进行BLAST比对。使用CLUSTALX 1.83 软件和MEGA 5.1.2软件构建菌株系统进化树。
1.8 数据分析
采用Excel 2016进行数据整理,SPSS 19.0软件对试验数据进行One-Way ANOVA分析和Duncan新复极差法进行差异显著性检验(P<0.05)。
2 结果与分析
2.1 PGPR在高原早熟禾根际的分布
由表1可知,从高原早熟禾根际共分离出32株PGPR,其中固氮菌最多,有15株,溶无机磷菌次之,为11株。PGPR在高原早熟禾根际不同部位的分布也不同。无论是固氮菌,还是溶磷菌,在根际的分布都是根系表面>根际土壤>根内,呈典型的“根际效应”。

表1 PGPR在高原早熟禾根际的分布
2.2 PGPR菌株的促生特性
由表2可知,根据初筛结果,从高原早熟禾根际分离出的32株菌株中挑选出Pa-2,Pa-4,Pa-7,Pa-21和Pa-29等5株特性优良的菌株,进行进一步研究。
由表2可知,具有溶无机磷能力的菌株有4株,其D/d值在1.63~2.19之间,Pa-4最高,为2.19,显著高于其他3株(P<0.05);菌株在无机磷培养基中的pH值与D/d值趋势相反,Pa-4最低,为3.61,差异显著(P<0.05),Pa-29最高,达5.42;定量测定结果显示,溶无机磷能力最强的菌株为Pa-4,其溶无机磷的能力达到274.30 μg·mL-1,显著高于Pa-2,Pa-21和Pa-29(P<0.05),与D/d的变化趋势基本一致。具有溶解有机磷能力的菌株有3株,在有机磷培养基上,D/d值最高的是Pa-4,为1.69;pH值最低是Pa-4,为4.22,最高的为Pa-2,为5.29;定量测定的结果与pH值及D/d值的趋势不同,溶解有机磷能力最强的菌株为Pa-2,达128.39 μg·mL-1,其次是Pa-4,为52.98 μg·mL-1。
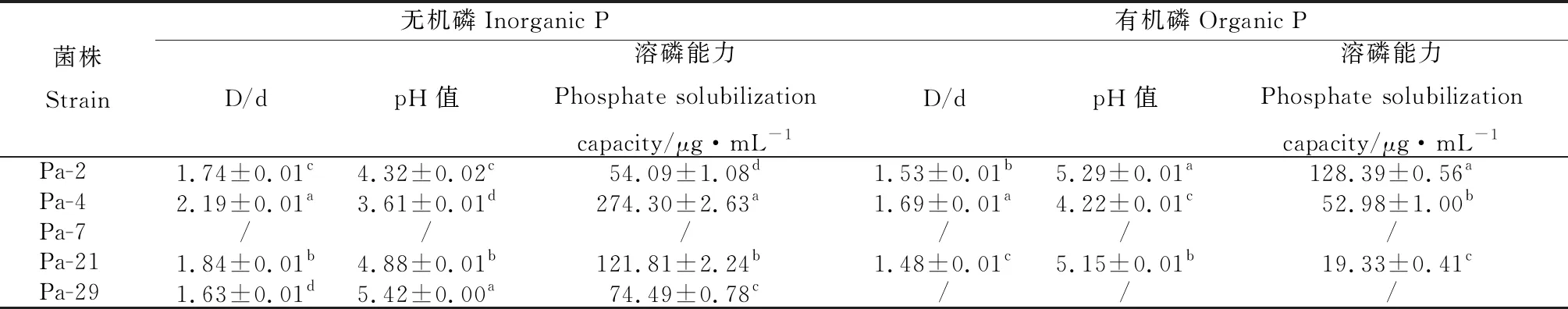
表2 优良PGPR菌株溶磷能力
由表3可知,不同菌株的固氮酶活性不同,菌株间差异显著(P<0.05),在5株待测菌株中,具有固氮酶活性的菌株有4株,固氮酶活性强的为Pa-7,固氮酶活性达652.65 nmol(C2H4)·h-1·mL-1,其次为Pa-29为320.90 nmol(C2H4)·h-1·mL-1,Pa-2次之,Pa-4相对较弱。而5株待测菌株均检测出了分泌IAA的能力,但不同菌株的分泌能力不同,处在9.62~76.16 μg·mL-1之间,分泌IAA能力最强的菌株为Pa-7,其IAA的值为76.16 μg·mL-1,显著高于其他4株(P<0.05)。

表3 优良PGPR菌株固氮酶活性及分泌IAA能力
2.3 PGPR菌株对病原菌的抑制率
由表4可知,本研究的5株待测菌株对3种常见病原菌均具有一定的拮抗能力,但不同菌株的拮抗能力不同,同一菌株对不同病原菌的拮抗能力也不同。抑菌能力最强的菌株为Pa-21,其对燕麦镰刀菌(F.avenaceum)、立枯丝核菌(R.solani)、麦根腐平脐蠕孢(B.sorokiniana)的抑制率均高于其他待测菌株,分别达92.11%,82.47%和85.20%。其他待测菌也具有不同程度的抑菌能力。

表4 优良PGPR菌株对病原菌的抑制率
2.4 PGPR菌株对高原早熟禾种子萌发的影响
由表5可知,和CK相比,促生菌可以较为显著的提高高原早熟禾种子的萌发率(P<0.05),促生菌浸种后,高原早熟禾种子的发芽率提高了1.65%~4.40%,其中Pa-4菌株浸种后发芽率提高最为明显,提高了4.40%;促生菌株处理后发芽指数提高了21.56%~78.11%,Pa-4菌株浸种后发芽指数提高幅度高达78.11%;促生菌浸种后,高原早熟禾幼苗的活力指数同样有较为显著的提升(P<0.05),提高了7.33%~23.06%。

表5 优良PGPR菌株对高原早熟禾种子萌发的影响
2.5 PGPR菌株对高原早熟禾生长的影响
由表6可知,和CK相比,用促生菌处理后,高原早熟禾的株高、根长、地上生物量、地下生物量等指标均有显著提升(P<0.05);促生菌处理后,早熟禾的株高提升7.18%~25.97%;根长增加8.2%~27.87%;地上生物量增加24.2%~57.58%;地下生物量增加36.36%~54.55%,各指标均以Pa-4菌株促进效果最好。
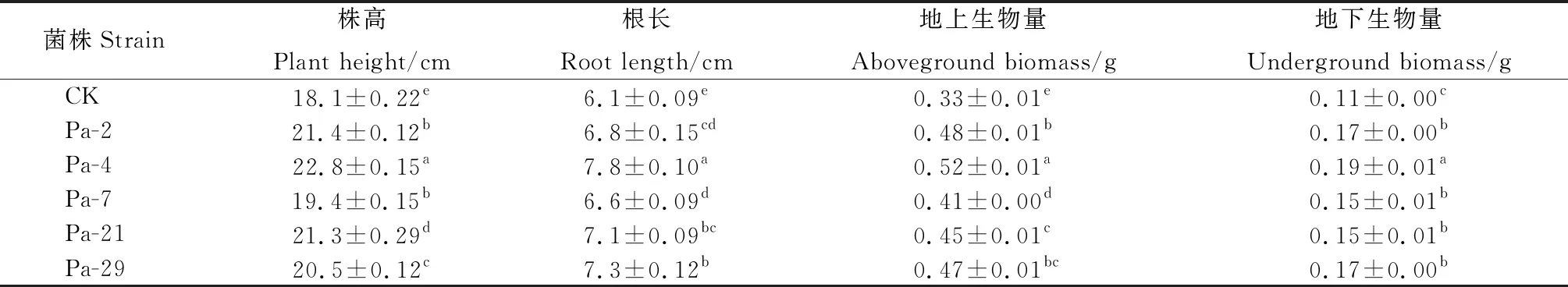
表6 优良PGPR菌株对高原早熟禾生长的影响
2.6 PGPR菌株分类地位的确定
结合菌株形态鉴定结果与16S rDNA序列分析结果(表7),对5株待测菌株的分类地位进行确定,结果发现,Pa-2和Pa-7为枯草芽孢杆菌(Bacillussubtilis),Pa-4为蕈状芽孢杆菌(Bacillusmycoides);Pa-21和Pa-29分别为不动杆菌(Acinetobactersp.)与荧光假单胞菌(Pseudomonasfluorescens)。图1为5株菌的系统进化分析,根据参比菌株的遗传进化距离对比可以发现,本研究的鉴定结果准确。将测得的序列提交GenBank数据库,获得了GenBank登录号,分别为MW805692-MW805696。

表7 菌株鉴定结果
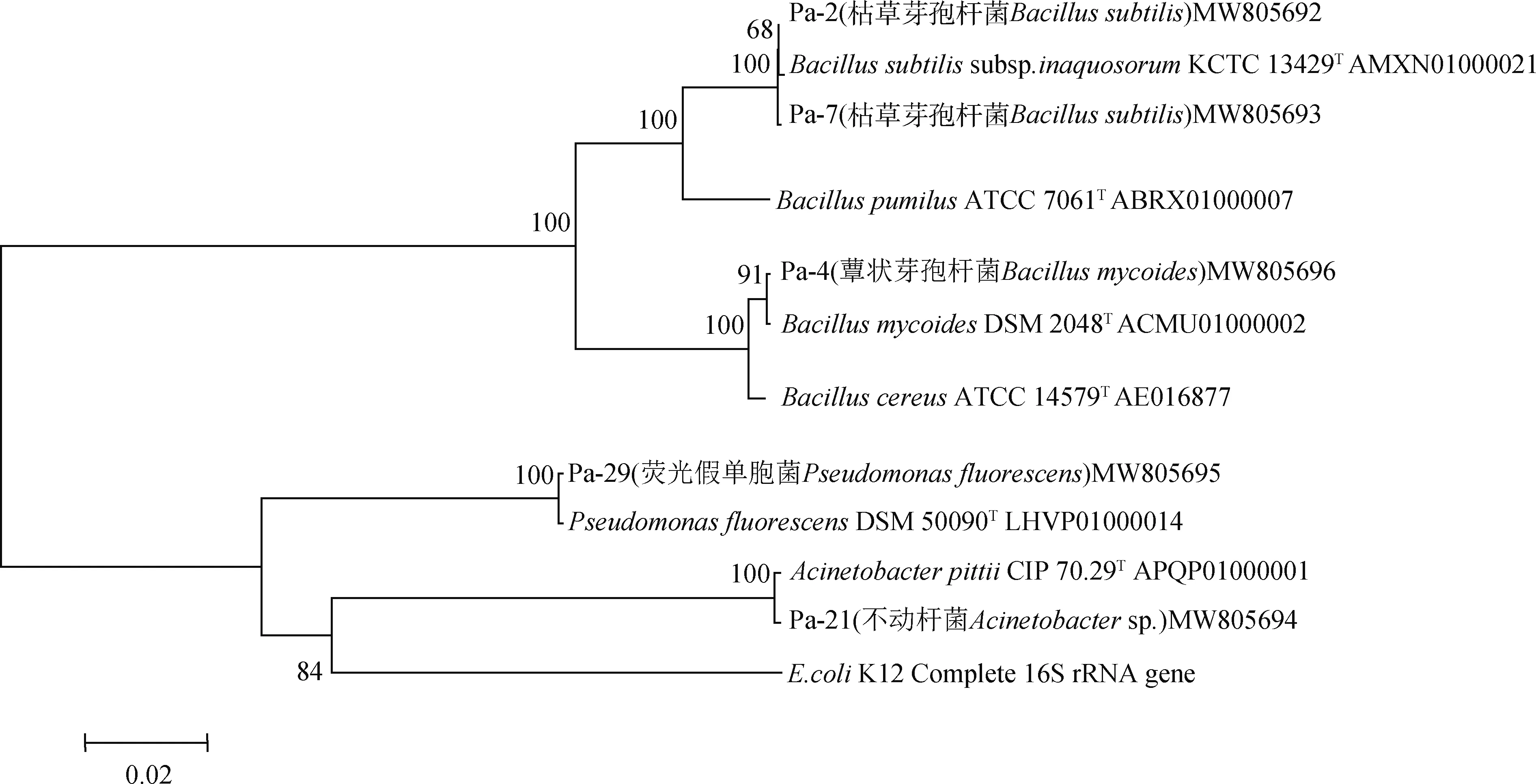
图1 基于16S rRNA基因采用N-J邻接方法建立本研究菌株与其它近似菌株的系统进化树
3 讨论
草地的退化主要体现在2个层面,一是草地植被的退化,如草地植被高度、盖度、物种多样性、草产量等的下降,以及优质牧草比例的下降、毒杂草比例的提高等等;二是草地土壤的下降,包括土壤盐碱化、肥力下降、物理性质劣化以及土壤微生物多样性的降低[3-5]。李建宏等[26]在东祁连山高寒草地的研究还表明,草地退化过程中还伴随着固氮微生物丰度的下降[26],另有学者指出,草地退化减少了草地土壤氮库[27]。而固氮微生物和土壤氮库的降低,直接导致了草地土壤肥力的下降,土壤肥力的下降又使得牧草营养缺乏,植被进一步退化,因此,在本质上,草地退化是植被—土壤系统的协同退化[7]。由此,退化草地的修复也应该是从植被—土壤系统耦合的思路来进行修复。纵观近些年国内大多数草原管理者的修复方案,无论是人工补播还是草地施肥,都是从单一层面进行修复,虽然也在一定程度上取得了积极的效果,但是其局限性也很明显,一是补播的牧草成活率低、生长状况差;二是草地土壤养分循环能力未得到根本性的提高,仅靠外源的补给很难使其进入良性循环[6-8]。本研究显示,植物根际促生菌不仅具有溶磷、固氮、分泌植物激素等功效,提高土壤肥力,还可以有效提高牧草种子的发芽率和幼苗活力,促进牧草的生长,正好解决了退化草地修复难题,具有良好的应用前景。除此之外,越来越多的学者们认识到传统的修复措施对原有生态系统有一定的扰动和破坏,其负面影响不可忽视,因此提出了“近自然修复”的理念[28-31]。该理念强调在草地修复的同时,要尊重原有的生态系统。而植物根际促生菌是“源于自然,用于自然”的,因此,也是退化草地“近自然修复措施”必不可少的措施。
本研究还发现植物根际促生菌可以促进牧草种子的发芽,提高发芽率、发芽指数以及幼苗活力指数,朱诗苗[32]的研究发现,使用促生菌后,烟草(NicotianatabacumL.)种子发芽势、发芽率、发芽指数和活力指数分别增加了 30.61%,8.36%,31.13%,36.9%,苗长和根长分别增加了11.37%和57.11%,与本研究的结果相似。推测其原因,一是促生菌分泌的植物激素促进了种子的萌发[33];二是促生菌通过自身代谢作用,分解了抑制种子发芽的物质[34],促进了种子的发芽。而种子发芽之后,促生菌还可以促进幼苗对养分的吸收,双重作用导致了促生菌对种子萌发的促进作用。但是关于其机理,目前尚缺乏深入的研究。
4 结论
从高原早熟禾根际共分离出32株具有促生作用的菌株,促生菌在高原早熟禾根际的分布呈“根际效应”。挑选出的5株优良菌株有不同程度的溶磷、固氮及分泌植物的能力,均能提高高原早熟禾幼苗的发芽率、发芽指数、幼苗活力指数,并能促进高原早熟禾幼苗的生长;5株优良菌株中,有2株枯草芽孢杆菌,1株蕈状芽孢杆菌,1株不动杆菌以及1株荧光假单胞菌。本研究为进一步的深入研究和功能微生物资源开发奠定了基础。

