基于网络药理学分析补阳还五汤治疗动脉粥样硬化的作用机制
高 雅,周欣欣,马存根,2,张红珍
(1.山西中医药大学第四临床学院,山西中医药大学神经生物学研究中心,国家中医药管理局多发性硬化益气活血重点研究室,山西晋中030619;2.山西大同大学脑科学研究所,山西 大同037009)
动脉粥样硬化(Atherosclerosis,AS)是由于各种因素影响,脂质在大、中血管的内膜沉积、平滑肌细胞和纤维组织增生、钙质沉积,形成黄色的粥样斑块,继而造成血管腔不同程度的狭窄及血管壁的硬化[1]。AS是心脑血管疾病的病理基础,也是其恶性事件的首要原因。近年来,我国AS的发病率和死亡率上升,随着人们生活方式和饮食结构的变化,不断年轻化成为动脉粥样硬化的发病趋势[2]。对动脉粥样硬化发病机制的认识虽取得了一定的成果,如认识到内膜损伤可能是其主要的原因,但是因为该病病程时间长、病因相对复杂等特点,使得更深入的研究还相对不足。
补阳还五汤源自清代著名医家王清任的《医林改错》,研究表明,补阳还五汤能在蛋白水平调控血脂的浓度,从而改善AS症状。一系列的最新相关研究发现,补阳还五汤的功效不仅在蛋白水平,同时对AS发生发展过程中发挥重要作用的Rho激酶、PAI-1、及eNOS等特异性标志物都有一定的调控作用,进而对AS的治疗发挥效用[3]。有研究显示补阳还五汤及其组方成分可以调节机体脂代谢、降低巨噬细胞泡沫化、减少炎症和免疫反应、抑制血管平滑肌细胞增殖、减小和稳定AS斑块,具有多方面的有效作用[4]。
中药网络药理学是在系统生物学基础上,通过对相关网络数据库进行检索,在计算机大运算支持下对中药成分进行高通量组学分子生物网络分析的新学科,主要用于中药活性成分、靶点、通路及疾病之间关系的相关分析,在整体水平上阐明中药药效的物质基础和作用机制。本研究在此基础上,应用网络药理学筛选补阳还五汤作用于AS的主要活性成分、作用靶点、作用通路,为深入探讨补阳还五汤治疗AS的作用机制提供研究思路。
1 材料与方法
1.1 筛选补阳还五汤活性成分及靶点
通过中药系统药理学数据库和分析平台(Traditional Chinese Medicine Systems Pharmacology Databaseand Analysis Platform,TCMSP,http://ibts.hkbu.edu.hk/LSP/tcmsp.php)检索补阳还五汤所含化学成分,并以口服利用度(oral bioavailabitity,OB)≥30%,类药性(drug likeness,DL)≥0.18为筛选标准,确定符合条件的活性成分。利用TCMSP提供的信息筛选出相关靶点,并将收集的数据进行化合物作用靶点的进一步筛选。通过Uniprot(https://www.uniprot.org/)数据库中将已筛选出的靶蛋白名转换为靶点简称,进行标准化。
1.2 获取AS靶点以及共同靶点
以“Atherosclerosis”“AS”为关键词,在Gene Cards(https://www.genecards.org/)数据库检索与AS相关的基因。通过R语言中VennDiagram程序包,获取补阳还五汤与AS的共同靶点。
1.3 构建蛋白互作网络
在STRING(http://string-db.org)数据平台输入共同靶点,蛋白种属设置为“Homosapiens”,最低相互作用阈值设为中等“mediumconfidence”(>0.4),分析后得到蛋白-蛋白相互作用(protein-protein interaction,PPI)网络,结果导入Cytoscape 3.7.1可视化,并进行网络拓扑分析。
1.4 KEGG富集
应用DAVID对益气活血与AS的共同靶点进行基因本体(gene ontology,GO)功能注释和京都基因与基因组百科全书(kyoto enoyclopadia of gene and genomes,KEGG)通路富集分析,保留P<0.05的结果,然后进行可视化处理。
2 结果
2.1 筛选出补阳还五汤活性成分及靶点
通过TCMSP数据库筛选出补阳还五汤共有86个化合物和143个作用靶点,表明补阳还五汤中的一些化合物可作用于多个靶点,而且不同化合物也可以同时作用于同一靶点,这反映了中药中多个组分与多个靶标之间的相互作用。
2.2 补阳还五汤与AS共同靶点
从GeneCards数据库检索获得4346个疾病相关靶点,补阳还五汤与AS靶点取交集,获得97个共同的靶标(图1),表明补阳还五汤通过多个潜在靶标在治疗AS中起着协同作用。

图1 疾病与药物靶点
2.3 蛋白互作网络分析
通过STRING数据库对97个共同靶点分析后,得到PPI网络(图2)。首先以DC值进行筛选获得网络中的重要节点即“Bighubs”,最终筛选出关键靶点(表1),主要涉及炎症与免疫、内皮细胞功能等。

图2 补阳还五汤治疗AS的关键靶点筛选
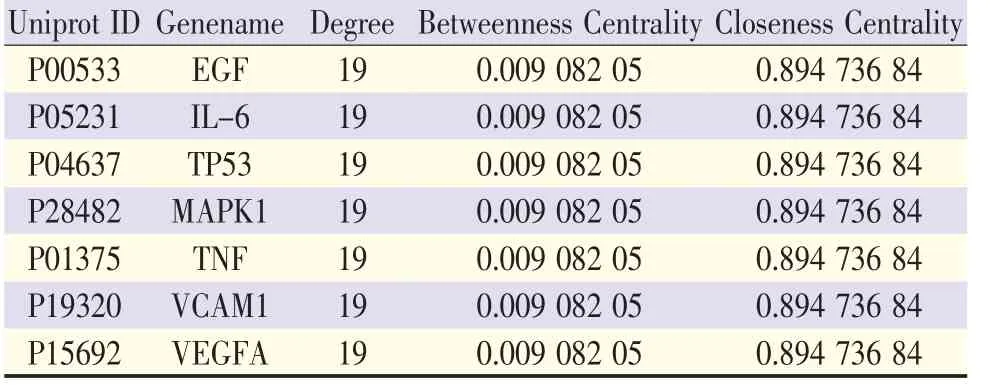
表1 补阳还五汤治疗AS的关键靶点
2.4 KEGG通路富集分析
97个共同靶点KEGG通路富集分析,将前20条信号通路进行可视化分析(图3)。其中包括自噬相关PI3K-Akt信号通路,与炎症和免疫相关的包括白介素-17(interleu kin 17,IL-17)信号通路、T细胞受体信号通路、肿瘤坏死因子(tumor necrosis factor,TNF)信号通路、TH17细胞分化、乏氧诱导因子(hypoxia inducible factor,HIF-1)信号通路等;这表明补阳还五汤可能具有通过抗炎、提高免疫、激活自噬等作用以缓解AS进程。通过剔除疾病、广义通路后,获得与补阳还五汤治疗AS相关度最高的通路(表2)。

图3 KEGG通路富集分析

表2 基于京都基因和基因组途径分析百科全书的潜在靶点功能分析
3 讨论
本研究发现补阳还五汤中有86个化合物,143个作用靶点,说明成分具有多靶点的作用特点。例如,槲皮素、山奈酚、β-谷甾醇分别作用于87、55和51个靶点,说明他们可能是补阳还五汤中的主要活性化合物。槲皮素和山萘酚为黄酮类化合物,是一类具有可变酚结构的天然物质,具有抗氧化、抗炎等特性。槲皮素干预可有效改善脂代谢紊乱,减轻AS病理改变,改善动脉壁结构,同时可显著抑制动脉粥样硬化时VSMCs及成纤维细胞的增殖以及由二者的增殖导致的动脉壁胶原成分增加,延缓AS的进展[5]。当PI3K/Akt/NF-κB通路被激活时,促进主动脉壁成纤维细胞、平滑肌细胞增殖及胶原等成分的合成与分泌,加速了AS进程;而槲皮素治疗AS除影响脂代谢途径外,也可能干预此通路中关键蛋白的活性、抑制NF-κB转移,抑制主动脉壁成纤维细胞、平滑肌细胞增殖及胶原等成分的合成与分泌,从而延缓动脉粥样硬化进程。有实验指出槲皮素具有抗AS作用,不同的药物剂量、时间均对结果产生不同的影响。槲皮素抗AS的分子作用机制可能是源自于对高迁移率蛋白1(high mobility group box 1 protein,HMGB1)、Toll样受体(toll-like repector 4,TLR4)蛋白和基因表达的下调[6]。山奈酚通过在降脂、抗氧化及抑制血管炎症等方面发挥作用,起到有效防治高脂诱导家兔AS,显著改善其相关血管病变的功效。通过调节E-选择素、细胞间黏附分子1(intercellular adhesion molecale-1,ICAM-1)和血管细胞黏附分子(vascular cell adhesion molecule,VCAM-1)等黏附分子的基因与蛋白的表达从而影响血管的炎症反应[7]。实验表明,摄入β-谷甾醇的甾醇型有机凝胶剂的大鼠血清中总胆固醇、甘油三酯、低密度脂蛋白等的含量均呈现降低趋势,证实了其具有良好的抗AS作用;且实验表明β-谷甾醇能通过降低高血脂大鼠血清总胆固醇和甘油三酯水平,从而调节脂质代谢,以达到预防AS的效果[8]。
研究发现,在AS发生发展进程中,单一因素并不能解释其复杂的发病机理,诸多因素相互作用可能是导致AS发生的重要原因。根据KEGG富集分析发现,补阳还五汤在治疗AS过程中,主要与PI3K-Akt信号通路、IL-17信号通路、T-cell受体信号通路、TNF信号通路、Th17细胞分化、HIF-1信号通路等相关。
补阳还五汤含药血清可以抑制由脂多糖(lipoplysacch aride,LPS)刺激而激活的PI3K、p-AKT蛋白表达,进一步抑制下游炎症因子,从而对AS有治疗和降低炎症的作用[9]。实验证实抑制PI3K/AKT信号能调节小鼠血压、脂肪蓄积及体内脂质代谢。T细胞在炎症中的作用主要是通过对动脉斑块抗原适应性的免疫应答反应,由此产生大量IL-1、IL-2、IL-6及TNF-α等促炎细胞和相关因子会加速免疫炎症反应,最终促进AS的发生与发展[10]。研究发现在补阳还五汤治疗高脂饲料诱导SD大鼠AS模型中,补阳还五汤抗AS的作用机制主要是通过下调VCAM-1mRNA表达来延缓小鼠发生AS的进程;同时该研究通过对比补阳还五汤组与川芎嗪组的治疗效果发现,补阳还五汤在高剂量治疗和低剂量预防抗AS上有更好的疗效,原因可能是通过降低IL-6、IL-8及高敏C反应蛋白水平等来实现[11]。
Th17细胞主要分泌一种前炎性效应因子,即IL-17,IL-17可以通过激活核转录因子、MAPK等信号通路,促进内皮细胞分泌炎症因子、促进细胞凋亡,从而加速AS的转变[12]。另有研究表明,Th17/IL-17在动脉粥样硬化斑块局部高表达,且斑块大小及总胆固醇水平随着Th17细胞数量的增加而增长,证实Th17/IL-17不仅参与了动脉粥样硬化斑块的局部反应,还促进了斑块的形成[13]。因此,我们推测补阳还五汤可以通过调节IL-17信号通路促进AS的治愈。
HIF-1α是一种转录因子,在低氧条件下,集聚的HIF-1α能够激活VEGF和CEGFR的转录和表达,促使新生血管生成,形成不稳定斑块。同时AS产生过程中的致炎因子、巨噬细胞会促使HIF-1α因子在COX-2和核转录因子等经典途径表达,从而增加其活性,加速促进AS斑块新生[14-15]。补阳还五汤干预AS模型小鼠后HIF-1α蛋白表达水平明显降低,说明补阳还五汤可能参与调控HIF-1α抗AS[16]。
有研究发现,AS是一种血管慢性进展性炎症,TNF-α是其中一类参与其发病过程的炎性因子[17]。当人体体内的脂质代谢发生异常时,血管内皮细胞会由于炎症反应的增加而进行变性脱落[18],TNF-α的活性因此增加,从而通过促进血管内皮细胞与白细胞的黏附加剧病程的发展[19]。相关实验发现补阳还五汤干预后,TNF-α水平明显降低,动脉硬化斑块面积减小,血脂代谢紊乱改善,达到了抗AS的作用[20]。AS的形成涉及多种信号转导通路,大量实验研究证实中药能够通过影响各信号转导通路达到延缓AS的目的。基于以上,补阳还五汤可能通过免疫调节、抑制炎症、激活自噬来缓解AS的发生发展。
在本研究中,通过网络药理学方法确定了补阳还五汤治疗AS的97个潜在靶点,对潜在靶点的数据进行富集分析,结果显示补阳还五汤活性成分通过对HIF-1信号通路、PI3K-Akt信号通路及TNF信号通路等多个信号通路进行多靶点的调控,达到免疫调控、抗炎、抗氧化应激作用。干预AS的发生发展。本研究为进一步研究补阳还五汤治疗AS奠定了良好的理论基础,同时,本研究仅为中医科学研究提供了初步的假设,有待系统的实验研究进一步证实。

