RAD51表达与肝细胞癌增殖侵袭能力及预后的关系
帕成周 张贯启 邬善敏
原发性肝癌是我国第4位常见的恶性肿瘤,在肿瘤致死病因中位居第2位[1]。近年来肝癌在男性和女性中的发生率均有不同程度的增加,其5年生存率为18%[2]。肝细胞癌(hepatocellular carcinoma, HCC)是最常见的原发性肝癌类型,进展至晚期时预后极差,仅有5%~10%的早期患者具备手术切除的条件[3]。
DNA损伤通常是由多种内源性和外源性因素引起的,如紫外线、辐射、化学因素、活性氧、DNA复制错误等。当发生DNA单链或双链断裂时会引起基因组不稳定,基因组不稳定性被广泛认为是肿瘤的标志性特征之一,在肿瘤的发生、发展中起着重要作用[4]。为了对抗DNA损伤,机体启动损伤修复机制来修复和维持基因组的稳定性,DNA单链断裂时进行碱基异常修复(base-excision repair, BER),DNA双链断裂则可通过非同源末端链接(non-homologous end joining, NHEJ)和同源重组(homologous recombination, HR)方式进行修复[5, 6]。RAD51是HR修复DNA双链断裂的关键蛋白之一,在前列腺癌、乳腺癌、食管癌、胰腺癌、结肠癌中发挥致癌基因的作用[7~13]。然而,RAD51表达在肝细胞癌中的临床价值和生物学功能尚未完全阐明。本研究旨在探讨RAD51表达与HCC患者临床病理特征及预后的关系,探究其表达与肝癌SMMC-7721细胞增殖、迁移侵袭能力的关系。
材料与方法
1.数据获取及生存分析:2020年6月使用癌症基因组图谱(TCGA)数据库(https:∥portal.gdc.cancer.gov/)下载HCC患者临床资料和RNA-seq表达数据。该数据集包括374例HCC组织和50例癌旁组织。根据RAD51的中位表达将HCC患者分为高低表达两组,使用Kaplan-Meier Plotter网站(https:∥kmplot.com/analysis/)进行生存分析。
2.细胞系及主要实验材料:人正常肝细胞系L02和人肝癌细胞系SMMC-7721(中国科学院细胞库)、RPMI 1640培养基(美国HyClone公司)、10%胎牛血清(美国HyClone公司)、RAD51 siRNA(广州锐博生物科技有限公司)、RAD51抗体(武汉三鹰生物技术有限公司)、CCK-8检测试剂盒(大连美仑生物技术有限公司)。细胞放置于37℃ 5%CO2的培养箱,待细胞贴壁繁殖达培养瓶底部面积80%左右用胰酶细胞消化液进行消化传代。
3.实时荧光定量PCR(quantitative real-time PCR, qPCR):将细胞硏磨裂解后加入1ml Trizol Reagent抽提总RNA,使用反转录试剂盒合成cDNA,按FastStart Universal SYBR Green Master(Rox) 试剂盒说明书配制反应体系并进行定量PCR反应,采用2-ΔΔCT法计算RAD51 mRNA相对表达量。内参基因 GAPDH及RAD51引物序列详见表1。

表1 引物序列
4.细胞转染及筛选:细胞转染采用小干扰RNA技术构建RAD51敲低质粒,设计3条si-RAD51干扰序列,设置SMMC-7721正常对照组(Control组)、空载组(si-NC组)、转染组(si-RAD51-1、si-RAD51-2、si-RAD51-3组)共5组。将SMMC-7721细胞接种在6孔板上,采用lipofectamin 2000方法在无血清培养基中进行细胞转染,温育6h后更换新鲜含血清培养基,温育48h后收集细胞用于qPCR和 Western blot法筛选出干扰效果最佳的转染组细胞系。以Control组、si-NC组、干扰最佳si-RAD51组进行生物学功能实验。
5.CCK-8增殖实验:根据CCK-8检测试剂盒说明书进行实验,测定48h各组SMMC-7721细胞存活率。
6.Transwell迁移及侵袭实验:迁移实验将处理后的各组细胞加入200μl的无血清培养基分别配制成含有2×104个的细胞悬液, 接种于Transwell小室上室;侵袭实验将各组细胞配制成含有2.5×104个的细胞悬液,接种于BD matrigel和RPMI-1640以1∶3的比例制备而成的侵袭小室上室。下室加入500μl 含10% FBS的完全培养基,在37℃ 5%CO2的培养箱中培养24h后取出,PBS洗去培养基,结晶紫染色10min,擦除干净,显微镜下随机选取3个视野拍照。
7.基因集富集分析:基因集富集分析使用GSEA软件(v.4.0.3,https:∥www.gsea-msigdb.org/gsea/index.jsp)进行,以“c2.cp.kegg.v7.1.symbols.gmt”, “c5.all.v7.1.symbols.gmt” 作为参考数据集,随机运行次数设置为1000,以P<0.01、FDR<0.05作为过滤条件,进行GO功能注释和KEGG通路分析。
8.统计学方法:采用GraphPad Prism 8统计学软件对数据进行统计分析,两独立样本的差异采用t检验,多组间比较采用方差分析,以P<0.05为差异有统计学意义。
结 果
1.RAD51 mRNA表达结果:利用TCGA分析发现,RAD51 mRNA在HCC组织中的表达水平明显高于邻近正常肝组织(t=6.35,P<0.01, 图1A)。通过qPCR分析RAD51 mRNA在L02和SMMC-7721中的表达情况,结果显示RAD51 mRNA在肝癌细胞系中表达显著高于正常肝细胞系(t=6.96,P<0.01, 图1B)。
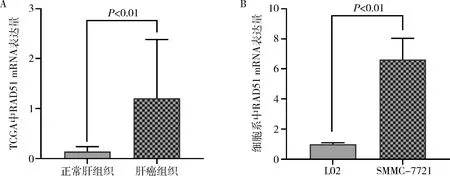
图1 RAD51 mRNA在肝细胞癌组织和细胞中的表达情况A.TCGA数据库中组织水平表达情况;B.细胞系水平表达情况
2.RAD51 mRNA表达与HCC患者临床特征:RAD51 mRNA表达水平在年龄(<60岁 vs ≥60岁,P<0.01,图2A)、病理分级(G1和2 vs G3和4,P<0.01,图2C)、临床分期(stageⅠ vs stage Ⅱ和stageⅠ vs stage Ⅲ和Ⅳ,P<0.01,图2D)、T分期(T1vs T2、T1vs T3、T1vs T4,P<0.05,图2E)差异有统计学意义。
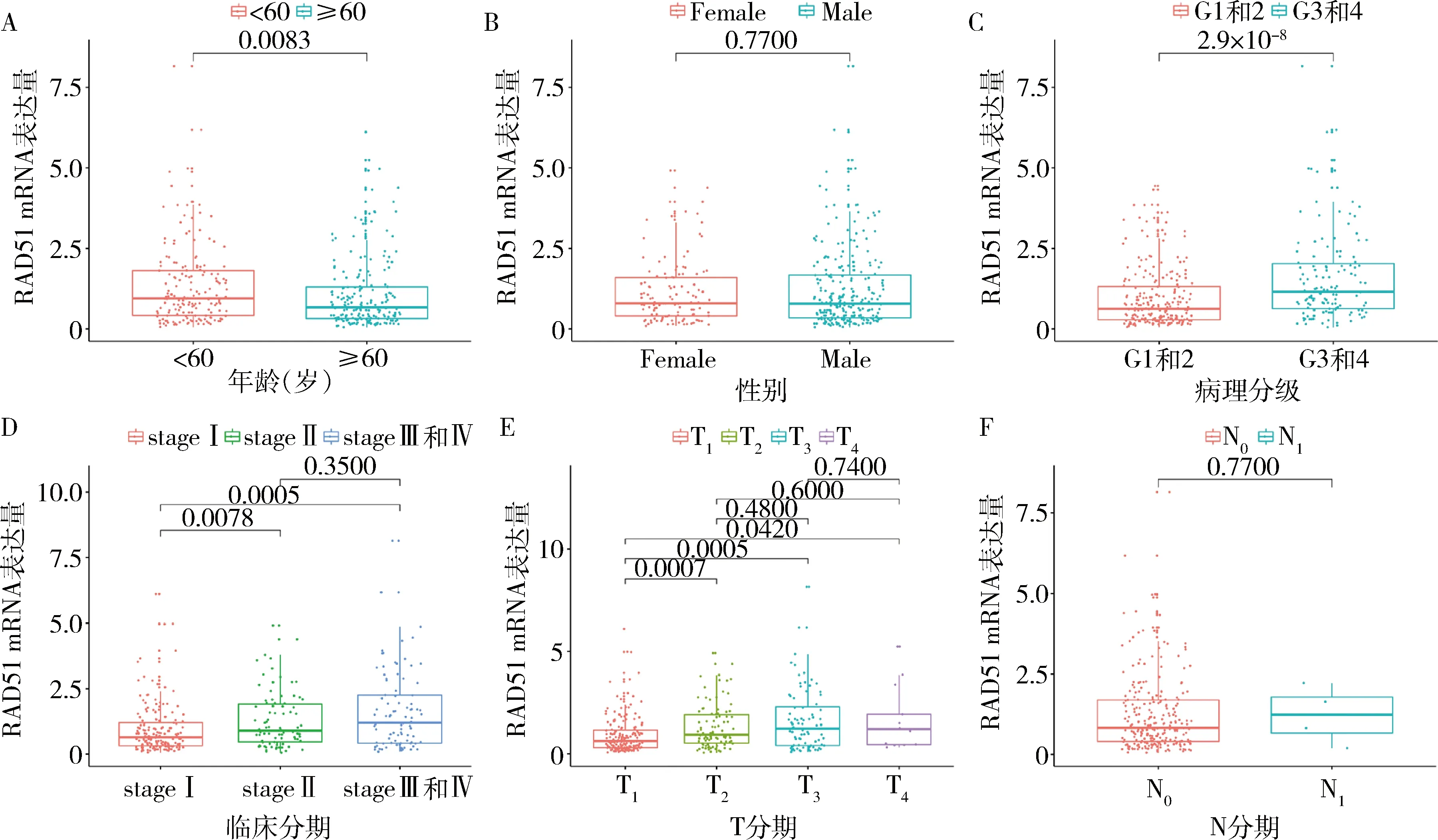
图2 RAD51 mRNA表达与HCC患者临床特征的关系A.年龄;B.性别;C.病理分级;D.临床分期;E.T分期;F.N分期
3.RAD51 mRNA表达与预后:利用Kaplan-Meier Plotter网站根据RAD51表达中位值将HCC患者分为高低表达两组进行生存分析,RAD51低表达的HCC患者总生存期(overall survival, OS)优于高表达的HCC患者(HR=1.62, 95% CI:1.14~2.30,P<0.01,图3)。其中,RAD51低表达组患者的中位生存时间为70.5个月;高表达组的中位生存时间为45.7个月。此外,通过单因素和多因素COX分析验证了RAD51表达是否为HCC患者OS的独立预后因素。单因素COX分析显示,RAD51表达、临床分期、肿瘤直径、远处转移与HCC患者的OS密切相关(表2);在多因素COX分析中进一步提示RAD51表达是OS的独立预后指标(HR=1.31, 95% CI:1.10~1.55,P<0.01)。

图3 RAD51 mRNA表达与HCC患者预后的生存曲线
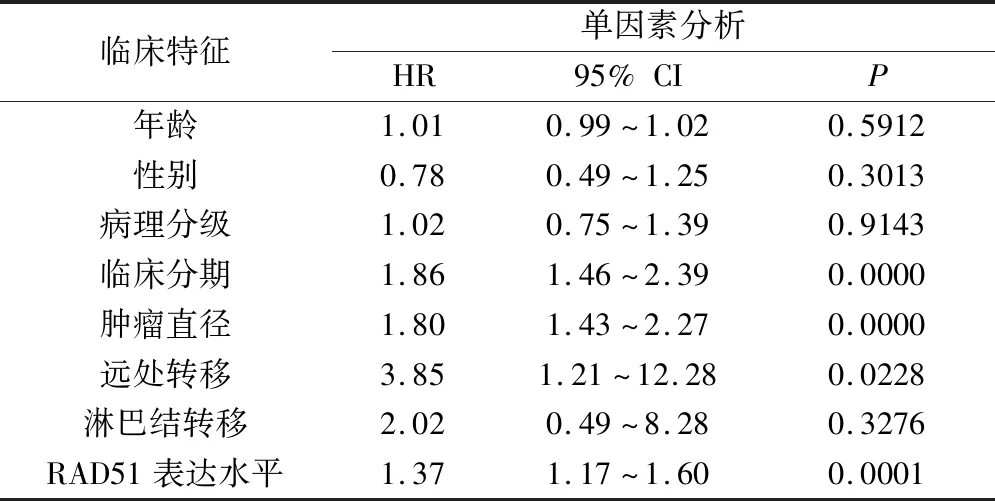
表2 单因素COX分析HCC患者临床特征和总体生存率的相关性
4.干扰效率的验证结果:将3条RAD51干扰序列转染至SMMC-7721细胞,通过qPCR和 Western blot法检测其mRNA表达改变。结果发现在SMMC-7721细胞中,si-RAD51-1组、si-RAD51-3组与Contorl组比较RAD51 mRNA表达水平明显降低(F=40.6,P<0.01,图4)。其中si-RAD51-3干扰效果最佳,选择此干扰作为后期实验组研究对象。
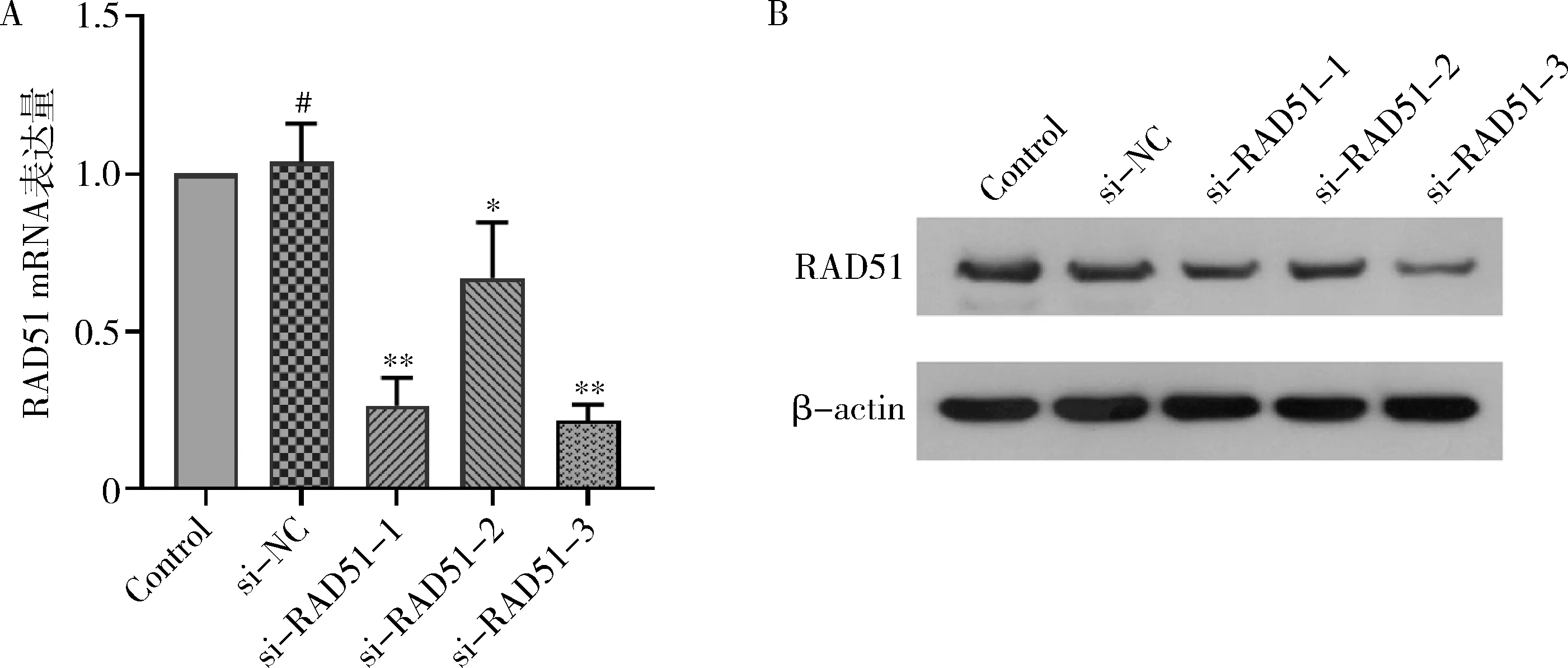
图4 干扰载体在SMMC-7721细胞干扰效率的验证A.qPCR;B.Western blot法检测;与Control组比较, *P<0.05, **P<0.01,#P>0.05
5.增殖实验结果:48h CCK-8实验结果表明, si-RAD51组细胞存活率显著低于Control组、si-NC组细胞存活率(F=27.9,P<0.01,图5)。
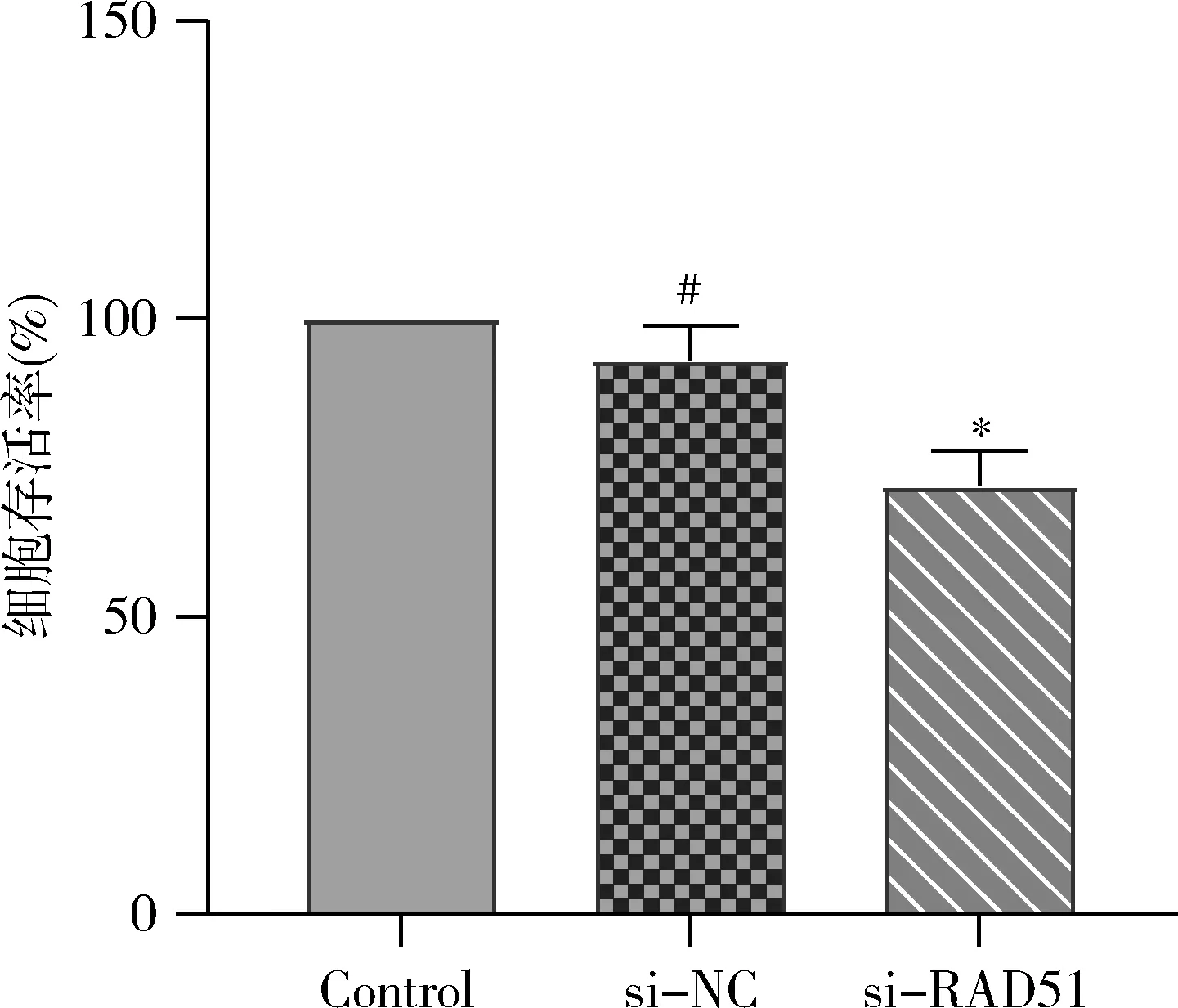
图5 沉默RAD51后SMMC-7721细胞的存活率与Control组比较,*P<0.01,#P>0.05
6.Transwell小室实验结果:si-RAD51组与Control组、si-NC组比较,SMMC-7721细胞的迁移能力受到抑制(F=39.8,P<0.01),侵袭能力也受到抑制(F=11.1,P<0.01,图6)。
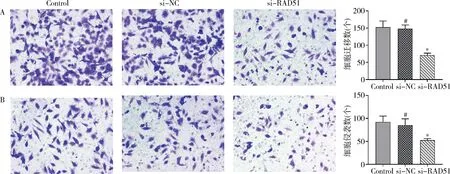
图6 沉默RAD51后SMMC-7721细胞Transwell小室实验(×200)A.Transwell迁移实验;B.Transwell侵袭实验;与Control组比较, * P<0.01,#P>0.05
7.GSEA基因集富集分析结果:通过GSEA进行RAD51基因GO功能注释和KEGG通路分析,结果显示HCC中与RAD51高表达相关的15个显著富集的GO功能注释和KEGG通路。RAD51主要位于染色体着丝粒区域,具有基因沉默、DNA包装、DNA复制、mRNA结合、细胞周期调控等分子功能,参与细胞周期的负调控、p53介导的细胞信号转导途径调控基因表达等生物学过程。RAD51基因可能在细胞周期、核苷酸切除修复、剪接体、错配修复、碱基切除修复、同源重组、N-聚糖生物合成、泛素介导的蛋白水解、p53信号通路等通路中发挥作用。
讨 论
RAD51基因位于染色体15q15.1上,由13个外显子组成,编码RAD51蛋白家族成员,参与HR和DNA修复[14]。它与5个RAD51样基因XRCC2、XRCC3、RAD51B(RAD51L1)、RAD51C(RAD51L2)和RAD51D(RAD51L3)在基因修复中起着至关重要的作用[15]。然而,RAD51在HCC中的临床意义和生物学功能仍有待研究。
本研究发现RAD51 mRNA在HCC组织中表达上调,同时,RAD51在肝癌SMMC-7721细胞中的表达显著高于正常肝L02细胞。生存分析数据显示,RAD51高表达组与低表达比较,其总体生存期更差。多因素COX分析中进一步提示RAD51表达水平可以作为HCC患者的独立预后指标。人类癌症的病程是由解剖学上的疾病阶段和肿瘤生长速度决定的。TNM分期通过肿瘤直径(T分期)、有无局部淋巴结转移(N分期)及有无远处转移(M分期)来确定肿瘤的进展程度。探索RAD51 mRNA表达水平与HCC患者临床特征关系时,发现RAD51表达增加与更高的病理分级、临床分期和肿瘤直径相关,提示RAD51高表达可能促进肿瘤进展。本研究结果显示RAD51 mRNA表达水平与HCC患者有无局部淋巴结转移不相关,但相关研究表明高表达的RAD51在乳腺癌中可以促进局部淋巴结转移的发生[16, 17]。出现这一现象的原因可能是由于在HCC患者临床特征数据中N分期的病例数缺失较多(占比30.8%)所致,需在实验研究和实际工作中进一步验证。
此外,笔者还进行了体外细胞学实验来研究RAD51的表达对肝癌细胞生物学功能的影响。本研究利用siRNA沉默肝癌SMMC-7721细胞中RAD51的表达,探讨RAD51与肝癌细胞增殖、迁移及侵袭能力的关系。48h CCK-8实验结果显示抑制RAD51后SMMC-7721细胞的增殖能力下降,Transwell细胞实验结果显示沉默RAD51后,无论是迁移细胞数还是侵袭细胞数均明显减少,提示沉默RAD51可以抑制SMMC-7721细胞的迁移侵袭能力。本研究通过基因集富集分析明确了RAD51基因的功能及其发挥生物学作用的可能通路。RAD51主要位于染色体着丝粒区域,具有基因沉默、DNA包装、DNA复制、mRNA结合等功能,参与p53介导的细胞信号转导途径以及周期负调控,与现有关于RAD51结构和分子功能的研究结果基本一致。RAD51的高表达在HCC中富集于p53、N-聚糖生物合成、泛素介导的蛋白水解等通路,这些生物学过程的异常已被证实与癌症进展有关。细胞蛋白的降解是一个复杂且精细的过程,绝大多数依赖泛素-蛋白酶体系统进行,细胞周期调节蛋白的水解异常致使细胞周期次序及细胞内环境紊乱,与细胞转化和恶性肿瘤的发生密切相关[18]。近年来有研究表明RAD51可以指导癌症患者的临床治疗及评估疗效[19~21]。随着我国人口老龄化趋势愈加明显,部分难以耐受手术者或肿瘤复发难以切除者需进行手术以外的其他手段治疗。抑制RAD51的表达可以改善肿瘤患者化疗、放疗耐受的情况,这一现象发生在乳腺癌、鼻咽癌、食管癌等多种恶性肿瘤疾病中[22~26]。RAD51的表达还与内分泌治疗、免疫治疗相关,抑制RAD51的表达可能对肿瘤治疗的方式及手段产生影响,具有重要的临床应用前景。
综上所述,本研究结果提示RAD51高表达与HCC患者更高的病理分级、临床分期密切相关,是影响总体生存预后的独立危险因素,沉默其表达可显著抑制肝癌SMMC-7721细胞的增殖、迁移及侵袭能力。在未来,关于RAD51的临床应用和转化研究将有助于更好地了解同源重组在恶性肿瘤中的作用。

