果胶酶产生菌的筛选鉴定和酶学性质研究
杨逸飞,雷雨田,赵天恒,宋 琪,闫达中,彭 芳*
(1.武汉轻工大学 生命科学与技术学院,湖北 武汉 430023;2.湖北省阿克瑞德检验检测有限公司,湖北 武汉 430077)
果胶酶(pectinase)是指所有能催化分解果胶质的一类酶的总称[1],属于一种复合酶。该复合酶包括原果胶酶(protopectinase)、聚半乳糖醛酸酶(polygalacturonase,PG)、果胶裂解酶(pectate lyase,PL)、果胶甲酯酶(pectinmethylesterase,PE)与纤维素酶(cellulase)等多种酶[2]。尽管自然界中天然果胶酶广泛存在于动植物体内,但其产量低,难以大量提取,微生物由于生长周期短,培养条件简单易控制,分布广等优势,是果胶酶的重要来源[3-4]。现代通常采用微生物发酵的方法,从微生物的代谢产物中提取果胶酶。一般来说果胶酶产生菌主要是真菌和细菌,在真菌中尤其以曲霉属最为常见[5-7]。目前,果胶酶广泛应用于食品工业的果汁加工和果汁澄清[8-9]以及造纸工业的纸浆脱胶、纺织和废水处理等行业[10]。胡椒(Piper nigrumL.)是重要的热带香辛作物,被誉为“香料之王”,研究发现果胶是胡椒果皮中胞间层和初级细胞壁中起交联作用的主要物质,胡椒脱皮可以采取水沤法、微生物酶法、微生物发酵法和冷冻机械脱皮法。水沤法脱皮耗时长(7~15 d),产品外观差,有“异臭味”。利用微生物酶法、微生物发酵法等新方法替代传统胡椒加工方法日益受到重视[11]。国内对胡椒生物酶法脱皮研究的重点主要聚焦于胡椒脱皮微生物的筛选、鉴定及脱皮效果的分析上[12-13],微生物来源的果胶酶用于胡椒脱皮报道并不多,菌种单一,产酶成本高,没有形成大规模生产。我国对果胶酶的研究、生产起步较晚,尽管果胶酶可以在中国生产,但品种单一,缺乏高效的果胶酶。面对果汁和食品加工行业的快速发展,许多果胶酶仍需要大量进口。因此,亟需筛选具有良好稳定性,高活性和高特异性的产果胶酶优良菌株,降低酶制剂成本。
本研究从海南胡椒种植园采集土壤,在这种环境中可能进化出可以降解胡椒果皮的微生物,采用刚果红染色法从土壤中筛选能产生果胶酶的菌株,通过生理、生化实验以及16S rRNA基因序列分析对高产果胶酶菌株进行鉴定,并对其所产果胶酶的酶学性质进行研究。以期为利用微生物酶法对胡椒脱皮的产业化打下基础,也为果胶酶的生产提供优良的菌种。
1 材料与方法
1.1 材料与试剂
1.1.1 样品来源
采集海南胡椒种植园的土壤,去掉表层2~3 cm表层土。
1.1.2 化学试剂
果胶(半乳糖醛酸≥74.0%):美国Sigma公司;刚果红(指示剂级):上海阿拉丁生化科技股份有限公司;胰蛋白胨、酵母提取物、琼脂粉(均为生化试剂):英国OXOID公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS),溴甲酚紫、(NH4)2SO4、FeSO4、K2HPO4、MgSO4、NH4NO3、FeCl3、NaCl(均为分析纯):国药集团(上海)化学试剂有限公司;脱氧核糖核苷三磷酸(deoxy-ribonucleosidetriphosphate,dNTP)Mix、Taq酶:宝生物工程(大连)有限公司。
1.1.3 培养基
液体初筛培养基:K2HPO42.0 g/L、MgSO40.5 g/L、果胶2.0 g/L、调整pH为7.2~7.4。115 ℃高压蒸汽灭菌30 min。分别配制75 g/L(NH4)2SO4和0.5 g/L FeSO4水溶液,过滤除菌后再添加到初筛培养基中(每100mL培养基加入2mL母液),使(NH4)2SO4、FeSO4的终质量浓度分别为1.5 g/L 和0.01 g/L。
固体初筛培养基:在上述液体培养基中添加18.0 g/L的琼脂粉。
发酵培养基:无机盐成分与初筛培养基相同,将果胶的质量浓度调整为4.0 g/L。
LB平板:胰蛋白胨10 g/L,酵母提取物5g/L,NaCl10g/L,pH 7.4,琼脂粉15 g/L,121 ℃高压蒸汽灭菌20 min。
芽孢杆菌培养基:KCl 0.2 g,MgSO40.2 g,(NH4)2HPO41 g,酵母膏0.2 g,琼脂粉7 g,糖或醇类10 g,蒸馏水1 000 mL,0.04%溴甲酚紫15 mL。调整pH为7.2,分装到试管中使培养基高度约为4~5 cm,121 ℃高压蒸汽灭菌20 min。
纤维素无机盐培养基:CaCl20.1 g,K2HPO40.6 g,酵母膏0.05 g,MgSO40.5 g,KH2PO40.5 g,NaCl 1.0 g,NH4NO31.0 g,FeCl30.02 g,羧甲基纤维素8 g,琼脂粉20 g,蒸馏水1 000 mL,pH 7.0~7.2,121 ℃高压蒸汽灭菌20 min。
淀粉培养基:牛肉膏5.0 g,蛋白胨10.0 g,NaCl 5 g,可溶性淀粉2 g,琼脂粉20 g,蒸馏水1 000 mL,pH 7.2~7.4,121 ℃高压蒸汽灭菌20 min[5]。
明胶培养基:蛋白胨5 g,明胶100~150 g,蒸馏水1 000 mL,pH 7.2~7.4,115 ℃高压蒸汽灭菌30 min。
半固体穿刺培养基:牛肉膏5.0 g,蛋白胨10.0 g,NaCl 5 g,琼脂粉3~6 g,蒸馏水1 000 mL,pH 7.2~7.4。121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
LAMBDATM25 Series 紫外可见光分光光度计:美国PerkinElmer公司;Biometra TProfessional Thermocycler聚合酶链式反应(polymerase chain reaction,PCR)扩增仪:德国耶拿分析仪器股份有限公司;ZHJH-C1112B超净工作台、ZWYR-2102C摇床:上海智诚分析仪器有限公司;YXQ-50SⅡ立式压力蒸汽灭菌锅:上海博讯医疗生物仪器股份有限公司;SPX-300BSH-Ⅱ生化培养箱:上海新苗医疗器械制造有限公司;5424R高速冷冻离心机:德国艾本德股份公司。
1.3 方法
1.3.1 高产果胶酶菌种的筛选
释放土壤微生物:将土壤样品取10 g于灭菌后的锥形瓶中加无菌水100 mL,放入28 ℃、200 r/min摇床72 h释放土壤中的微生物,制成10%的土壤悬液备用。
初筛:将摇瓶中的上清液梯度稀释为10-4、10-5、10-6后,各取100μL稀释液分别涂布于初筛培养基平板上,放入28℃培养箱中培养约2~3 d,以长出菌落明显为宜。选取长势较好的菌落将其转接至另外两个初筛培养基平板上,放入28 ℃培养箱中培养。
复筛:待长出菌落明显后,将一个平板倒入刚果红溶液(5 mg/mL水溶液),使其完全覆盖整个平板,静置15 min。再倒去刚果红溶液,用氯化钠溶液(1 mol/L)重新覆盖平板表面,静置15 min,观察菌落旁水解圈明显且较大的菌株[14]。将另外相同平板上水解圈较大的菌株接种于液体初筛培养基中,放入28 ℃、200 r/min摇床培养48 h后,取0.5 mL培养液接种于50 mL的发酵培养基中,28 ℃、200 r/min摇床培养72 h后,吸取2 mL上清液,经4 ℃、12 000 r/min,30 min离心后作为粗酶液。将粗酶液适当稀释后使用DNS定糖法测定果胶酶的活力,以此为依据筛选出活力相对较高的菌株[15]。
1.3.2 DNS定糖法检测果胶酶活力
取培养液10 mL,12 000 r/min离心15 min,取上清液作为粗酶液。用pH值为6.5的K2HPO4-KH2PO4缓冲液10 mL溶解0.05 g的果胶。取1 mL加入EP管中,再加入粗酶液0.5 mL,搅拌器混匀,放入46 ℃水浴锅中反应1 h。取0.13 mL反应后的混合液,加入另一EP管中,与0.47 mL的DNS试剂混合均匀。于100 ℃加热10 min,用石英狭缝比色杯在波长540 nm处测定吸光度值,以灭活的酶液作为空白对照,每个样品平行测定3次,结果取平均值。果胶酶酶活定义:在46 ℃、pH 6.5的条件下,1.0 mL果胶酶液每分钟催化果胶生成1 μmol半乳糖醛酸的酶量定义为1个酶活单位(U/mL)。酶活计算公式如下[16-17]:
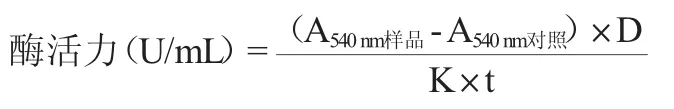
式中:A540nm样品、A540nm对照分别为待测样品酶和对照灭活的酶液在波长540 nm处的吸光度值;D为稀释倍数;K为标准曲线斜率;t为反应时间,min。
1.3.3 菌株鉴定
(1)形态特征
将YY01菌液划线于LB平板,28 ℃培养24 h,观察菌落形状、大小、颜色、水溶性色素等特征,并进行革兰氏染色。
(2)生理生化试验
糖、醇类发酵实验,细菌运动性观察实验,淀粉水解实验,纤维素水解实验,明胶液化实验参照文献[18],根据上述实验结果,参照《伯杰氏细菌鉴定手册》[19]和《常见细菌系统鉴定手册》[20],结合16S rRNA测定的结果,鉴定分离的菌株种属。
(3)分子生物学鉴定
将YY01菌液划线于无机盐平板,28 ℃培养24 h,煮沸法提取基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)。采用细菌通用引物27F和1492R,聚合酶链式反应(polymerase chain reaction,PCR)扩增16S rRNA。PCR扩增体系(20 μL):ddH2O 12.8 μL,PCR Buffer(10×)2 μL,引物P1(27F)、P2(1492R)各1 μL,10 mmol/L脱氧核糖核苷三磷酸(dNTP)Mix 2 μL,Taq酶0.2 μL,模板1 μL。PCR扩增程序:95 ℃预变性10 min;95 ℃变性1 min,56 ℃退火1 min,72 ℃延伸2 min,30个循环;72 ℃延伸10 min。
扩增产物送交生工生物工程(上海)股份有限公司测序。将测序结果提交美国国家生物技术信息中心(national center of biotechnology information,NCBI)的GenBank(Accession Number:MF443454)数据库,进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对分析,利用Mega X软件对其他几株类似菌属的16S rRNA序列进行序列一致性和同源性分析。
1.3.4 果胶酶的酶学性质
(1)最适pH值、最适温度测定
将果胶酶粗酶液加入到pH 7.0 Na2HPO4-NaH2PO4缓冲液中,分别测定30 ℃、35 ℃、40 ℃、45 ℃、50 ℃、55 ℃、60 ℃条件下酶活力。配制pH值分别为3.0~10.0的Na2HPO4-NaH2PO4和甘氨酸-NaOH缓冲液,将粗酶液加到上述各种不同pH值缓冲液中,测定45 ℃酶活力。
(2)pH稳定性、热稳定性测定
将粗酶液分别加到pH值为3.0~10.0的缓冲体系中保持12 h后,重新使用缓冲液将pH调为最适反应pH下测定果胶酶的活力。以最适pH条件下未保温的酶液测定的果胶酶活力记为100%,分别计算出不同pH条件下的相对酶活,考察酶的pH稳定性。酶的温度稳定性测定:将稀释后的酶液在30 ℃、40 ℃、50 ℃、60 ℃、70 ℃下处理6 h,取出1 mL然后立即将温度调整至45 ℃放置于pH 7.0缓冲液中测定果胶酶活性,以不同温度下未保温酶液测定的果胶酶活力记为100%,分别计算出不同温度条件下的相对酶活,考察酶的热稳定性。
2 结果与分析
2.1 高产果胶酶菌株的筛选
2.1.1 初筛菌株水解圈大小测定结果
能分泌果胶酶的菌株,其菌落周围的果胶被分解利用,利用刚果红染色后菌落周围出现透明圈的原理进行初筛,挑选出水解圈较大的菌株作为初筛菌株,结果见表1。由表1可知,筛选出3株菌落形态特征明显不同的菌株,分别命名为1号、2号、3号,1号菌落米黄色偏白,圆形中间有小突起;2号菌落灰白色,边缘不整齐,有毛刺;3号菌落灰白色,扁平圆形。其水解圈直径和菌落直径的比值分别为8、4、6。
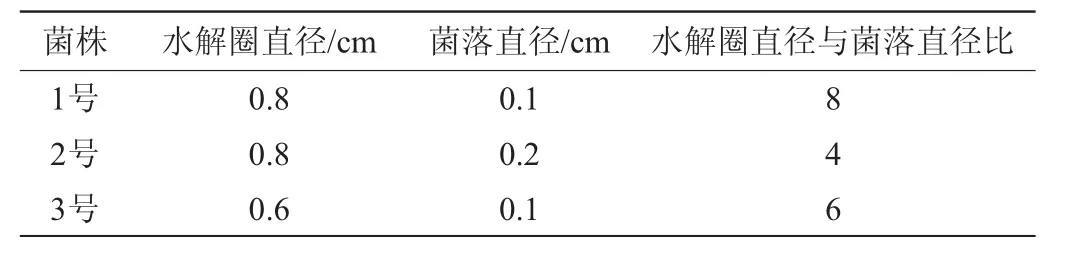
表1 筛选菌株水解圈直径大小比较Table 1 Comparison of hydrolytic circle diameter of screened strains
2.1.2 复筛菌株酶活力测定结果
将初筛得到的3株菌株平板划线得到单菌落后,接种于液态发酵培养基发酵后测定其产生的粗酶液的酶活力。因为酶活力和测定的吸光度值呈正比例线性关系,故用吸光度值的大小来代表其粗酶液的酶活力的大小,结果表明,1号菌所产生的粗酶液的酶活力(97.5 U/mL)显著高于其他两个菌株(2号和3号分别为36.3 U/mL,51.8 U/mL)(P<0.05),标记为YY01。经过3次连续传代培养,菌株YY01在筛选平板形成均匀、水解圈较大且透明的单菌落如图1所示,菌落质地均匀,较光滑、较粘稠、易挑起。在油镜下观察细胞形态,为杆状、单个或线型排列,革兰氏染色显示为紫色,表明菌株YY01为革兰氏阳性菌。因此,进一步对菌株YY01进行生理生化试验分析及分子生物学鉴定。
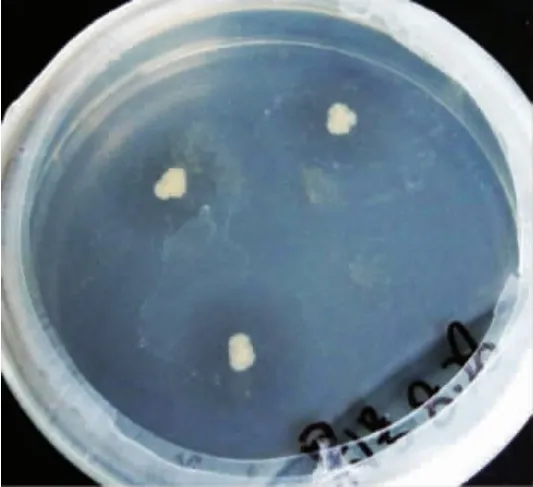
图1 菌株YY01的菌落形态及水解圈Fig.1 Colony morphology and hydrolytic circle of strain YY01
2.2 菌株YY01的鉴定
2.2.1 生理生化特性
将筛选菌株YY01单菌落到接种到相应的各种鉴定培养基,对其进行生理生化特性进行分析,结果见表2。由表2可知,菌株YY01的甘露醇、葡萄糖、蔗糖、木糖、阿拉伯糖发酵结果均为阳性;淀粉水解、纤维素分解、明胶液化结果均为阴性,不能运动。检索《伯杰氏细菌鉴定手册》,菌株YY01与芽孢杆菌的生理生化特征相吻合。初步断定本研究筛选的果胶酶产生菌YY01属于芽孢杆菌(Bacillus)。
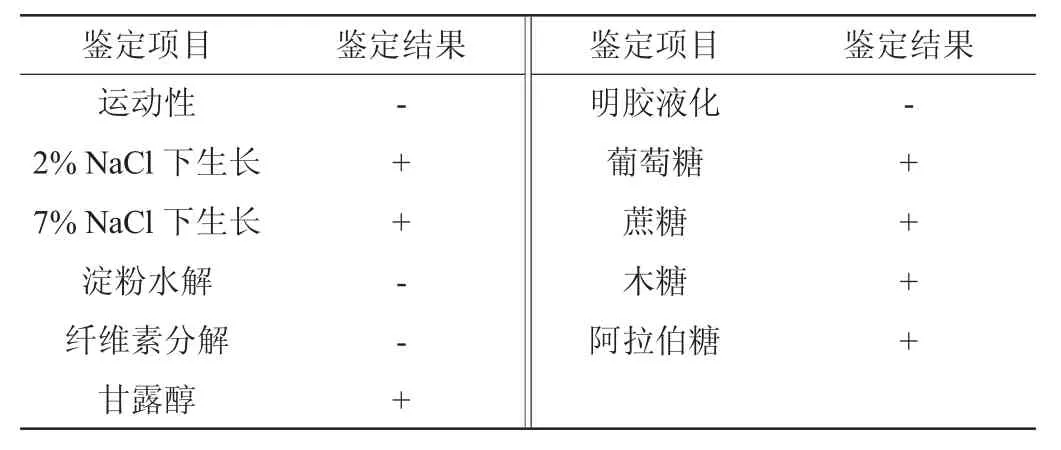
表2 菌株YY01的生理生化特征Table 2 Physiological and biochemical characteristics of strain YY01
2.2.2 菌株YY01的16S rRNA的测定结果
PCR扩增16S rRNA基因,PCR产物测序的结果拼接后,长度为1 438 bp,利用NCBI 的GenBank数据库的BLAST程序进行序列一致性比对,利用Mega X构建16S rRNA基因系统进化树见图2。由图2可知,菌株YY01的16S rRNA序列与PF4i 2的序列相似度达到了99.9%以上。因此,菌株YY01被鉴定为Bacillus niabensis。

图2 基于菌株16S rRNA基因构建的菌株YY01的系统进化树Fig.2 Phylogenetic tree of strain YY01 constructed based on 16S rRNA gene sequence
2.3 果胶酶的酶学性质
2.3.1 果胶酶最适pH值和最适温度
由图3A可知,果胶酶活力随着pH升高而升高;当pH值为7.0时,果胶酶活力最高,达到98.8 U/mL。当pH值>7.0以后,果胶酶活性呈现下降趋势。因此,果胶酶最适pH值为7.0。由图3B可知,随着发酵温度在30~45 ℃范围内升高,果胶酶酶活力逐渐升高,当温度为45 ℃时,果胶酶酶活最高,酶活力为97.5 U/mL;当温度>45 ℃之后,果胶酶活呈现下降的趋势,到50 ℃时,果胶酶活急剧下降。因此,果胶酶最适温度为45 ℃。
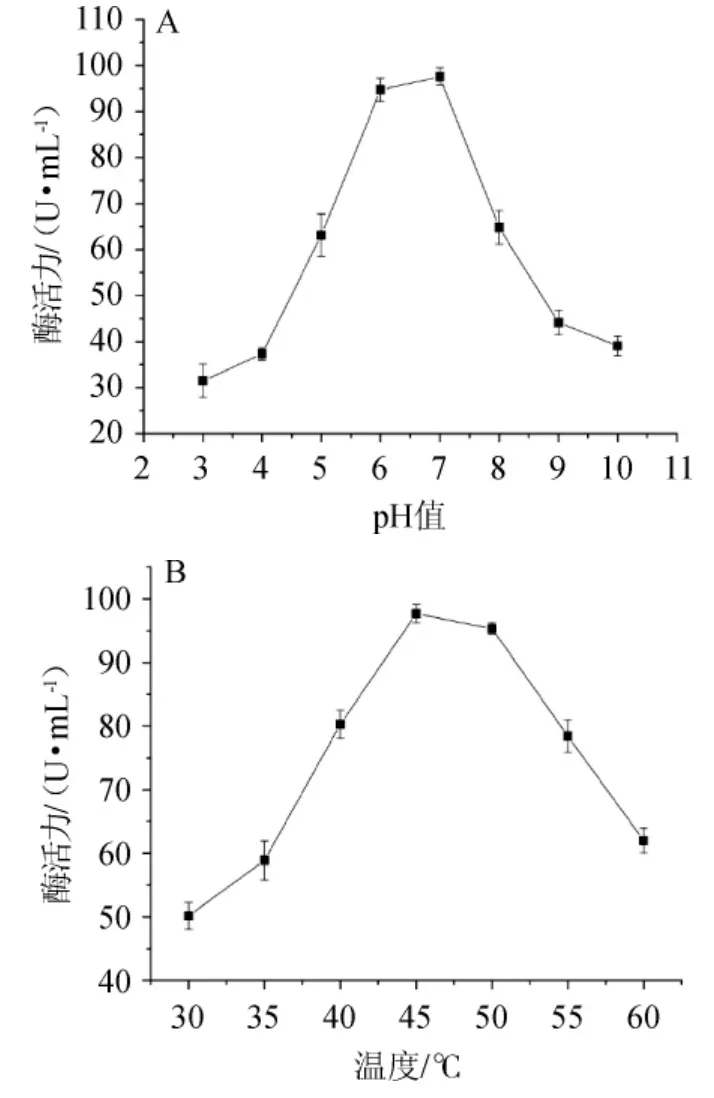
图3 菌株YY01产果胶酶的最适pH(A)及最适温度(B)Fig.3 Optimum pH (A) and temperature (B) of pectinase produced by strain YY01
pH对微生物营养物质的吸收和新陈代谢过程中酶的活性存在十分重要的作用,适宜的pH对菌种发酵起促进作用。温度对酶用于食品加工也是非常重要的参数之一。JOSHI M等[21]从海洋沉积物中分离出来的枯草芽孢杆菌在碱性缓冲液中,在温度为40 ℃时,果胶酶的活性最大。王齐玮等[22]从大麻籽中筛选到7株产果胶酶的最高酶活为21.8 U/mL。本实验筛选的菌株所产的果胶酶最适温度为45 ℃时,酶活力为97.5 U/mL,具有较好的应用前景。
2.3.2 果胶酶的pH稳定性与温度稳定性
由图4A可知,不同pH保温12 h后,果胶酶在pH 8.0时有75%的残余酶活力,在pH 10时仍有52.5%的残余酶活力。由图4B可知,果胶酶在40 ℃时保温6 h后有78.5%的残余酶活力,在50 ℃时保温6 h后仍具有64%的残余酶活力。由此可见,该菌株产果胶酶具有一定耐碱性和耐高温性。尹乐斌等[23]从果园土壤中筛选的一株高产果胶酶,发现在不同pH 4.0~7.0下,处理1 h,该酶还有50%的残留酶活力;在30~50 ℃条件下,处理1 h,该酶还有80%的残留酶活力。于平等[24]研究表明,从土壤中筛选的枯芽孢杆菌ZGL14,在50 ℃保温100 min有86.7%的酶活力;在pH 10的条件下保温100 min,仍有50.1%的酶活力。但在工业生产和果汁加工工艺研究中,果胶酶的酶解时间一般为2~5 h,酶解温度为45 ℃[25-27]。以往的相关研究报道在时间上处理相对较短,与生产实际应用具有一定的差距。本实验筛选的菌株YY01产生的果胶酶,在耐碱性和耐高温性上,更符合果汁生产工艺的需要,具有开发用于果汁加工和胡椒脱皮的应用前景。
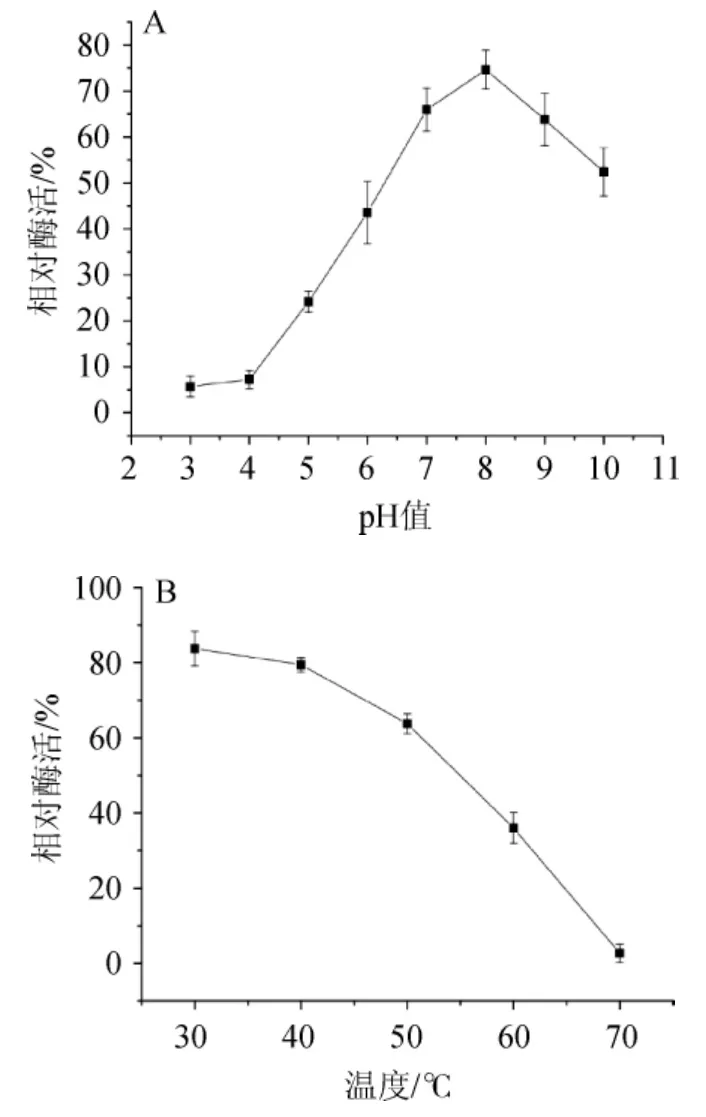
图4 菌株YY01产果胶酶的pH(A)及温度(B)稳定性Fig.4 Stability of pH (A) and temperature (B) of pectinase produced by strain YY01
3 结论
以果胶为唯一碳源,从海南寄送的泥土作为材料,通过稀释平板涂布直接筛选和摇瓶传代培养的方法筛选出一株产果胶酶菌株,经16S rRNA测序分析,结合生理生化实验,革兰氏染色等,将其鉴定为Bacillus niabensis。测定该菌株所产果胶酶的酶学性质,果胶酶的最适pH值为7.0,最适温度为45 ℃;在pH 10.0时孵育12 h,仍有52.5%残余酶活力;在50 ℃时孵育6 h,有64%残余酶活力,表现出了较好的酸碱耐受性和热稳定性,有应用到食品加工的潜力。

