酵母硒对滩羊的生物安全性评价:生长性能、血液常规参数、硒蛋白基因表达以及富集规律
贾雪婷 郭晓青 韩云胜 李 敬 赵青余 张 凯 汤超华 马 青 王 锦 赵正伟 张军民 秦玉昌
(1.中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京 100193;2.中国农业科学院北京畜牧兽医研究所,农业农村部华北动物遗传资源与营养科学观测实验站,北京 100193;3.青岛农业大学动物科技学院,青岛 266109;4.宁夏农林科学院动物科学研究所,银川 750002)
1973年,世界卫生组织(WHO)正式确认硒是人和动物必需的微量营养元素[1]。硒主要以硒代半胱氨酸的形式通过UGA密码子编码参与合成硒蛋白,并以硒蛋白的形式发挥生物学功能[2],参与机体氧化还原稳态调控、甲状腺激素代谢、免疫防御等多种生物进程[3-5]。目前,已在哺乳动物体内鉴定到的硒蛋白包括谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)家族、硫氧还原白还原酶(thioredoxin reductase,TXNRD)家族、甲状腺素脱碘酶(iodothyronine deiodinase,DIO)家族、硒蛋白(selenoprotein,SELENO)P等。动物体长期硒摄入不足易导致氧化还原稳态失衡[6],表现为生长缓慢、免疫力低下,并增加羊白肌病[7]、猪桑葚心、鸡渗出性素质等多种营养代谢疾病的患病风险[8-9],但长期过量的硒摄入同样会增加Ⅱ型糖尿病、心血管疾病等多种疾病的易感性[10-11]。因此,在家畜饲养管理中,要严格控制饲粮中硒的添加量。常见的饲粮补充硒源包括无机硒(硒酸盐、亚硒酸盐)和有机硒(酵母硒、蛋氨酸硒)。与无机硒相比,有机硒因生物利用率较高、毒性较低、污染性较小,在生产实践中应用更为广泛[12-14]。郭军蕊[15]研究了基础饲粮中添加0.5、5.0 mg/kg蛋氨酸硒对肉雏鸡饲用安全性的影响,结果表明,饲粮中添加5.0 mg/kg蛋氨酸硒可显著提高肉雏鸡血浆GPX活性和硒含量,但不会对肉雏鸡正常生长发育造成明显的不良影响。Tiwary等[16]发现羔羊口服2、3、4 mg/kg BW的亚硒酸钠和4、6、8 mg/kg DM的蛋氨酸硒12~14 h后,羔羊出现明显的采食量减少、呼吸急促等中毒现象。然而,关于酵母硒影响绵羊健康的安全性研究却鲜有报道。本试验以滩羊为研究对象,研究饲粮添加不同水平酵母硒对滩羊生长性能、血液常规参数、组织硒蛋白基因表达及组织器官硒含量的影响,评价酵母硒对滩羊的生物安全性,揭示硒在滩羊体内的生物富集规律,为酵母硒在绵羊养殖过程中的安全应用提供数据支撑,并提供酵母硒在绵羊饲粮中最高添加水平的安全参考系数。
1 材料与方法
1.1 试验饲粮
基础饲粮参照中华人民共和国农业行业标准《肉羊饲养标准》(NY/T 816—2004)[17]中肉用绵羊体重30 kg、日增重200 g时的营养需要配制,其组成及营养水平见表1,基础饲粮中硒含量为0.16 mg/kg。分别在基础饲粮中添加28.94、105.46、258.51、564.60 mg/kg酵母硒(北京英联马利食品有限公司,硒含量为3 300 mg/kg),使试验饲粮硒含量分别为0.25(Ⅰ组)、0.50(Ⅱ组)、1.00(Ⅲ组)、2.00 mg/kg(Ⅳ组)。《肉羊饲养标准》(NY/T 816—2004)[17]中推荐20~50 kg体重阶段育肥羊对饲粮硒的需要量为0.18~0.31 mg/kg,因此本试验Ⅰ组饲粮硒含量能满足滩羊的硒营养需要;Ⅳ组饲粮硒含量为育肥羊对饲粮硒的最大耐受含量。酵母硒和饲粮硒含量均采用电感耦合等离子体质谱(ICP-MS)法进行测定[18]。饲粮添加酵母硒时需利用粉碎后的玉米粉作为载体,逐级稀释,稀释到一定量后,再与其余除玉米秸秆外经粉碎的饲料原料按照配方添加混匀,以保证酵母硒充分均匀的混合。用制粒机将混匀后的饲料原料压制成直径6 mm左右的颗粒料,于通风避光处保存备用。
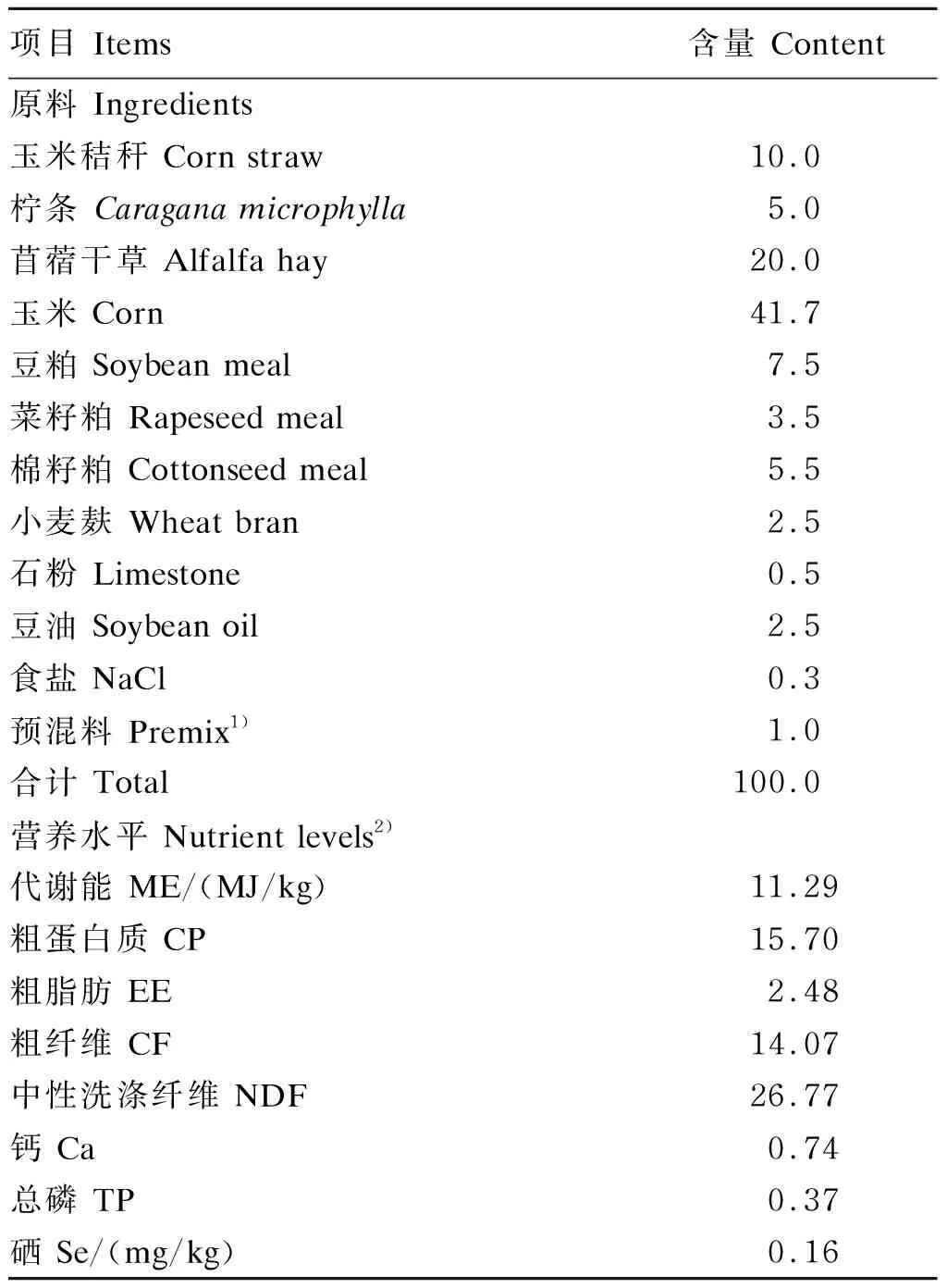
表1 基础饲粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of the basal diet (DM basis) %
1.2 试验动物、设计及饲养管理
试验选用64只体重[(32±2) kg]相近、健康的盐池滩羊公羔,随机分为4组,每组16个重复,每个重复1只羊。试验羊分栏饲养,每组随机饲喂1种试验饲粮,玉米秸秆和颗粒料混合饲喂,栏内单设饲槽和水槽,于每日07:00、17:00各饲喂1次,自由采食及饮水。按养殖场的常规程序进行免疫和消毒,保持圈舍自然通风。预试期10 d,正试期60 d。
1.3 样品的采集与制备
分别于试验第1天和第60天,空腹逐只称量试验羊体重。试验期间,每天准确称取羊只给料量,并回收记录剩余料量。试验结束后,每组选择8只体重相近的滩羊,颈静脉采集2份5 mL血液样本。其中一份用肝素钠抗凝管采集,在采血后2 h内使用全自动血液细胞分析仪(BC-5000 VET,深圳迈瑞生物医疗电子股份有限公司)测定滩羊血液常规参数,包括红细胞参数、白细胞参数、血小板参数等。另一份静置1 h后,3 000 r/min、4 ℃离心10 min制备血清,分装于1.5 mL冻存管,用于后续血清硒含量测定。血液样品采集完成后,屠宰采血羊只,宰前禁食12 h、禁水2 h,宰后采集同一部位的背肌、肝脏、肾脏、脾脏、肺脏、心脏等组织器官样品,液氮速冻,-80 ℃保存待测。
1.4 测定指标与方法
1.4.1 生长性能
记录滩羊的初始体重(IBW)和终末体重(FBW),计算各组的平均日增重(ADG);统计正试期的耗料量,计算平均日采食量(ADFI)。
1.4.2 组织中硒蛋白mRNA相对表达量测定
1.4.2.1 引物设计与合成
依据NCBI数据库公布的羊基因序列设计引物,并由北京三博远志生物技术有限责任公司进行合成,引物序列见表2。
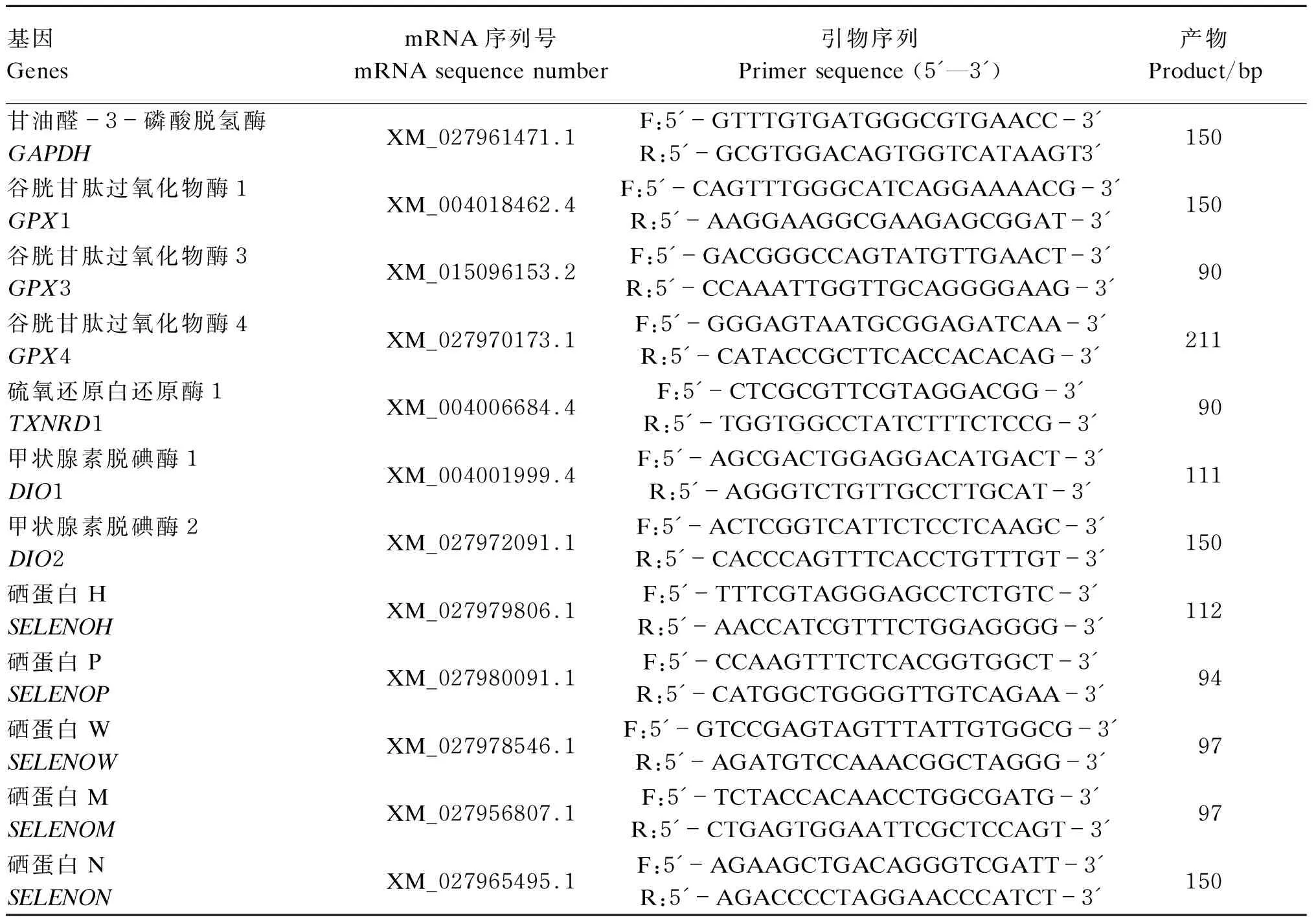
表2 引物序列Table 2 Primer sequences
1.4.2.2 硒蛋白mRNA相对表达量测定

1.4.3 硒含量测定
血清及组织器官中硒含量采用ICP-MS法进行测定,其中样品前处理方法参照中华人民共和国国家标准《食品安全国家标准食品中多元素的测定》(GB 5009.268—2016)进行[18]。准确称取0.5 g固(液)态样品(精确至0.001 g)于微波消解内罐中,加入8 mL硝酸,放置过夜,进行微波消解。微波消解仪消解程序为120 ℃保持5 min,150 ℃保持10 min,190 ℃保持20 min,升温时间5 min。冷却后取出,于167 ℃电热板加热1~2 h,溶液赶酸至黄豆粒大小,超纯水稀释定容至20 g,过0.45 μm水系滤膜,4 ℃保存待测硒含量,同时做空白及质控试验。
仪器参数:安捷伦-电感耦合等离子体质谱仪(ICP-MS 7900,安捷伦科技有限公司)。射频功率为1 550 W,等离子气体流速为15 mL/min,载气流速为1 L/min,氦气流速为4.5 mL/min,蠕动泵转数为0.1 r/s,雾化室温度为2 ℃,提取透镜2电压为-200 V,Omega偏转电压为-85 V,Omega透镜电压为-7.9 V,采样深度为10 mm,能量歧视电压为5 V,积分时间为1 s,监测同位素硒78、硒80、硒82,硒78用于定量计算。
1.5 数据统计与分析
应用SPSS 20.0软件对所得数据进行正态分布检验,符合正态分布后进行单因素方差分析(one-way ANOVA)。若有显著差异则采用Duncan氏法对组间差异进行多重比较,采用正交多项式对比法确定饲粮酵母硒添加水平的线性和二次效应。P<0.01为差异极显著,P<0.05为差异显著,P>0.10为差异不显著,0.05≤P≤0.10为有显著趋势。
2 结 果
2.1 饲粮酵母硒添加水平对滩羊生长性能的影响
由表3可知,各组之间滩羊初始体重无显著差异(P>0.05)。滩羊终末体重随饲粮酵母硒添加水平增长先降低后升高,为41.09~44.24 kg。各组之间滩羊终末体重、ADG均无显著差异(P>0.05)。方差分析表明,饲粮酵母硒添加水平有影响滩羊ADFI的趋势(P=0.069),但线性和二次分析未发现规律性变化(P>0.10)。
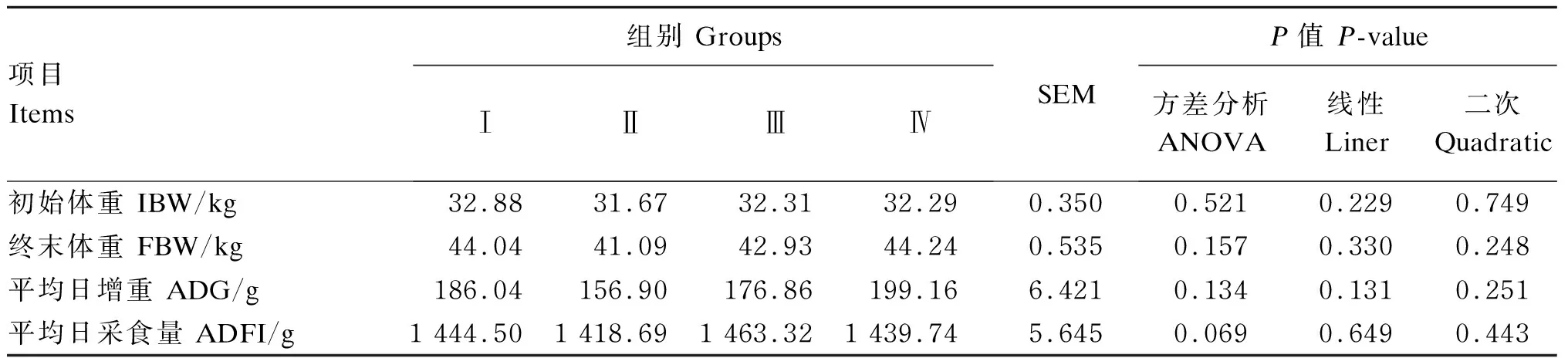
表3 饲粮酵母硒添加水平对滩羊生长性能的影响Table 3 Effects of dietary selenium yeast supplemental level on growth performance of Tan sheep
2.2 饲粮酵母硒添加水平对滩羊血液常规参数的影响
由表4可知,饲粮酵母硒添加水平对滩羊血液平均红细胞体积、嗜酸性粒细胞计数以及红细胞分布宽度标准差有显著影响(P<0.05)。与Ⅰ组相比,Ⅲ组滩羊血液平均红细胞体积、嗜酸性粒细胞计数显著升高(P<0.05)。与Ⅱ组相比,Ⅳ组滩羊血液红细胞分布宽度标准差显著降低(P<0.05)。与Ⅲ组相比,Ⅳ组滩羊血液嗜酸性粒细胞百分数(P=0.098)、血小板分布宽度变异系数(P=0.079)均呈下降趋势。滩羊血液平均红细胞血红蛋白量呈现出先升高后降低的二次变化(P<0.05)。饲粮酵母硒添加水平对其余血液常规参数均无显著影响(P>0.05)。
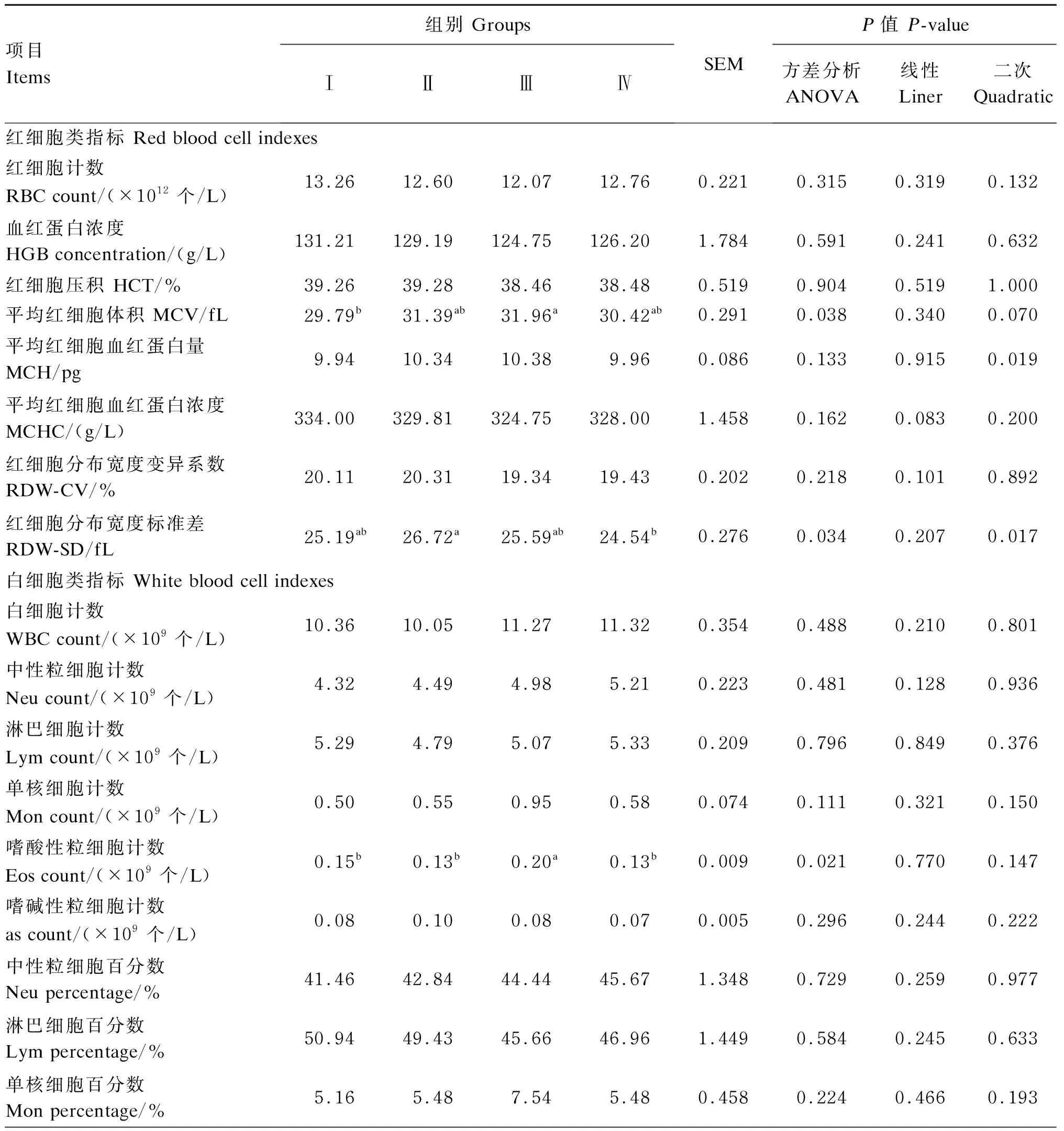
表4 饲粮酵母硒添加水平对滩羊血液常规参数的影响Table 4 Effects of dietary selenium yeast supplemental level on blood routine parameters of Tan sheep
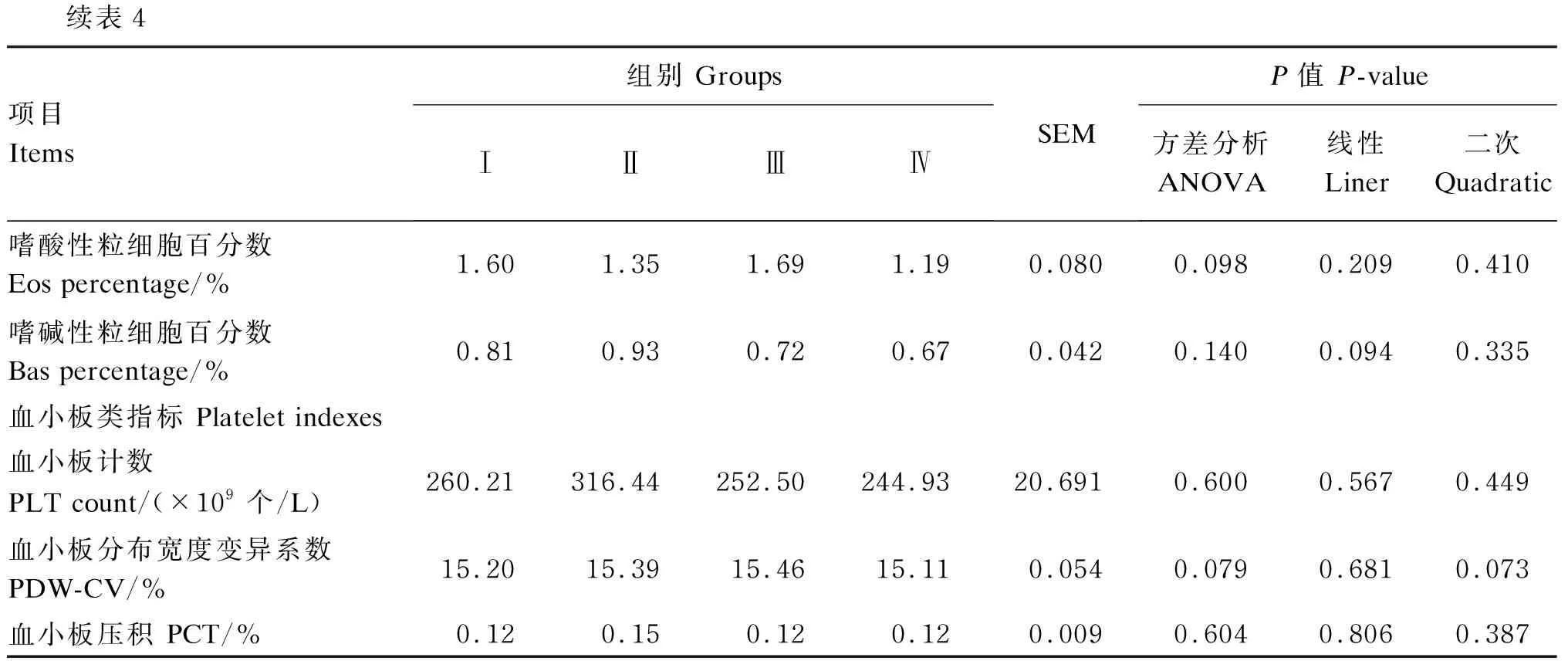
续表4项目Items组别 GroupsⅠⅡⅢⅣSEMP值 P-value方差分析ANOVA线性Liner二次Quadratic嗜酸性粒细胞百分数 Eos percentage/%1.601.351.691.190.0800.0980.2090.410嗜碱性粒细胞百分数 Bas percentage/%0.810.930.720.670.0420.1400.0940.335血小板类指标 Platelet indexes血小板计数 PLT count/(×109个/L)260.21316.44252.50244.9320.6910.6000.5670.449血小板分布宽度变异系数 PDW-CV/%15.2015.3915.4615.110.0540.0790.6810.073血小板压积 PCT/%0.120.150.120.120.0090.6040.8060.387
2.3 饲粮酵母硒添加水平对滩羊肝脏和肌肉硒蛋白mRNA相对表达量的影响
由表5可知,在肝脏组织中,饲粮酵母硒添加水平对滩羊肝脏GPX1、GPX3、TXNRD1、DIO1的mRNA相对表达量有显著或极显著影响(P<0.05或P<0.01)。与Ⅰ组相比,Ⅲ组滩羊肝脏GPX1、GPX3的mRNA相对表达量呈二次极显著升高(P<0.01)。与Ⅰ组相比,Ⅱ、Ⅲ、Ⅳ组滩羊肝脏TXNRD1的mRNA相对表达量呈二次极显著下降(P<0.01),DIO1的mRNA相对表达量呈线性显著下降(P<0.05);Ⅲ组滩羊肝脏SELENOM的mRNA相对表达量呈下降趋势(P=0.071)。在肌肉组织中,与Ⅲ组相比,Ⅳ组滩羊肌肉SELENOH的mRNA相对表达量呈下降趋势(P=0.075),GPX3的mRNA相对表达量呈先降低后升高的二次型变化(P<0.05)。各组之间滩羊肌肉硒蛋白mRNA相对表达量均无显著差异(P>0.05)。
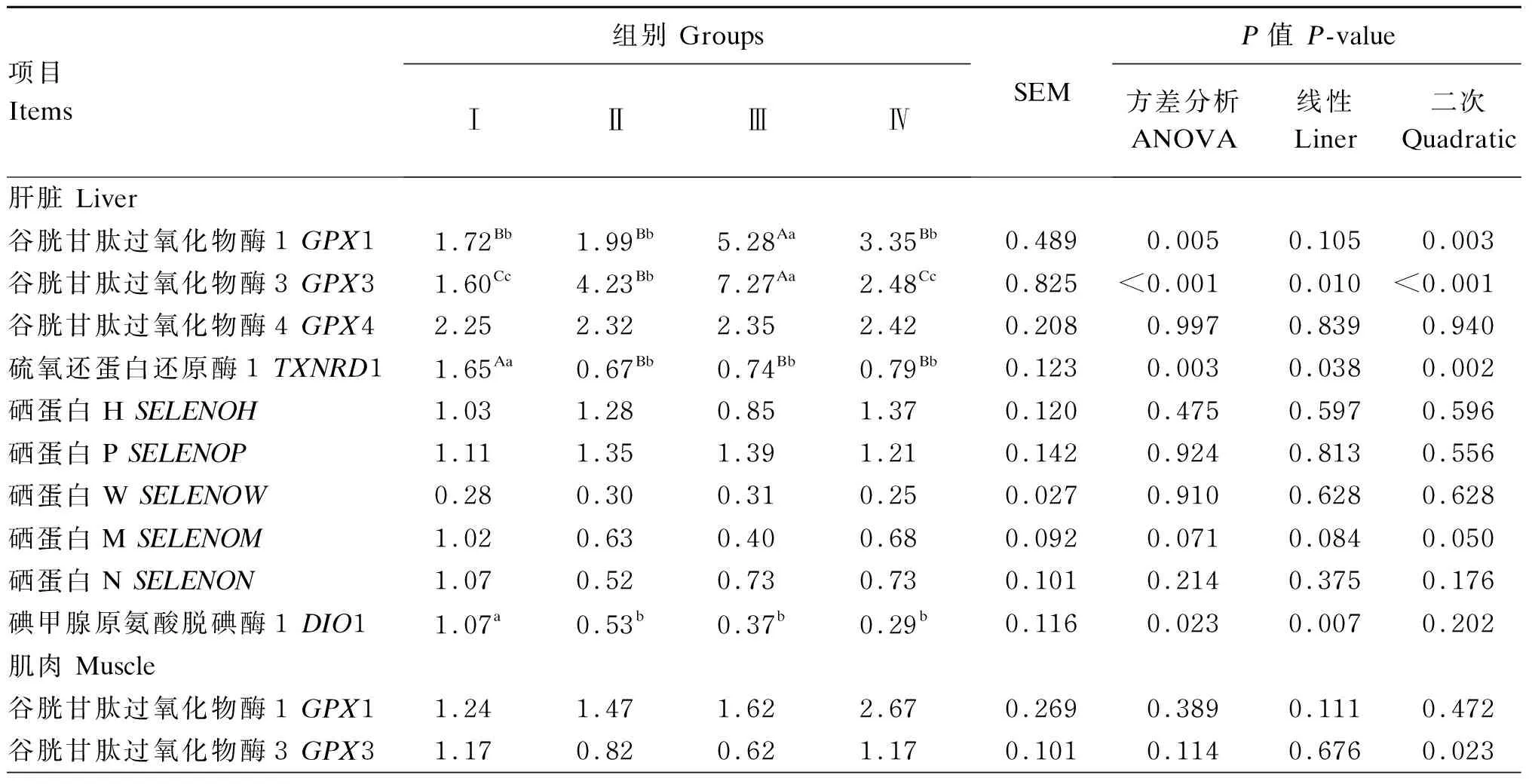
表5 饲粮酵母硒添加水平对滩羊肝脏和肌肉硒蛋白mRNA相对表达量的影响Table 5 Effects of dietary selenium yeast supplemental level on mRNA relative expression levels of selenoprotein in liver and muscle of Tan sheep
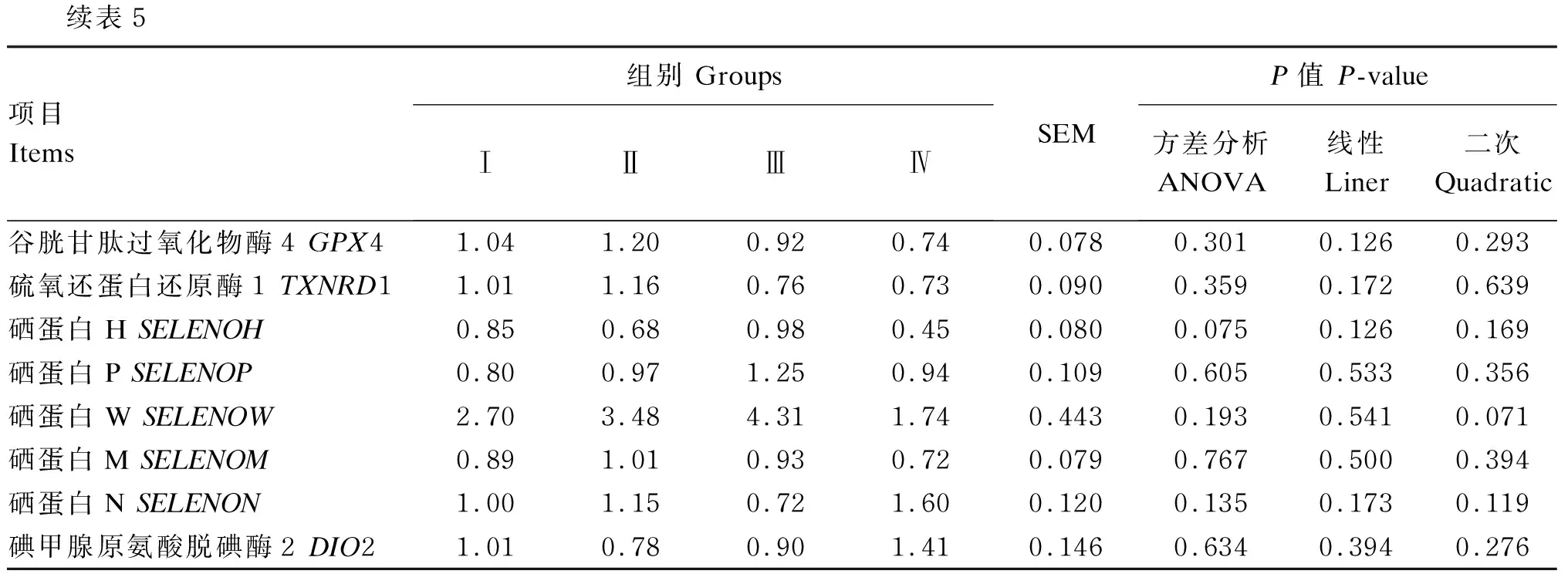
续表5项目Items组别 GroupsⅠⅡⅢⅣSEMP值 P-value方差分析ANOVA线性Liner二次Quadratic谷胱甘肽过氧化物酶4 GPX41.041.200.920.740.0780.3010.1260.293硫氧还蛋白还原酶1 TXNRD11.011.160.760.730.0900.3590.1720.639硒蛋白H SELENOH0.850.680.980.450.0800.0750.1260.169硒蛋白P SELENOP0.800.971.250.940.1090.6050.5330.356硒蛋白W SELENOW2.703.484.311.740.4430.1930.5410.071硒蛋白M SELENOM0.891.010.930.720.0790.7670.5000.394硒蛋白N SELENON1.001.150.721.600.1200.1350.1730.119碘甲腺原氨酸脱碘酶2 DIO21.010.780.901.410.1460.6340.3940.276
2.4 饲粮酵母硒添加水平对滩羊血清及组织器官硒含量的影响
由表6可知,饲粮酵母硒添加水平对滩羊血清及组织器官硒含量有极显著影响(P<0.01),滩羊血清及组织器官硒含量随饲粮酵母硒添加水平升高呈线性或二次极显著增加(P<0.01或P<0.01)。Ⅰ、Ⅱ、Ⅲ组滩羊血清硒含量无显著差异(P>0.01),Ⅳ组滩羊血清硒含量极显著高于Ⅰ、Ⅱ、Ⅲ组(P<0.01)。随着饲粮酵母硒添加水平的升高,滩羊背肌、肝脏、肾脏、肺脏、心脏、胰腺、十二指肠硒含量呈二次极显著增加(P<0.01),脾脏、睾丸硒含呈线性极显著增加(P<0.01)。不同组织器官中硒含量由高到低排序均为Ⅳ组>Ⅲ组>Ⅱ组>Ⅰ组,与饲粮酵母硒添加水平趋势相一致,且以肝脏、肾脏硒含量最高。
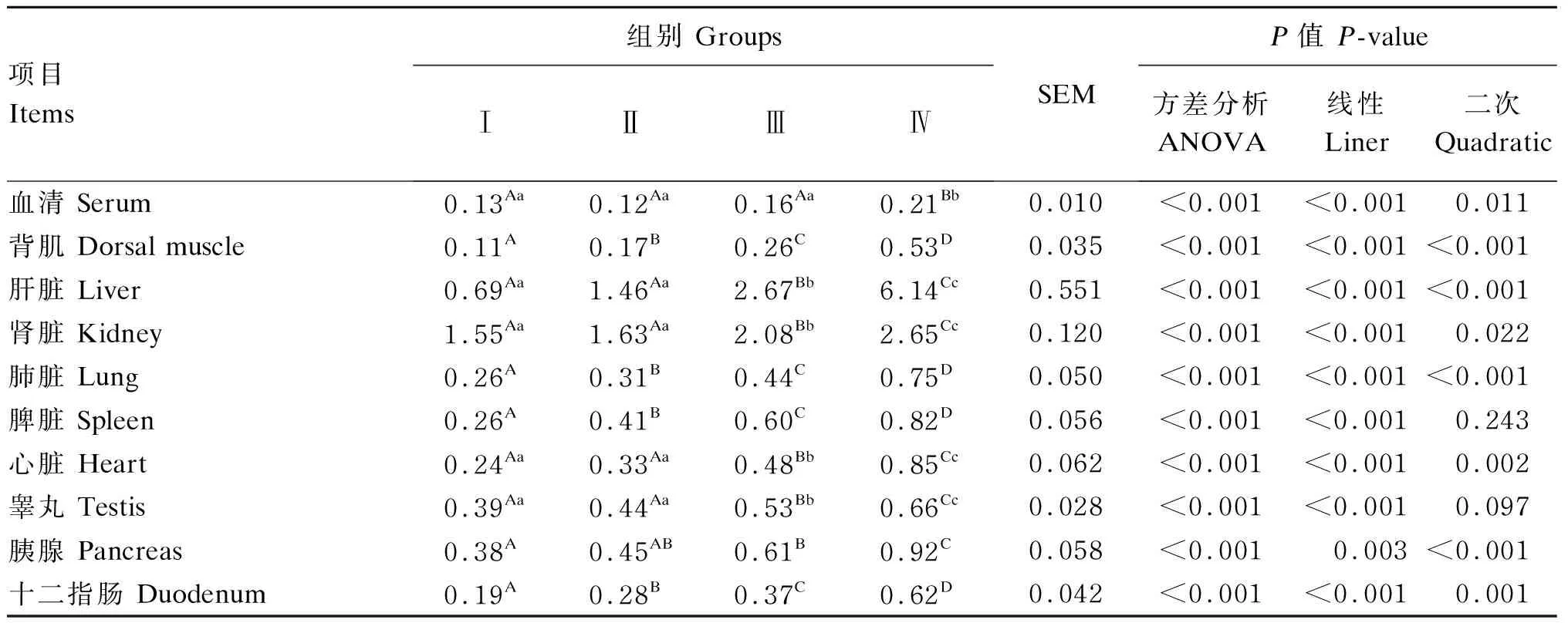
表6 饲粮酵母硒添加水平对滩羊血清及组织器官硒含量的影响Table 6 Effects of dietary selenium yeast supplemental level on content of selenium in serum and tissue and organ of Tan sheep mg/kg
3 讨 论
3.1 饲粮酵母硒添加水平对滩羊生长性能的影响
尽管已有文献广泛报道了硒对不同动物生长性能的影响,但可能由于不同国家、不同地域土壤和农作物中硒的含量、存在形式以及生物有效性的差异,尚未获得一致结论。邹晓庭等[19]研究证实,增加育肥猪饲粮有机硒水平对提高其ADG具有促进作用。但据Mahan等[20]报道,饲粮不同有机硒水平不会对育肥猪ADG和ADFI造成显著影响。张永翠等[21]研究发现,以酵母硒形式在杜寒杂交羊饲粮中添加0、0.2、0.4、0.8 mg/kg硒,羊的ADG、ADFI均无显著变化。本试验结果表明,饲粮酵母硒添加水平对滩羊终末体重、ADG、ADFI均无显著影响,与上述研究结果基本一致。
3.2 饲粮酵母硒添加水平对滩羊血液常规参数的影响
血常规检测即观察体内血细胞组分变化及形态分布,主要包括白细胞参数、红细胞参数、血小板参数三大组分[22]。粒细胞是构成机体免疫防御系统的重要成分之一[23]。本试验中,中性粒细胞计数随饲粮酵母硒添加水平升高呈升高趋势,且在正常范围内(1.8×109~6.3×109个/L),滩羊体内中性粒细胞对细菌的吞噬能力有所增强[24],提高了机体抵御病原入侵的防御力。嗜酸性粒细胞可以调节机体的局部免疫[25],一般在0.05×109~0.30×109个/L变化。本试验结果显示,添加酵母硒至饲粮硒水平为1.00 mg/kg时可以在一定范围内增强滩羊的机体免疫功能。滩羊血液平均红细胞体积随饲粮酵母硒添加水平升高呈先升高后下降趋势,与张永翠等[21]的研究结果相近。血小板对机体的止血功能极为重要,一般来说血小板计数大于400×109个/L则表示血小板计数增多,易导致血栓发生率升高[21]。本试验中,各组之间血小板计数无显著差异,说明饲粮添加酵母硒不会对滩羊机体造成不利影响。
3.3 饲粮酵母硒添加水平对滩羊肝脏及肌肉硒蛋白mRNA相对表达量的影响
提高动物饲粮硒水平可优化组织内多种硒蛋白基因表达,保障其生物学功能的正常发挥。GPX可将体内由不饱和脂肪酸过氧化生成的脂质过氧化物还原成无害的羟基化合物,使细胞免受氧化损伤[26]。本试验结果显示,滩羊肝脏GPX1、GPX3的mRNA相对表达量随饲粮酵母硒添加水平升高二次极显著上调,说明机体清除组织内有害过氧化物的能力有所增强,与Ibrahim等[27]的试验结果相符。与Ⅰ组相比,Ⅱ、Ⅲ、Ⅳ组滩羊肝脏TXNRD1的mRNA相对表达量有所下降,这与黄晓凤[28]在肉鸡上的研究结果相反,可能是由于物种差异的原因所导致。与Ⅰ组相比,Ⅱ、Ⅲ、Ⅳ组滩羊肌肉中GPX1、SELENOP的mRNA相对表达量均有所升高,GPX4、TXNRD1、SELENOW、SELENOM的mRNA相对表达量在一定范围有所升高。与肌肉组织相比,肝脏硒蛋白基因mRNA表达更易受饲粮酵母硒添加水平的调节作用,这与Zhang等[29]的试验结论相似,可能原因为肝脏是硒经肠道吸收后经历的第一个器官[30],同时也是硒蛋白合成和硒代谢的主要器官,生物半衰期接近4 d,而肌肉是硒的主要贮存器官,生物半衰期接近12 d[31],半衰期越长,说明蛋白质的合成降解代谢速率越慢,代谢活动不旺盛,可能导致肝脏组织中的硒蛋白基因mRNA表达比肌肉组织更易受饲粮酵母硒添加水平调控。综上所述,随着饲粮酵母硒添加水平的提高,滩羊肝脏及肌肉组织中多种硒蛋白基因mRNA相对表达量有所增长,这些硒蛋白所发挥的抗氧化等生物学功能得到增强。
3.4 饲粮酵母硒添加水平对滩羊血清及组织器官硒含量的影响
缺硒易导致机体多种病理过程的发生[32-33]。饲粮补硒不仅可以预防羊群缺硒疾病,同时也能增加羊血清及组织中的硒沉积。目前已有许多文献证实了饲粮补充有机硒对动物体组织硒富集的促进作用。Falk等[34]研究表明,在生长猪基础饲粮中补充酵母硒可显著提高猪心肌和骨骼肌中硒含量。张永翠等[35]通过以酵母硒形式给杜寒杂交羊补充0、0.2、0.4、0.8 mg/kg硒发现,羊血清、肝脏、肌肉中硒含量均随饲粮酵母硒补充水平增加呈上升趋势。本试验结果显示,滩羊血清及组织器官中的硒含量随着饲粮酵母硒添加水平的增长线性或二次升高,与上述研究结果基本一致。硒的沉积效率以肝脏和肾脏最高,与高建忠等[36]在仔猪上的研究结果相似,这可能是由肝脏和肾脏在硒的吸收与代谢过程中发挥的特殊功能决定的。肝脏是硒经吸收后到达的第一个器官[31],也是硒蛋白合成与硒代谢的主要器官。硒被摄入体内后主要以硒代蛋氨酸的形式在体内转化为硒代半胱氨酸,在β-裂解酶的作用下催化生成HSe-,参与硒蛋白合成[37]。在高硒摄入下,甲基转移酶可使HSe-甲基化形成二甲基衍生物[38-39],一小部分参与硒蛋白合成,其余主要经肾脏通过尿液排出体外,可能导致肝脏和肾脏中硒富集量明显高于其余组织器官。Lu等[40]在30周龄蛋鸡饲粮中添加0、0.3、1.5、3.0 mg/kg酵母硒(以硒计),饲喂12周后发现,与0 mg/kg硒组相比,3.0 mg/kg硒组鸡蛋及胸肉硒含量极显著提高1 036.73%、2 127.93%,但补充高剂量酵母硒并未对蛋鸡健康造成不良影响。结合上述结果,饲粮中补充酵母硒至饲粮硒水平达0.25~2.00 mg/kg时不会对滩羊生长性能、血液常规参数、组织硒蛋白基因表达以及组织器官硒含量造成不良影响。当补充酵母硒至饲粮硒水平达到0.25 mg/kg时,具有8倍的安全系数,即以2.00 mg/kg的硒水平饲粮饲喂滩羊是安全的。在不影响动物健康的前提下,饲粮补充高剂量酵母硒可极显著提高滩羊血清及组织器官中硒的富集量。
4 结 论
① 以酵母硒为补充硒源,饲粮硒含量在0.25~2.00 mg/kg时不会对滩羊生长性能、血液常规参数以及组织硒蛋白基因表达产生负面影响。
② 以酵母硒为补充硒源,饲粮硒含量达0.25 mg/kg时,具有8倍的安全系数,对饲喂滩羊是安全的。
③ 随着饲粮酵母硒添加水平的提高,滩羊血清及组织器官硒含量呈线性或二次极显著增加。

