硫酸熟化锂云母提取锂铷铯的机理及动力学特征
张秀峰,伊跃军,谭秀民,张利珍,王威,刘维燥
(1.中国地质科学院郑州矿产综合利用研究所,河南郑州,450006;2.国家非金属矿资源综合利用工程技术研究中心,河南郑州,450006;3.自然资源部多金属矿综合利用评价重点实验室,河南郑州,450006;4.四川大学化学工程学院,四川成都,610065;5.重庆大学材料科学与工程学院,重庆,400044)
美国内政部将对外依存度高且对美国经济发展和国家安全至关重要的35种矿产(锂、铷和铯等)列为关键矿产[1]。锂、铷和铯是航空航天、国防军工、新能源等产业发展不可或缺的矿产原料。锂是制造锂电池的核心原材料,也可用于制造锂铝、锂镁等高强度轻质合金,其同位素6Li 是制造氢弹和受控热核反应堆的原料。铷和铯具有优异的光电效应性能,是GPS、北斗等卫星导航定位系统所需铷(铯)原子钟的不可替代的基础材料[2−3]。我国强调要加强战略性矿产综合利用,推动难选冶共伴生资源高效分离提取和综合利用。
锂云母是兼含锂、铷和铯这3种关键矿产的特色矿物资源,是目前已知铷质量分数最高的矿物和铷的主要载体矿物,是重要的稀缺战略资源。锂云母是一种具有连续层状四面体结构的硅酸盐矿物,其化学式为KLi2−xAl1+x(Al2xSi4−2xO10)(OH,F)2,其中x=0~0.5,K可被Na,Rb和Cs类质同象替代,锂被包裹于层间,该种结构牢固稳定,难以破坏[4−5]。为了提取锂、铷和铯等组分,须采用高温助剂焙烧、浓酸熟化焙烧或高温高压浸出等强化手段破坏和重新构造锂云母矿物结构,转化生成新物质,使锂、铷和铯等有价组分转化为易溶出或可提取的形态。根据不同的矿相重构工艺,锂云母的化学冶金处理方法主要分为5 种:硫酸法[6−7]、石灰石烧结法[8−9]、硫酸盐焙烧法[10−11]、压煮法[12]和氯化焙烧法[13−14]。
1)硫酸法是采用硫酸与锂云母反应,H+替代Li+,生成可溶性硫酸锂。
2)石灰石烧结法是将石灰石或者石灰与锂云母混匀后于800~1 000 ℃焙烧发生矿相重构,焙砂经水淬、磨细后,通过水浸得到含氢氧化锂的浸出液。
3)压煮法是将锂云母在850~900 ℃温度下用水蒸气焙烧脱氟,再与盐溶液在高温高压下浸出,使锂溶出,根据所用药剂不同分为食盐压煮法、石灰乳压煮法和纯碱压煮法等。
4)氯化焙烧法是将氯化剂与锂云母混合在800~1 000 ℃焙烧,发生矿相重构,使锂转化为可溶性氯化锂,水浸后提取锂,所用氯化剂通常为氯气、盐酸、氯化钙、氯化钠、氯化钾和氯化铵等。
5)硫酸盐焙烧法是以硫酸钠、硫酸钾和硫酸钙等单一硫酸盐或复合硫酸盐作为助剂,与锂云母在850~1 100 ℃下焙烧,矿相重构后焙砂经水或稀硫酸浸出,实现锂的溶出。
石灰石烧结法曾实现了工业化,但因渣量大、成本过高而遭淘汰。压煮法要求耐高温高压的压煮设备、工业上操作性差。现今工业采用的硫酸盐焙烧法不能实现锂、铷和铯的高效共同提取;硫酸法和氯化焙烧法是实现锂铷铯共同提取的最具工业化潜力的方法。氯化焙烧法能耗较大,从节能降耗角度考虑,优先采用低温矿相重构工艺。温度温和的浓酸熟化是针对复杂难处理矿石的有效化学冶金方法[15−18]。不同于常规酸浸,浓酸熟化是指以高浓度酸代替稀酸作浸出剂,强化化学反应和物质传递,采用少量浓酸与矿石拌匀,润湿矿石表面,在表面形成薄膜液层并包裹矿石颗粒,升高至一定温度下熟化使浓酸与矿物接触发生化学反应[19]。为此,本文作者研究锂云母矿的硫酸熟化工艺[20],获取最优工艺参数,锂、铷和铯的提取率分别为97.1%,96.0%和95.1%,在此基础上,本文进一步明晰锂云母的硫酸熟化机理,查明其动力学控制因素,为硫酸熟化锂云母提取锂铷铯提供理论指导。
1 实验
1.1 实验原料
本研究采用的原料为浮选所得锂云母精矿,其化学组成见表1。从表1可知,锂、铷和铯质量分数较高。

表1 锂云母精矿的化学组成(质量分数)Table 1 Chemical composition of lepidolite concentrate(mass fraction) %
采用矿物表征自动定量分析系统(简称AMICS)[21]定量分析锂云母精矿的矿物,结果表明锂云母精矿的矿物质量分数组成如下:锂云母为58.43%,钠长石为22.49%,石英为17.43%,黄玉为1.54%,磷灰石为0.09%和锂磷铝石为0.01%。
1.2 实验方法
1.2.1 硫酸熟化−水浸实验
称取磨细的锂云母精矿500 g(粒度小于74 μm的颗粒质量分数为80%),置于聚四氟乙烯烧杯中,加入质量分数为85%的硫酸850 g,手动拌匀后放入电热鼓风干燥箱中,升温至180 ℃,静置熟化1 h后取出,手动捣碎后加入1 500 mL水,开启电动搅拌,在85 ℃浸出30 min 后趁热过滤,用少量纯水淋洗滤饼3次,洗涤后的滤饼于烘箱中120 ℃下干燥至恒质量后即为浸出渣,滤液即为浸出液,对浸出渣分析和表征,根据式(1)计算锂、铷和铯的浸出率。

式中:η为Li,Rb 或Cs 的浸出率,%;w1为Li,Rb或Cs在锂云母精矿中的质量分数,%;m1为锂云母精矿的质量,g;w2为Li,Rb 或Cs 在浸出渣中的质量分数,%;m2为浸出渣的质量,g。
1.2.2 硫酸熟化动力学实验
将粒度范围较窄(38~45 μm)的锂云母精矿预先加热至所需温度(120,170或220 ℃)后取出,快速加入所需的水和质量分数为98%浓硫酸,快速混匀,置于所需熟化温度下熟化,熟化一定时间后取出,按4∶1 的液固比加入水在85 ℃搅拌浸出30 min,分析浸出渣中Li,Rb 和Cs 的质量分数,计算Li,Rb和Cs的浸出率,将三者浸出率的平均值表示为硫酸熟化过程中锂云母的转化率α。
1.2.3 分析与表征
采用硅钼蓝光度法测定SiO2质量分数,采用原子吸收光谱仪(iCE3500,Thermofisher)测定Rb和Cs 的质量分数,采用离子选择电极法测定F 质量分数,采用电感耦合等离子体发射光谱仪(ICPOES,IRIS Intrepid II XSP)测定Li,K,Na,Ca和Al等金属元素质量分数。
采用Rigaku D/Max−1200型X射线衍射仪进行XRD 测试,采用Malvern 公司Mastersizer 2000 型激光粒度仪测试粒度分布,采用扫描电镜(EVO HD 15,德国Zeiss)分析形貌,与X 射线能谱仪(X−Max 50,英国Oxford)联用分析样品表面元素组成及相对质量分数。
2 硫酸熟化机理
2.1 浸出渣和硫酸熟化产物的组成分析
硫酸熟化−水浸处理后的浸出渣与锂云母精矿的化学组成对比见表2。
由表2可知:经过硫酸熟化−水浸处理后,Li2O,Rb2O 和Cs2O 质量分数由锂云母精矿中3.34%,1.08%和0.22%分别大幅降低至浸出渣中的0.19%,0.055%和0.011%,对应的浸出率分别为96.15%、96.55%和96.62%;K2O和Al2O3质量分数由锂云母精矿中6.25%和20.71%分别大幅降低至浸出渣中的0.70%和7.25%,对应的浸出率为96.10%和76.31%;氟质量分数由精矿中4.53%减少为浸出渣中2.56%,SiO2质量分数由60.63%增加到85.42%,浸出渣的成分(质量分数)主要是85.42%的SiO2,7.25%的Al2O3和3.07%的Na2O。锂、铷、铯和钾得到高效提取,其浸出率均在96%以上,硫酸熟化过程中锂云母矿物被消耗。另外,经检测分析,硫酸熟化产物中F质量分数为1.30%,而原料中F 质量分数为4.53%,由此计算得知29.3%的氟在硫酸熟化过程中以气体形式逸出,逸出气体可能是HF或SiF4。
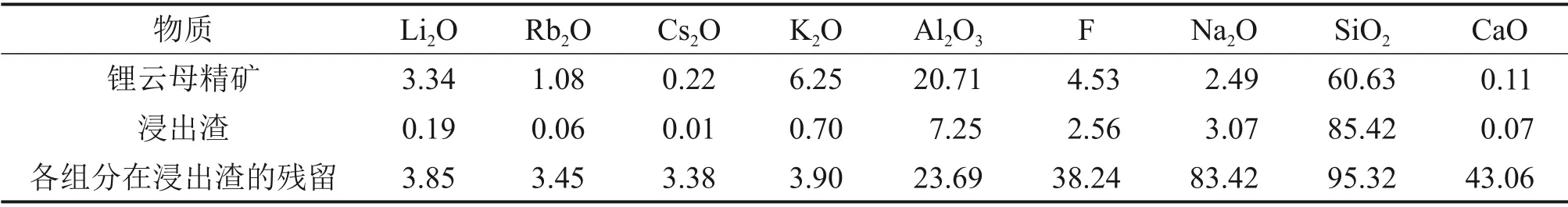
表2 锂云母精矿与浸出渣的化学组成对比(质量分数)Table 2 Comparison of chemical composition between lepidolite concentrate and leaching residue(mass fraction) %
图1所示为锂云母精矿、硫酸熟化产物和浸出渣的XRD 图谱。由图1可知:经过硫酸熟化后,锂云母物相衍射峰显著弱化,并且还出现了新物相Li2SO4,KAl(SO4)2和Al(SO4)(OH)·5H2O。硫酸熟化前后物相变化的结果表明,硫酸熟化过程中锂云母矿物与硫酸反应而被逐渐消耗,锂云母矿物中K,Li,Al,Rb和Cs组分转化为可溶性硫酸盐。由于铷和铯质量分数低,生成的铷铯化合物质量分数低于XRD 的检测限,因而未检测到铷、铯化合物的衍射峰。硫酸熟化后钾转化为KAl(SO4)2,由于铷、铯与钾的性质相似,故而推测铷和铯相应地转化为RbAl(SO4)2和CsAl(SO4)2。锂云母经硫酸熟化−水浸处理后的浸出渣主要由石英和钠长石组成。因此,硫酸熟化是锂云母矿物与硫酸的反应过程,在此过程中锂云母矿物被消耗。
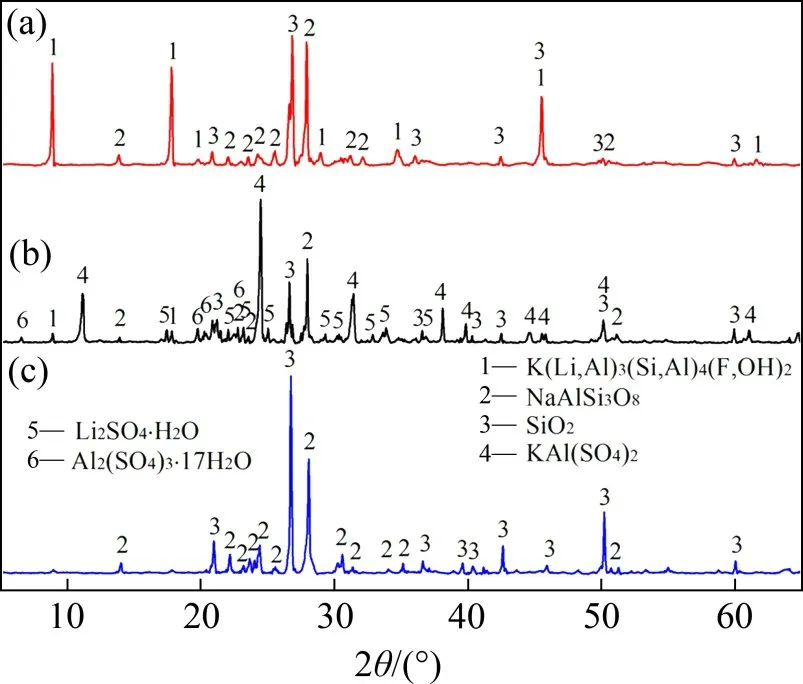
图1 锂云母精矿、硫酸熟化产物和浸出渣的XRD图谱Fig.1 XRD patterns of lepidolite concentrate,product of sulfuric acid baking and leaching residue
硫酸熟化产物和浸出渣的EDS 能谱分析结果见图2和图3。由图2可知:“谱图3”和“谱图4”这2 个微区的元素组成是K,Al,Si,O 和S,结合硫酸熟化产物XRD 结果可知,对应的物相是KAl(SO4)2和SiO2,“谱图1”和“谱图5”这2个微区的元素组成是Al,Si,O 和S,对应的物相是Al(SO4)(OH)·5H2O和SiO2。据此推断,硫酸熟化后固体颗粒由熟化产物层包裹,该产物层是锂云母矿物与硫酸反应的生成物。由于电子能谱仪检测不到锂元素,所以,EDS谱图中并未出现Li。
由图3可知:浸出渣中“谱图1”“谱图2”“谱图4”3 个微区的元素组成是Na,Al,Si 和O,对应的物相是NaAlSi3O8,“谱图3”微区的元素组成是Si 和O,对应的物相是SiO2。EDS 结果结合XRD 结果(图1)进一步证明了浸出渣由钠长石(NaAlSi3O8)和石英(SiO2)组成。
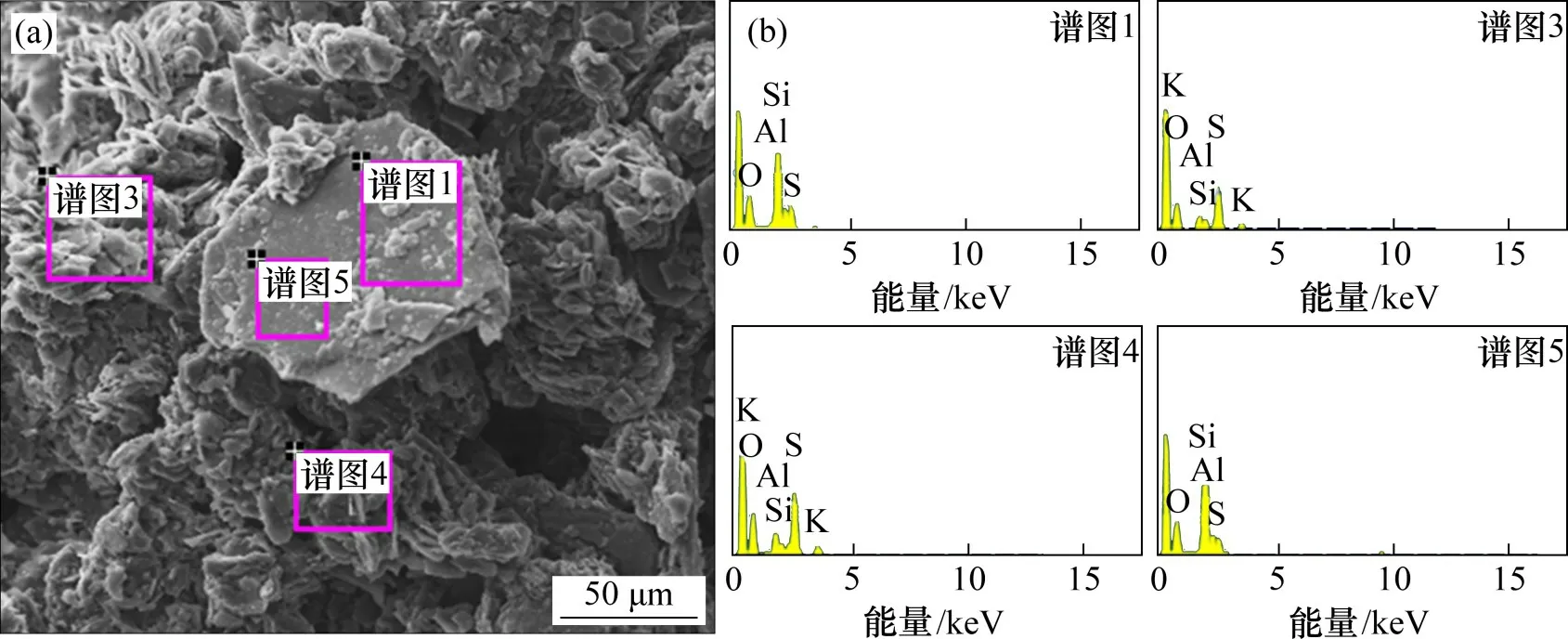
图2 硫酸熟化产物的EDS微区分析Fig.2 EDS analysis at points of baked product

图3 浸出渣的EDS微区分析Fig.3 EDS analysis at points of leaching residue
2.2 硫酸熟化前后的形貌和粒度变化
图4所示为锂云母精矿、硫酸熟化产物和浸出渣的SEM 照片。从图4可知:锂云母精矿是由粒径不一、形状不规则的矿石颗粒组成,颗粒粒径基本小于100 μm,并含有少量粒径低于20 μm 的颗粒;硫酸熟化后的产物外部包裹着一层粒度较小的类似于熔融物的产物层;熟化产物经过水浸后,外部产物层消失,得到粒度细化的浸出渣,浸出渣粒度明显小于锂云母精矿给料粒度,其中,粒径小于20 μm 的颗粒显著增多。根据SEM 照片的演变,可以推断,硫酸熟化过程中颗粒较大的锂云母矿物被消耗,转化生成可溶性硫酸盐以及细小难溶物,产物层包裹在颗粒外部,经过水浸后产物层消失,可溶性硫酸盐进入溶液中,从而提取锂、铷和铯。结合浸出渣XRD 和EDS 结果,推断熟化生成的细小难溶物是SiO2。

图4 锂云母精矿、硫酸熟化产物和浸出渣的SEM照片Fig.4 SEM images of lepidolite concentrate,baked product and leaching residue
为了定量分析硫酸熟化前后粒度变化,对浸出渣进行激光粒度分布测试,将其与熟化前的原料粒度组成进行对比,结果见图5。由图5可知:锂云母精矿经过硫酸熟化工艺处理后,颗粒粒度显著变细,锂云母精矿的d10,d50和d90分别为6.969,34.941 和144.590 μm,浸出渣的d10,d50和d90分别降低为5.548,31.642和81.168 μm,体积平均粒径由熟化前的61.298 μm 减小为水浸后的38.291 μm,结果印证了图4所示结果,进一步说明了熟化过程中颗粒较大的锂云母矿物被消耗。

图5 锂云母精矿和浸出渣的激光粒度分析Fig.5 Laser particle size analysis of lepidolite concentrate and leaching residue
2.3 硫酸熟化过程机制
通过前述分析可知硫酸熟化锂云母提取锂铷铯的机制:熟化过程中硫酸与锂云母矿物发生反应,锂云母矿相结构被破坏,锂云母矿物中Li,Rb,Cs,K,Al,Si组分相应转化为可溶性的硫酸盐Li2SO4,RbAl(SO4)2,CsAl(SO4)2,KAl(SO4)2,Al(SO4)(OH)·5H2O以及不溶性的SiO2,通过水浸使可溶性硫酸盐溶解进入浸出液,实现锂、铷和铯的共同提取。图6所示为硫酸熟化锂云母提取锂铷铯的物相转化示意图。
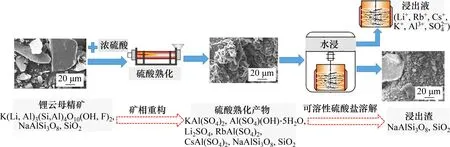
图6 硫酸熟化锂云母精矿提取锂铷铯的物相转化示意图Fig.6 Digram of extraction of Li,Rb and Cs from lepidolite concentrate by sulfuric acid baking process
3 硫酸熟化的动力学研究
3.1 硫酸熟化与缩芯模型
在锂云母精矿的硫酸熟化工艺中,水浸是简单的可溶性硫酸盐的溶解过程。水浸容易进行,Li,Rb和Cs的浸出率主要取决于硫酸熟化过程碱金属转化为硫酸盐的程度,而硫酸化程度受硫酸用量、硫酸浓度、熟化温度以及熟化时间等因素影响。因此,研究硫酸熟化过程的动力学行为具有重要意义,可为强化硫酸熟化过程提供理论依据。
硫酸熟化是将浓硫酸与锂云母精矿固相混合但并不形成矿浆流体相,仅是固体物料被浓硫酸溶液浸润,固体颗粒表面的酸溶液扩散后与锂云母颗粒发生化学反应,基本上是在非流体相中进行的非催化“流体−多粒微固体”体系多相反应过程。如图4所示,锂云母矿物不是多孔介质,随着熟化的进行,锂云母固体颗粒粒度逐渐变小,反应生成的硫酸盐固相产物包覆于未反应固体颗粒表面,未反应的锂云母颗粒就像被包裹的芯一样不断缩小,可近似认为反应只在矿物颗粒表面进行。因此,锂云母精矿的硫酸熟化过程可以采用缩芯模型[22]描述。
硫酸熟化过程包括外扩散、内扩散、化学反应等几个步骤:
1)硫酸通过液膜扩散到固体颗粒外表面(外扩散过程);
2)硫酸由固体颗粒外表面经过固相产物层以及固体颗粒的孔隙(裂隙)扩散到未反应芯表面(内扩散过程);
3)硫酸在未反应芯表面与锂云母矿物发生化学反应;
4)气相产物经过固相产物层扩散到固体颗粒外表面(内扩散过程);
5)气相产物由固体颗粒外表面经液膜扩散到空气中(外扩散)。
最慢的步骤决定着硫酸熟化反应速度。根据阻力大小,硫酸熟化过程控制步骤通常分为外扩散控制、内扩散控制和化学反应控制。根据缩芯模型,3种动力学方程[23−24]分别如下。
外(液膜)扩散控制:

内(固膜)扩散控制:

化学反应控制:

式中:α为硫酸熟化的转化率,%;t为反应时间,min;k为反应的表观速率常数,min−1。
根据表观速率常数和温度的关系式即阿仑尼乌斯(Arrehenius)公式可以求出反应的表观活化能。阿仑尼乌斯公式为

式中:E为反应活化能,kJ/mol;A为指前因子,min−1;R为气体常数,8.314 J·mol−1·K−1;T为反应温度,K。
3.2 硫酸熟化动力学曲线
通过动力学实验以确定硫酸熟化过程的控制步骤,120,170和220 ℃这3个温度的硫酸熟化动力学曲线见图7。由图7可见:温度对硫酸熟化影响较大;温度越高,熟化速度越快,达到相同转化率所需时间越短;当温度为120 ℃时,转化率由熟化30 min 的51.36% 快速增加到60 min 的74.33%,熟化120 min的转化率为88.78%,当时间延长至180 min时,转化率小幅增加至90.31%;当熟化温度为170 ℃时,20,40,60 和90 min 对应的转化率分别为52.17%,79.99%,87.86% 和93.11%;熟化温度为220 ℃,10,20,40和60 min对应的转化率分别为54.02%,83.67%,92.56%和92.82%。
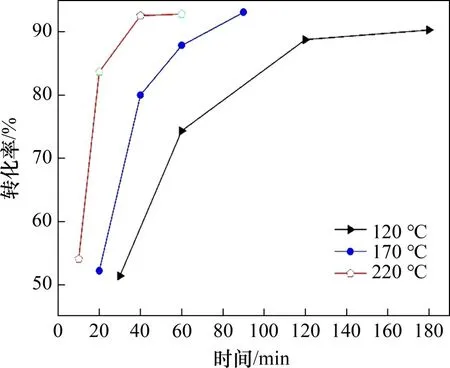
图7 不同温度下时间对硫酸熟化程度(转化率α)的影响Fig.7 Effect of baking time on sulfuric acid baking conversion(α)at different temperatures
3.3 动力学方程拟合与活化能计算
基于图7中硫酸熟化转化率α与时间t的关系,按照外扩散控制方程α=kt、化学反应控制方程1−(1−α)1/3=kt和内扩散控制方程1−(1−α)2/3−2α/3=kt进行线性拟合,结果见图8。
从图8可见:在120~220 ℃范围内,转化率α与时间t拟合为直线的拟合优度(决定系数R2为0.67,0.72 和0.84)很低,转化率α与时间t不呈线性关系;1−(1−α)1/3与时间t的线性关系良好,拟合优度R2为0.96~0.99,符合化学反应控制方程;1−(1−α)2/3−2α/3与时间t的线性关系良好,拟合优度R2为0.98~0.99,符合内扩散控制方程。结果表明,硫酸熟化过程不符合外扩散控制方程,硫酸熟化受化学反应控制或内扩散控制。
根据Arrehenius公式,将图8(b)和(c)拟合确定的直线斜率即反应表观速率常数k以lnk对温度的倒数(1/T)作图并线性拟合,拟合结果见图9。
由图9(a)可知:lnk和1/T呈良好的线性关系,拟合优度R2为0.99,直线斜率−E/R为−2 387.98,计算出表观活化能为19.85 kJ/mol。尽管图8(b)显示硫酸熟化符合化学反应控制方程,但表观活化能低(19.85 kJ/mol),不符合化学反应控制表观活化能大于41.8 kJ/mol 的特征,因此,硫酸熟化过程不受化学反应控制。

图8 3种动力学方程的拟合Fig.8 Fitting of three kinetic equations

图9 lnk和1/T的阿仑尼乌斯公式拟合Fig.9 Arrehenius plots for apparent activation energy
由图9(b)可知:lnk和1/T呈良好的线性关系,拟合优度R2为0.97,直线斜率−E/R为−2 489.57,计算出表观活化能为20.70 kJ/mol,符合内扩散控制表观活化能较小(8~20.9 kJ/mol)的特征[25]且如图8(c)所示,1−(1−α)2/3−2α/3与时间t的线性关系良好,硫酸熟化符合内扩散控制方程,因此,锂云母精矿的硫酸熟化过程受内扩散控制。
综上所述,锂云母精矿的硫酸熟化过程受硫酸介质经过固相产物层的固膜扩散控制,即受内扩散控制,其表观活化能为20.70 kJ/mol。因此,应从降低给料粒度、提高熟化温度、增加硫酸浓度等方面强化硫酸熟化,以提高锂、铷和铯的提取率。
4 结论
1)硫酸熟化工艺可高效地提取锂云母中锂、铷和铯,其浸出率均在96%以上。
2)锂云母精矿的硫酸熟化工艺机理如下:熟化过程中锂云母矿物与硫酸发生反应,锂云母矿相结构破坏、转化生成新物相,锂云母中Li,Rb,Cs,Al,K 和Si 组分分别转化为可溶性硫酸盐Li2SO4,RbAl(SO4)2,CsAl(SO4)2,Al(SO4)(OH)·5H2O,KAl(SO4)2以及不溶性的SiO2,水浸使可溶性硫酸盐进入浸出液,实现锂、铷和铯的共同提取。
3)锂云母精矿的硫酸熟化符合缩芯模型,反应过程受固相产物层的固膜扩散控制,其表观活化能为20.70 kJ/mol,应从降低给料粒度、提高温度、增加硫酸浓度等方面强化锂、铷和铯的提取。

