鸡源4型禽腺病毒滨州株适应细胞的筛选及培养特性的研究
魏 凤,张文通,唐 娜,王 艳,管 宇,祖立闯,王金良,苗立中*,沈志强*(.山东省滨州畜牧兽医研究院,山东 滨州 56600;.山东绿都生物科技有限公司,山东 滨州 56600)
禽腺病毒(fowl adenovirus,FAdV)是一种无囊膜的双股DNA病毒,直径大小为60~90 nm,属于腺病毒科禽腺病毒属。依据限制性内切酶消化模式与血清交叉中和试验的不同,I群禽腺病毒(FAdV-I)又分为5个亚群(A-E)、12个血清型(FAdV1-11,其中FAdV-8分为a和b两型),可以引起禽类的多种疾病,包括包涵体肝炎、心包积液综合征和鸡胃糜烂[1-2]。鸡肝炎-心包积液综合征(Hepatitis and hydropericardium syndrome,HHS)是由禽腺病毒4型引起的主要侵害肉仔鸡的一种病毒性传染病。本病首次于1987年在巴基斯坦的安卡拉地区发生[3],随后在亚洲、欧洲和南美洲等地区流行[4-5]。2015年以来该病在我国山东、江苏、河南、安徽等地广泛流行,可感染不同日龄、不同品种鸡,发病死亡情况因地区、品种而异,对3~5周龄肉鸡的致死率高达40%~100%,给我国养禽业造成了巨大的经济损失[6-9]。
目前,预防禽腺病毒病的根本措施是疫苗免疫[10]。有研究报道利用鸡胚和鸡胚原代肝细胞培养FAdV-4制备灭活全病毒油乳剂疫苗,并在临床起到了较好的保护效果[11]。但该培养方法培养的病毒滴度较低,而且培养工艺繁琐,不能满足疫苗规模化生产需要。筛选易培养、培养FAdV-4滴度高的细胞系,并对病毒培养特性进行研究,将有利于研发新型高效疫苗。本试验通过用不同的细胞进行培养FADV-4滨州株从而筛选出最适应细胞株,并对其培养特性进行研究,以克服现有病毒增殖上存在的不足,为进一步开展禽腺病毒流行病学调查及疫苗毒株的培育提供研究基础。
1 材料与方法
1.1 材料
FADV-4滨州株由笔者分离保存; Vero细胞、QT-35细胞、DF-1细胞、LMH细胞均为本实验室保存。
1.2 主要试剂和仪器
DMEM培养基购自GIBCO公司、DMEM/F-12购自GIBCO公司;新生牛血清购自天津康源生物技术有限公司、胎牛血清购自Hyclone生物工程公司;胰酶为Sigma公司产品;核酸提取试剂盒和DNA Marker DL2000购自宝生物工程(大连)有限公司。二氧化碳培养箱(MC015AC)购自山东爱博科技贸易有限公司、倒置显微镜(XDS-IB)购自重庆光电仪器有限公司、电热恒温培养箱购自黄石市恒丰医疗器械有限公司。
1.3 适应性细胞的筛选
将前期分离保存的FADV-4滨州株按1%比例分别接种长满单层的LMH细胞、Vero细胞、QT-35细胞和DF-1细胞,同时设空白细胞对照,吸附1.5 h后补加细胞维持液,37 ℃ 5% CO2培养箱中培养72~96 h,每天观察细胞,待约85%细胞出现细胞病变时收获,按此方法连续传3代(F1-F3)。
LMH细胞、Vero细胞、QT-35细胞和DF-1细胞分别按1∶3的比例传代时,细胞计数后,按1.5×105个/mL的细胞浓度,分别制备96孔细胞培养板,置37 ℃ 5% CO2培养箱中培养1 d。将其F3代培养物分别用DMEM做10倍系列稀释(10-1~10-8),接种对应的长满单层的96孔细胞板中,每个稀释度接种8个孔,0.1 mL/孔。同时设健康细胞对照。置37 ℃ 5% CO2培养箱中培养7 d,每天观察细胞病变情况。按照Reed-Muench法计算病毒含量(TCID50。)
1.4 LMH细胞的优选、克隆优化
将长满单层的LMH细胞用0.25%的胰酶进行消化分散,细胞计数后,按15×104/mL的细胞数接种于T25细胞瓶中,轻轻摇匀后,放置于37 ℃ 5% CO2培养箱中培养20 min后,弃去培养液,补加10%胎牛血清的DMEM/F12培养基,重置于37 ℃ 5% CO2培养箱中培养72 h。
将培养72 h的LMH细胞经胰酶消化、重悬后,添加15%胎牛血清的DM/F12培养基稀释成10个细胞/mL,充分混匀后,加入96孔细胞培养板中,0.1 mL/孔,置37 ℃ 5% CO2培养箱中培养2~4 d,更换新配制的15%胎牛血清的DM/F12培养基,0.2 mL生长液/孔,继续培养2~4 d,待细胞长满单层后,选取单个细胞状态良好的细胞,进行消化,计数。重复上述步骤,进行LMH细胞的克隆纯化,直到获得无细胞内杂质、透亮、轮廓清晰的细胞,液氮冻存一部分。同时进行传代培养,待细胞能稳定传代后,进行培养条件的优化,将培养基换成普通的DMEM,血清换成7%新生牛血清,同时添加0.5%鸡血清,在恒温电热培养箱中培养。
1.5 病毒培养条件的优化
1.5.1 不同接毒剂量对TCID50的影响 将克隆优化后的LMH细胞按常规方法进行传代培养,按3×105/mL的细胞密度,制备出11瓶LMH细胞(T25)。待细胞长满单层后,按不同接毒量接种病毒。共分5组,每组两瓶。分别按1/100、 1/200、 1/400、 1/800、 1/1000接种病毒。同时设1瓶空白细胞对照。接种病毒后的细胞和对照细胞均放置于37 ℃培养箱中培养。每天观察细胞病变,当每瓶细胞有85%发生细胞病变时,收获病毒液,置于-80 ℃冰箱中冻融3次。按此方法连续传3代后,测定病毒含量,按照Reed-Muench法计算TCID50。分别计算每瓶毒液的TCID50,算出平均值,数据取lg值,用Excel软件制图。
1.5.2 不同吸附时间对TCID50的影响 将克隆优化后的LMH细胞按常规方法进行传代培养,按3×105/mL的细胞密度,制备出11瓶LMH细胞(T25)。待细胞长满单层后,按1/1000接毒量接种病毒,分别置于37 ℃培养箱中吸附0 h、0.5 h、1 h、1.5 h、2 h,然后加入含2%新生牛血清的DMEM维持液。同时设1瓶空白细胞对照。接种病毒后的细胞和对照细胞均放置于37 ℃培养箱中培养。每天观察细胞病变,当每瓶细胞有85%发生细胞病变时,收获病毒液,置于-80 ℃冰箱中冻融3次。按此方法连续传3代后,测定TCID50,方法同1.5.1。
1.5.3 不同收获时间对病毒含量的影响 将克隆优化后的LMH细胞按常规方法进行克隆传代,按3×105/mL的细胞密度,制备出7瓶LMH细胞(T25)。待细胞长满单层后,按1/1000接毒量接种病毒,分别置于37 ℃培养箱中吸附1 h,然后加入含2%新生牛血清的DMEM维持液。同时设1瓶空白细胞对照。接种病毒后的细胞和对照细胞均放置于37 ℃培养箱中培养。当培养至24 h、36 h、48 h时分别收获2瓶接毒细胞,放置于-80 ℃冰柜冻融3次。按此方法连续传3代后,测定TCID50,方法同1.5.1。
2 结果与分析
2.1 适应性细胞的筛选结果
FADV-4滨州株接种DF-1细胞盲传三代无细胞病变可见,在LMH细胞、Vero细胞、QT-35细胞上均能看到明显的细胞病变,其中在LMH细胞上接种24 h就有约60%的细胞出现细胞病变,36 h约有80%细胞出现细胞病变,病变特征主要表现为:细胞变圆、聚集成不规则葡萄串状,细胞间隙增大。在Vero细胞和QT-35细胞上细胞病变出现的慢,培养48 h时约有50%细胞出现细胞病变,其病变特征为:细胞聚集、融合成合胞体(图1)。在LMH、Vero和QT-35细胞上培养三代的病毒含量分别为107. 5TCID50/0.1 mL、104.875TCID50/0.1 mL、106. 25TCID50/0.1 mL(表1)。根据在不同细胞上培养时产生病变的时间、病变特征及病毒含量,确定LMH细胞为该毒株的最适宿主细胞。

表1 病毒适应性培养观察及TCID50测定结果Table 1 Observation of virus adaptive culture and determination of TCD50
2.2 LMH细胞的克隆优化结果
根据前面的试验结果,LMH细胞较适宜该分离毒株的培养。但LMH细胞不易培养,优化前需用专用培养基加胎牛血清、置5% CO2培养箱培养。经过克隆、优化培养后获得了无细胞内杂质、透亮、轮廓清晰的细胞,细胞的生长速度和细胞密度都较优化前有所提高,培养条件只需用DMEM培养基加新生牛血清、置恒温电热培养箱即可。
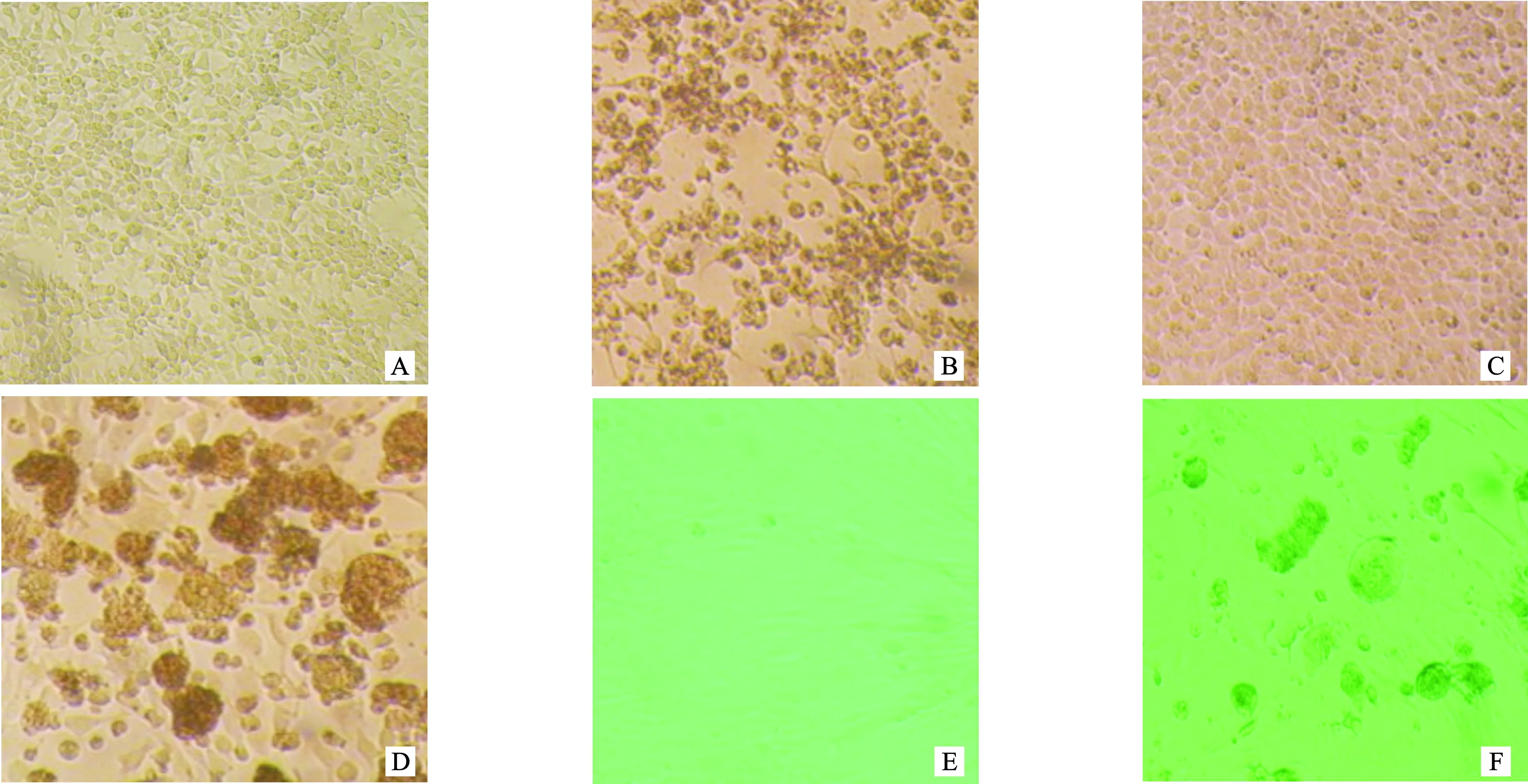
图1 分离毒株在接种LMH细胞、Vero细胞、QT35细胞48h 细胞病变情况(100×) A.正常的LMH细胞;B.病毒感染的LMH细胞;C.正常的Vero细胞;D.病毒感染的Vero细胞; E.正常的QT35细胞;F.病毒感染的QT35细胞Fig. 1 Cytopathic condition of isolated virus strains inoculated with LMH cells, Vero cells and QT35 cells at 48h (100X) A. Normal LMH cells; B. Virus-infected LMH cells; C. Normal Vero cells; D. Virus-infected Vero cells; E. Normal QT35 cells; F. Virus-infected QT35 cells
2.3 FADV-4滨州株在LMH细胞上培养条件优化
2.3.1 不同接毒剂量对TCID50的影响结果 分别按接毒量为1/100、1/200、1/400、1/800、1/1000接种LMH细胞,于接毒后细胞病变达到约85%时收获病毒液,测定TCID50。结果表明,最佳接毒量为1/1000(图2)。
2.3.2 不同吸附时间对TCID50的影响结果 接种病毒后吸附1 h组的平均病毒含量可达108.125TCID50/0.1 mL。接毒后吸附0 h、0.5 h、1.5 h、2 h组的平均病毒含量均低于吸附1 h组的平均病毒含量,所以接毒后最佳吸附时间为1 h(见图2)。
2.3.3 不同收获时间对TCID50的影响结果 当接种后36 h收获时病毒的毒价最高,平均值达到108.27/0.1 mL。24 h和48 h收获时病毒毒价均低于36 h收获时病毒毒价,由此确定该分离毒株的最佳收获时间为接种后36 h(见图2)。
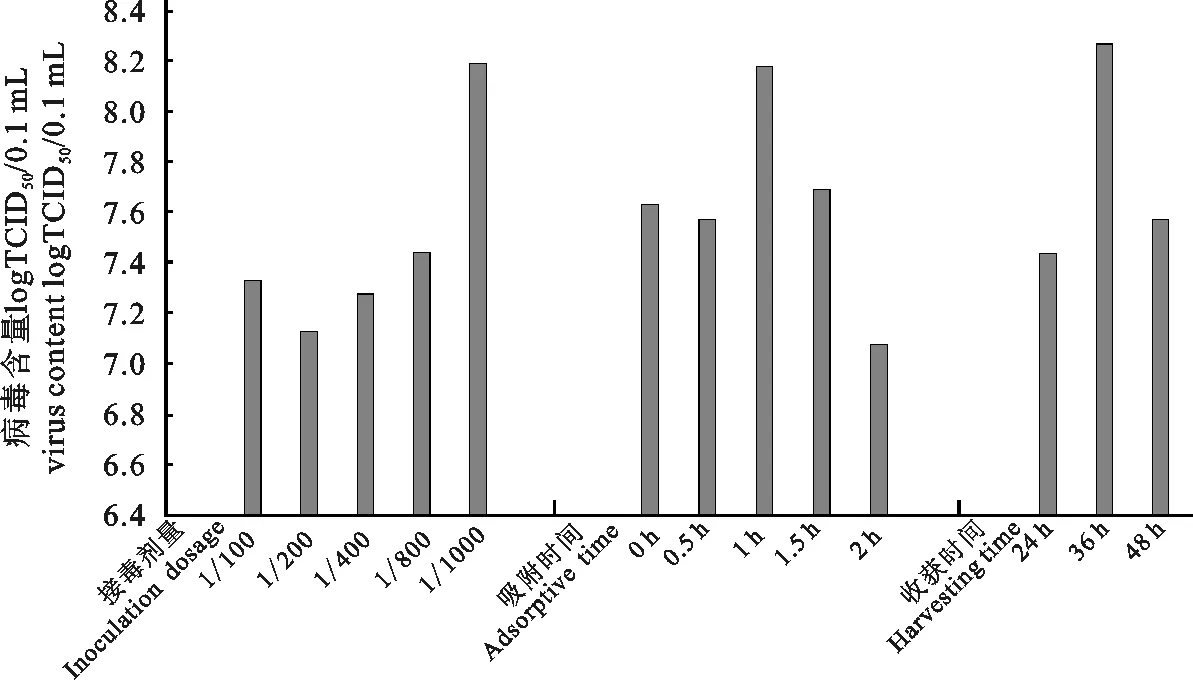
图2 培养条件优化结果Fig.2 Optimization of culture conditions
3 讨 论
一直以来,如何快速、高效的增殖病毒是疫苗研发生产中必须考虑的基本问题之一。由于传统方式不能满足需求,利用各类细胞增殖病毒成为疫苗研究者们关注的领域。细胞系生产疫苗具有生产成本低、操作简单、对免疫动物机体副反应小等特点,最重要的是能克服SPF鸡胚存在的缺点,避免了鸡源性潜在疾病的感染。FAdV-I一般不感染异种动物,在其相应的细胞中生存繁殖不佳,因此采用禽源的细胞来培养本病毒效果最好,如鸡胚或是雏鸡肾细胞、鸡胚或是雏鸡肝细胞或者鸡胚等。病毒感染的细胞一般会表现出明显的细胞病变:细胞变圆成葡萄状、折光性变强,最后细胞脱落[12]。本试验选取了DF-1细胞、LMH细胞、Vero细胞、QT-35细胞培养FADV-4滨州株,结果发现该毒株在DF-1细胞上盲传三代无细胞病变可见,在LMH细胞、Vero细胞、QT-35细胞上均能看到明显的细胞病变。通过传代培养、CPE观察及病毒含量测定,最终筛选出CPE明显,病毒含量高的病毒适应性细胞-LMH细胞。LMH细胞作为永生化细胞系,是通过化学药物诱导正常细胞而建立的细胞系,不含任何外源病毒和致瘤基因,可以无限传代,作为灭活疫苗的生产是安全的[13]。
本研究通过对LMH细胞进行克隆筛选及病毒培养特性研究,结果证明了鸡源禽腺病毒可在LMH细胞上有效增殖并形成腺病毒特征性细胞病变,病毒含量最高可达到108.375TCID50/0.1 mL赵蕾等[14]研究证明FADV DC株在LMH细胞上增殖时,病毒含量可达107.5TCID50/0.1 mL。这与本实验的结果相似。LMH细胞系属于肝上皮细胞,而腺病毒倾向于感染上皮细胞,这可能与上皮细胞表达较高水平病毒受体有关。由于不同的毒株对不同的细胞感染能力不一样,所以在具体实验中需要摸索病毒的最佳增殖条件。
4 结 论
本研究通过克隆筛选、优化培养,获得一株易培养的LMH细胞,并且该细胞最适宜鸡源4性禽腺病毒滨州株的培养,建立了禽腺病毒4型的细胞培养模型。该毒株的最佳增殖条件为:最佳接毒量为1/1000、接毒后最佳吸附时间为1 h、收毒时间为接毒后36 h。该研究为鸡源禽腺病毒的分离、疫苗研究及疾病防控提供参考。

