微流控制备纳米药物载体的研究进展
许瑞呈,叶思远,尤蓉蓉,吕松伟,招秀伯
(常州大学 制药与生命科学学院 护理学院,江苏 常州 213000)
0 引 言
近年来,纳米材料在生物医学方面的应用引起广泛关注[1],纳米结构因其尺寸小、孔隙大、机械强度高以及良好的生物相容性等诸多优点,可以提高生物利用度、控制药物释放、减少药物使用剂量以及降低副作用[2]。在药物递送系统中显示出巨大的使用前景。传统的制备纳米材料的技术所制备纳米材料可能会氧化结块,而且在合成规模扩大的过程中,工艺本身就可能会受到混合、成核和生长等限制。因此,有必要采用替代的合成方法,来获得尺寸和形态可控的、稳定的、可重复的单分散粒子。近几十年来,许多研究小组利用微流控这一技术,以及从无机到聚合物等各种材料,制备了尺度从纳米到微米的颗粒。该技术因其能够精确控制流体流动和反应条件而备受关注,即使在放大的过程中也能实现精确的生长控制,同时还能最大限度地减少副产品的产生。
微流体学起源于20世纪90年代,最初是一门应用于分析化学领域的学科[3]。但随着微流体技术的不断发展以及相关设备的创新,现如今微流控学在材料学、生物学以及化学工业等诸多领域都有应用,例如,制造新型功能材料(如纳米纤维、脂质体)[4],细胞分离和分类[5]以及高通量筛选等。微流体法制备的纳米颗粒具有粒径尺寸可控、分散性好等优点,广泛应用于纳米材料的合成,如纳米金属材料、氧化物颗粒和金属有机骨架。
本文将从微流控芯片、微通道系统、药物输送纳米材料的制备等方面进行简要介绍。
1 微流控技术的概述
1.1 微流控芯片
微流控芯片,又称为芯片实验室(lab on a chip)[6],是微流体研究的重要载体和技术平台。生化分析技术中的样品合成、分离检测和细胞培养、筛选等基本操作都可以在微流控芯片上实现。与传统技术平台相比,微流控芯片面积小,只有几平方厘米(cm2)或更小,因此实验所需试剂大大减少,反应分析时间相应缩短[7]。微流控技术涉及科学领域广,是生物学、微机电学和化学等领域的近几年的研究重点。
1.2 微流控芯片制备材料
迄今为止,通常有以下五种材料用来制作微流控芯片:晶硅、聚二甲基硅氧烷(polydimethylsiloxane)[8]、玻璃[9]、石英和塑料。其中,以晶硅体、聚二甲基硅氧烷和玻璃最为常用,以下对这三种材料进行详细的介绍。
晶体硅:材料的机械强度大、纯度高、耐腐蚀且有着良好的散热性。生产工艺和微细加工技术相对而言较为成熟等优点,但是其绝缘性和透光性能差,进行深度刻蚀比较困难,而且表面化学行为复杂,硅基片的粘合率低,上述缺陷极大地限制了其在微流控芯片中的广泛应用。
聚二甲基硅氧烷:制备方便快捷,材料成本低,化学惰性好,同时聚二甲基硅氧烷具有良好的透光性和生物相容性,能在室温下直接与多种材料接合。另外聚二甲基硅氧烷的结构弹性高,这些特点使其成为一种广泛应用于芯片制作的聚合材料,但是它的软化温度点低,键合力弱,会导致其通道耐压相对而言较弱一些[10]。
用得最多的材料是玻璃,其价格便宜,有着良好的电渗性和透光性,且表面反应性佳,易浸润,玻璃可以通过光刻技术和蚀刻技术将微通道网络复制在表面。与晶体硅一样,深度蚀刻困难,而且键合温度较高会导致键合率降低。
2 基于微流控技术的微通道系统
微流控技术可以实现微尺度流体的精确控制,是从最初的微量分析化学平台向高通道药物筛选、微混合、微反应以及微分离的领域发展,作为一种崭新材料的制备技术平台,如今已经在功能性材料的制备上展现出比传统技术更加突出的优势。
微流控制备材料通常是基于其微通道实现的。最近几年,研究微流控学的国内外研究人员,为方便各种功能材料的制备,设计制作了具有多种结构功能的微通道系统。这些不同结构的微通道的问世,使微流控技术的前景在不同的科学领域得到更为广泛的发展。
目前,用于药物载体制备的微通道系统主要有以三种方式,如图1所示。第一种,共轴流法;第二种,T型通道(正交结构)方式;第三种,流动汇聚型。
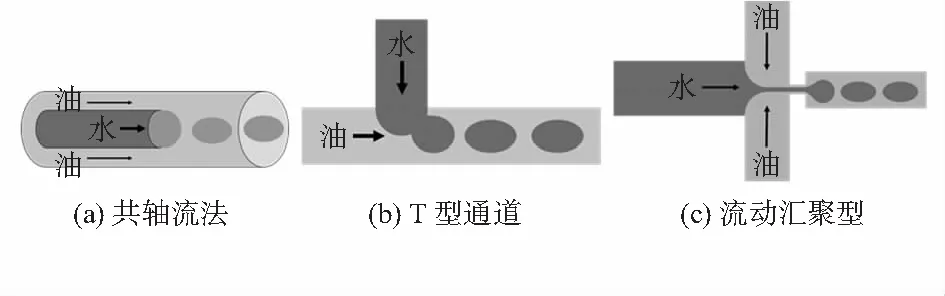
图1 三种微通道结构示意
2.1 共轴流法
共轴流(Co-flow)法形成液滴的机理,是将圆形毛细管的一端用拉针仪拉成锥形并置于另一根圆形的毛细管之中,里面圆形毛细管的内径与外面圆形毛细管的外径是相等的。向圆形毛细管方形毛细管分别通入平行流动的分散相及连续相,并在某一相中加入表面活性剂,在尖端剪切力的作用下从而形成液滴。通过共轴流法所生成的微液滴半径的计算公式为2R=(6v·Tn/n)。式中R为微液滴半径,v为分散相的流速,Tn为液滴产生的周期。
这类通道是最基本、最简单的通道。因此,许多学者根据自己的需要,在其基础上自行设计制造了各种结构,用于制备各种不同形式的产品,如在毛细管内再加两根尖端相对的细毛细管,分别向毛细管内外通入不同的表面活性剂溶液,受剪切力的作用形成实验所需要的液滴层数。
2.2 T型通道
传统乳化和微型化是T型通道(T-junction)法生产液滴的方法,以剪切力与液滴前后压力差导致液滴生成。在T型微通道中,分散相通入垂直的入口,另一个入口通入连续相。于两相界面处,界面张力无法维持连续相对分散相施加的剪切力,在连续相剪切力的作用下,使部分分散相脱离,形成小液滴。当两相流速一定时,液滴的生成将逐渐趋于稳定。由于其便于制作和操纵,广泛应用于对微液滴均匀性要求不高的场合,而且该法产生的液滴可控范围相对较小。其中Y型通道是T型通道的一种变异形式,与T型通道相比,其剪切作用力较弱,若要获得相同尺寸的液滴,需要更大的连续相流速和流量,因此,T型通道使用的场景范围要远大于Y型通道。
2.3 流动聚焦法
不同于共轴流法,流动聚焦(flow focusing)法主要是将不同通道内的连续相和分散相流体聚焦于一个通道内,外围流路流入连续相,两个连续相的中间流进分散相,对称的连续相剪切力将分散相夹断形成液滴。与 T型通道相比,流动聚焦法更容易控制液滴,形成的液滴也更加稳定,生成的液滴具有更大的体积范围,因此其适用范围比 T型通道更广,与T 通道相结合可以制备更复杂的粒子。
3 微流控制备纳米药物载体
近年来,随着科学技术的迅猛发展,纳米材料以其独特的尺寸、结构和性能,在微电子、光电子、感测器件、能源、药物输送以及生物工程等领域显示了广阔的应用前景。用纳米材料做药物载体,可改善许多药物溶解度低、稳定性差以及生物分布不均匀的问题[11]。由于纳米材料药物载体的物化性质取决于其尺寸、形状以及晶体结构,因此,合成的过程中需要对动力学和热力学反应进行精确的控制。故而,微反应器在纳米材料合成中的作用主要体现在三个方面:1)尺寸、形状和结构合成的可控性;2)可通过连续流工艺进行放大;3)高通量。目前以微流控技术制备的药物载体纳米材料主要有:聚合物纳米材料[12]、无机纳米材料[13]、脂质体纳米材料[14]、杂化纳米材料[15]等。
3.1 聚合物纳米材料
聚合物纳米材料是一种固体胶态颗粒,由天然或合成聚合物材料制成,广泛用于药物输送。根据研究需要,微流控技术可控制聚合物纳米颗粒的溶剂混合时间和粒径尺寸大小。Han X W等人[12]利用液滴微流控技术与物理交联相结合,制备了大量均匀的、单分散的聚乙烯醇(PVA)微球,该微球尺寸可通过改变两相流体的注入流量和微流道宽度来控制。物理交联法制备 PVA微球,效率高,且微球具有良好的单分散性,工艺无需添加化学交联剂,避免了对包合物材料的干扰,适用于药物载体等领域。2017年,Tran T T等人[16]以姜黄素(CUR)和壳聚糖(CHI)作为药物和多糖的模型,开发了具有高尺寸可调性的连续微流控药物纳米复合物合成平台。
3.2 无机纳米材料
通过生物功能化作用,无机纳米材料具有良好的生物相容性,因此在生物医学领域得到越来越广泛的应用。无机纳米材料也可与如诊断、治疗、生物感应、组织工程这些生物医学相关的功能相结合。无机纳米颗粒在合成过程中,前驱体浓度、反应温度以及表面活性剂的性质和原子核停留时间都能够决定纳米粒径[17]。微流控流动聚焦法通过精确控制混合时间、反应温度和停留时间,实现了快速成核,从而可以制备出尺寸均匀性好的无机纳米粒子。
Roberts D S等人[17]借助微流控设备制备出粒径在150~350 nm的多孔硅纳米颗粒,其收率高达57 %,与传统超声波和球磨法相比,收率提高了2.4倍,均匀度提高了1.8倍,反应时间则缩短了36倍。Sen N等人[18]报道了一种基于液—液两相的分段微流体系统用于合成BaSO4纳米粒子(如图2所示),该系统可以连续运行且不会堵塞。通过对初始浓度、摩尔比和流速等不同操作参数的研究,发现上述参数对纳米颗粒合成的尺寸精度和可控性有很大影响,在最佳条件下,该系统可连续合成粒径65 nm、多分散指数0.10的BaSO4纳米颗粒。

图2 BaSO4纳米颗粒制备实验装置示意
3.3 脂质体纳米材料
脂质体是磷脂囊泡,在20世纪60年代由Bangham及其同事发现。脂质体是由脂质双分子层组成,其纳米颗粒具有中空结构,可作为药物载体,提高药物的疗效[19]。制备脂质纳米颗粒的传统方法有很多[20],例如,pH梯度法、超声波分散法及冷冻干燥法等,这些方法繁琐,操作困难,制得的脂质体分散性低,稳定性差。
Hong S C等人[21]基于流体动力学聚焦原理,利用二棕榈酰磷脂酰胆碱作为构建基,通过微流体组装技术,成功制备出单分散的200 nm儿茶素和姜黄素双重负载脂质体。本方案提出了双活性组分包封提高生物利用度的可行性。Maeki M等人[22]用即触即用法制备脂质纳米颗粒。先用微流控设备在玻璃基底上形成脂质双层膜,后向微流控装置中引入浓缩的 DNA核,并与脂质膜表面接触,包覆在双层脂质膜上形成脂质纳米颗粒。Hood R R等人[23]使用可产生3D流动聚焦流的玻璃多毛细管阵列微流控装置,制备出粒径更窄的小尺寸脂质纳米颗粒。
3.4 杂化纳米复合材料
杂化纳米复合材料是指由两种或两种以上的材料或组分组成的复合材料或杂化材料,其中至少含有一种纳米(nm)级别的材料或组分[24]。在药物递送的研究中,具有复杂多组分结构的杂化粒子往往具有更多的功能,如靶向性、联合递送、降低毒性等。但是粒子结构复杂化则其制备工艺也会变得更为复杂,可控性降低,重复性差,难以保证粒子结构的单一性。
2015年,Bag P P等人[25]利用连续微流控设备,通过液相热注入的方法合成了CdSe、CdS和CdSeS(合金)量子点,在CdSe或CdSeS的情况下,通过一个单一步骤的反应,ZnS或CdS外壳就能获得高达60 %的量子产率。紧接着,2016年,Ortiz de Solorzano I等人[26]利用微流体平台连续合成了可生物降解的光热硫化铜纳米颗粒。金属—有机框架(MOF)是一种新型有机—无机杂化纳米晶体材料,其具有开放性框架结构和高孔隙率,可用于储氢[27,28]、药物输送、磁共振成像造影剂[25,29]及催化[30,31]等方面。MOF的传统制备方法耗时长、需要特殊的装置。因此,Faustini M等人[15]提出了一种基于液滴的微流体合成 MOF的方案(如图3所示),成功地合成了典型的MOF—5、IRMOF—3、UiO—66等杂化结构。这种制备方法可以连续、快速地合成 MOF,并且可以在商业和工业上制备 MOF。
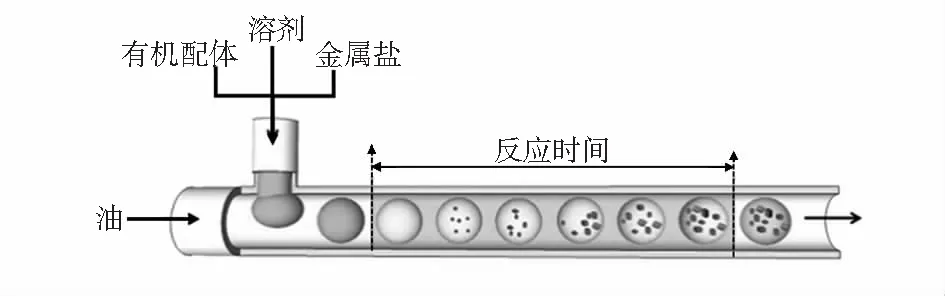
图3 微化过程的示意
4 结束语
微流控样品消耗低、性能高、操作简单等优点,微芯片反应器在合成纳米材料的应用中日益广泛,微流控合成纳米材料解决了传统间歇合成中难以获得质量均一,粒径分布可控的难题,为纳米材料的合成开辟了新的方向,也使纳米药物输送系统具有了更为广阔的发展前景。
对于纳米材料制备和操作的微流控技术的未来发展,将有更多的研究集中在几个问题上:
1)单、多相过程(包括微流控器件中的连续后处理)中的流动行为和质量以及热传递的基本原理尚待进一步研究。此外,还应建立不同操作环境下纳米材料加工过程与相态关系的理论基础(如转移与分散过程的规律、分布行为等)。
2)集成微化学系统进行可控制备颗粒将成为该领域的一个重要课题。微化系统可定义为由一个或多个微设备控制传输和反应过程的系统,此类系统可包括一个微设备、多个微设备或带有传统设备的微设备,但由于该领域的知识有限,设计和构建集成微化系统面临一些挑战。
3)尽管液滴和液塞是在传统的和新型的微流控平台上实现并行化的,但新材料的批量生产仍是一个难题。只有达到每天生产千克(kg)级的产品,微流控平台的优势才有意义。规模战略需要进一步发展,才能实现纳米颗粒的工业化应用规模。在工业应用中,微器件系统所面临的堵漏、长周期稳定性和维护技术等工程问题,应该成为微流控技术下一个需要解决的主要问题。

