突发传染病相关临床研究伦理审查突出问题的总结与反思*
——基于文献综述的分析
陈海萍,祖恩晴,唐 燕,杨红荣,奚益群,周 萍**
(1 上海交通大学附属儿童医院/上海市儿童医院伦理委员会,上海 200062,chenhaiping@shchildren.com.cn;2 复旦大学公共卫生学院,上海 200032)
突发传染病事件通常伴随着其预防诊治科学性的不确定、社会和机构的混乱、焦虑或恐慌的情绪、信心和信任降低的氛围,给相关临床研究的伦理审查和管理带来了挑战。在突发传染病疫情面前,如何进行应急需求的伦理审查,在响应公共卫生紧急需要的同时,遵守伦理原则、符合伦理规范,以确保患者安全与权益是亟待解决的议题。
笔者通过文献综述的方式,梳理疫情期间进行突发传染病相关临床研究主要存在的伦理问题与挑战,并从伦理审查实际工作需求的角度探讨建立突发传染病相关临床研究伦理审查特殊规范的必要性。
1 研究方法
1.1 检索策略
笔者通过在中国知网上搜索“新型冠状病毒肺炎”“新冠肺炎”“突发传染病”“突发公共卫生事件”“临床研究”“伦理”“伦理审查”得到关于我国突发传染病相关临床研究伦理审查的文献共25篇,对文献进行筛选最终保留了19篇相关文献。
1.2 信息提取与整理
运用边际归纳法,对纳入文献中所提到的突发传染病相关临床研究以及其伦理审查中存在的问题进行摘录、标记与归纳,如第一篇文章中提到N个问题,第二篇文章提及的相同问题,则在对应问题下计数+1,新增的问题则额外摘录添加,如此对纳入的19篇文献中提及所有问题进行摘录与计数,并将同类问题加以归纳。同时,针对文献分析发现的问题,从伦理审查实际工作需求的角度进一步归纳如何规范突发传染病相关临床研究伦理审查特殊要求。
2 结果
2.1 纳入文献中所提及的伦理审查相关问题梳理
结果显示,19篇纳入的文献中,提及的问题按照提及率(即提及篇数占总篇数的比重)由高到低依次是:临床研究的安全性(16篇,84.21%),知情同意及隐私保护(15篇,78.95%)、临床研究设计的合理合法性(14篇,73.68%)、临床研究重要资源的分配(13篇,68.42%)、伦理审查的方式(11篇,占比57.89%)、伦理审查的效率(8篇,42.11%)、研究结果的披露(8篇,42.11%)、临床研究的公平性(6篇,31.58%)和伦理审查的能力(5篇,26.32%)(见表1)。
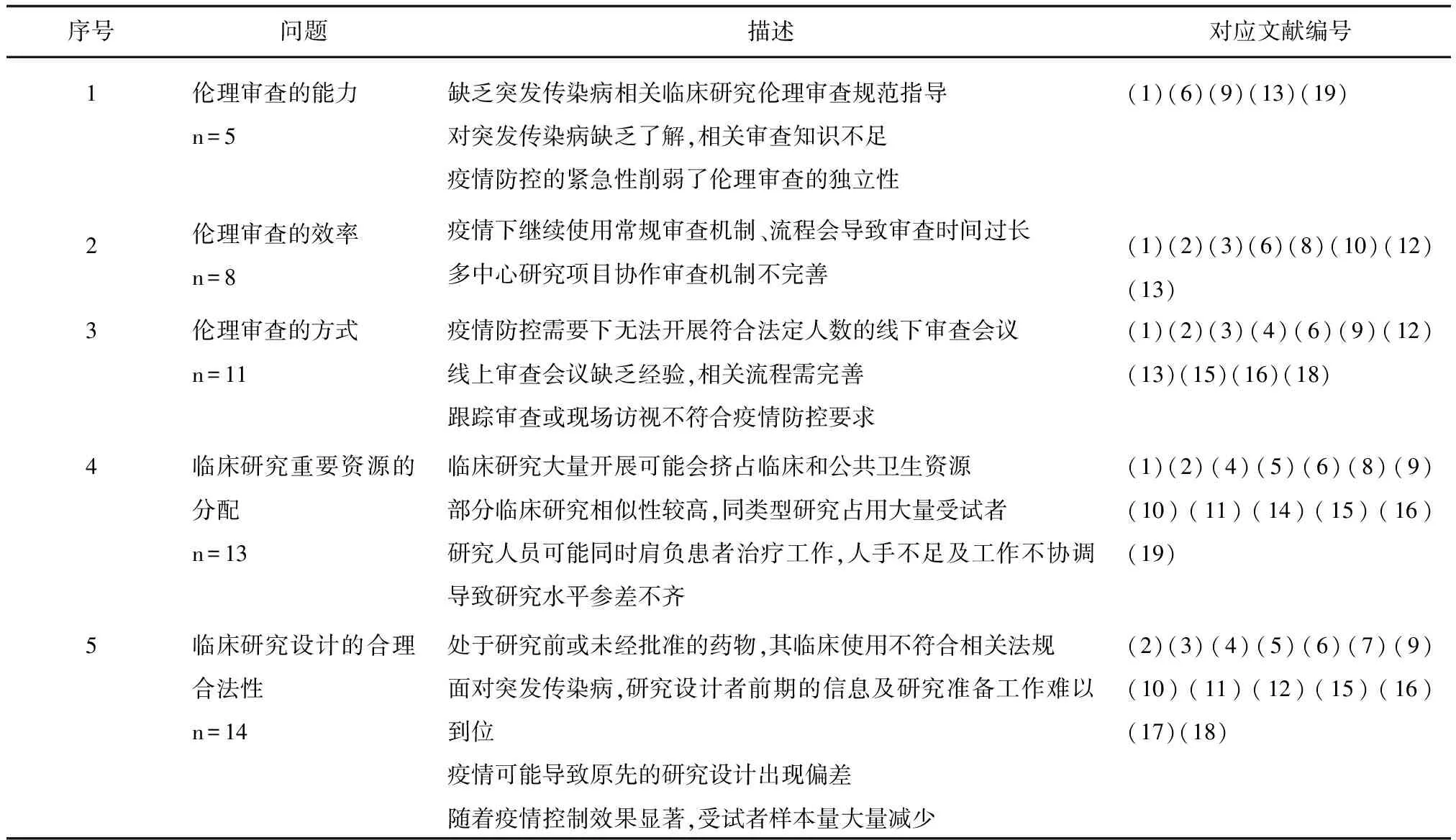
表1 突发传染病相关临床研究伦理审查问题汇总
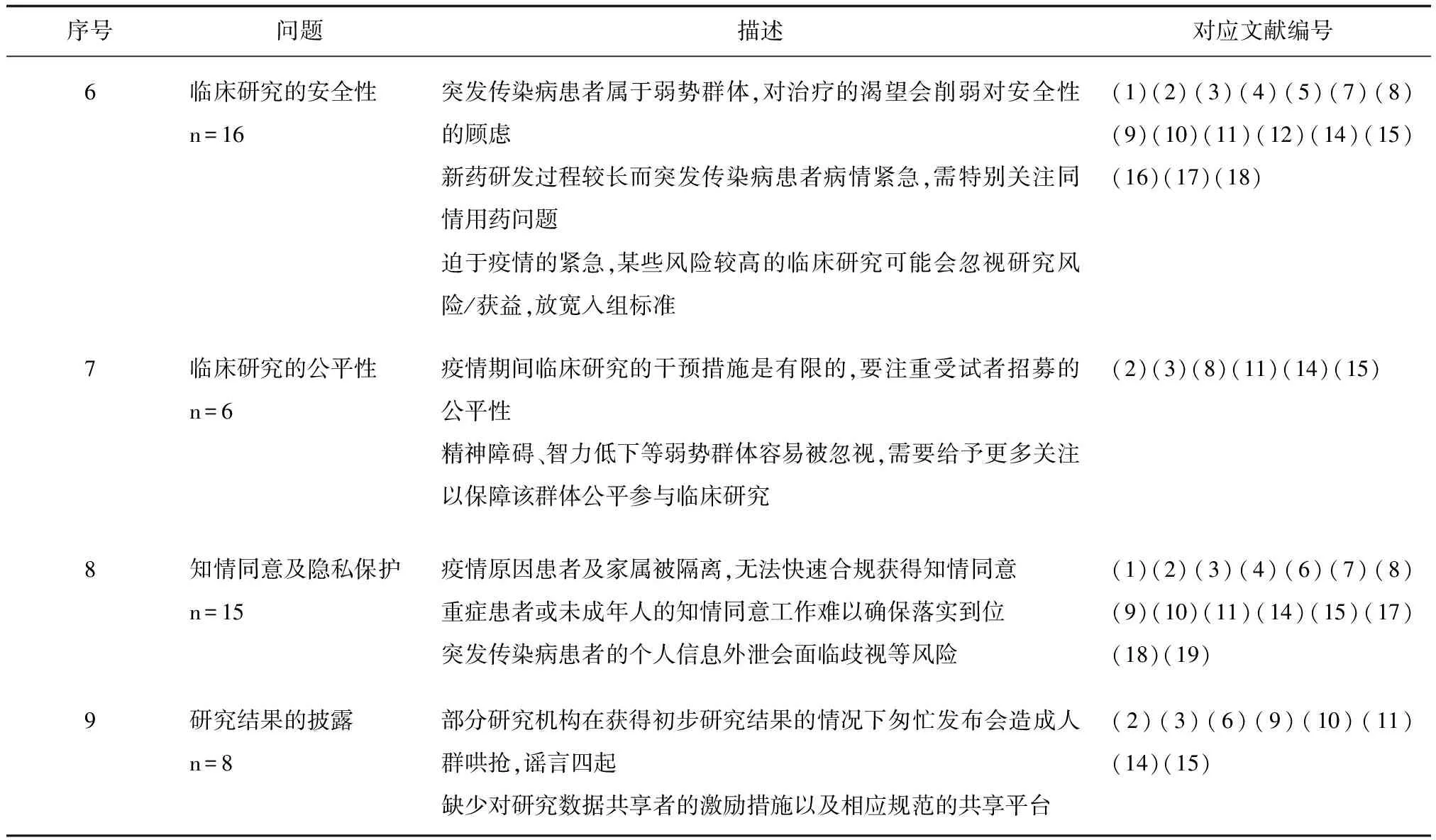
续表
2.2 突发传染病相关临床研究伦理审查特殊规范所应针对的需求面
以伦理审查实际工作需求为着力点,结合文献梳理,提示需要从临床研究管理、伦理委员会管理与伦理审查过程管理三个方面研究突发传染病相关临床研究伦理审查的特殊规范需求(见表2)。

表2 建立或完善突发传染病相关临床研究伦理审查及管理的规范需求
3 讨论
在公共卫生应急情境下,时间的紧迫性、传染性疾病的不确定性、临床和研究资源的有限性等问题都对此时的临床研究伦理审查带来诸多挑战。
3.1 临床研究的安全性
突发传染病相关临床研究伦理审查文献分析显示,84.21%的文献关注于临床研究的安全性[1-16],新的突发传染病研究需积极做好安全隐患的控制,其安全性把握难点在于:①疾病因素方面,不同于普通疾病,突发传染病相关临床研究还面临着疾病在人群中传播的风险,同时威胁受试人群和研究人员;②患者因素方面,患者对获得更好治疗方法的渴望使其对临床研究可能存在的安全风险有所忽视;③临床诊疗因素方面,因突发传染病在预防和临床诊治中尚未建立有效的诊疗规范或可及的诊治措施,部分创新性较强、风险较大的临床研究项目有可能为了达到实施研究的样本量而存在放宽入组标准的情况[7-9]。治疗新发传染病的药物研究往往耗时较长,在无有效治疗手段的情况下将处于临床研究阶段的药物用于急需的患者,即同情用药,但它亦可能带来较大安全隐患。因此,建议在伦理审查管理中,完善突发传染病临床研究安全性相关的伦理审查要点,如在临床研究进行前充分衡量风险获益比[1-4],通过构建风险获益比评估体系,利用疾病因素(疾病传播方式、速度、对人类的危害程度等)、患者因素(患病严重程度、健康状况、经济状况等)、临床诊疗因素(诊疗干预手段、有创性程度、疗效、预后等)综合评估判定,保护受试者的安全和权益,此外,还需保障研究人员的安全,避免职业暴露的发生。
3.2 知情同意及隐私保护的挑战
突发传染病相关临床研究伦理审查文献分析显示,78.95%的文献关注于临床研究的知情同意和隐私保护[1-4,6-10,12-13,15-18],根据国家《涉及人的生物医药研究伦理审查办法》:研究者开展研究,应当获得受试者自愿签署的知情同意书;当受试者本人无法出具书面同意书,也无法口头传达知情同意时,应当取得其法定监护人的书面知情同意。突发传染病相关临床研究的知情同意和隐私保护实施的难点在于:①研究受试者因素方面,突发传染病情况下受试者处于隔离状态且部分危重型受试者可能已丧失自主知情同意能力,而其家属作为密切接触人也要接受隔离观察,再加上社区封闭、交通管制等因素,获取知情同意障碍重重;②疾病因素方面:传染病的性质使得传染病患者容易遭受异样的眼光甚至歧视,临床研究中收集到的受试者姓名、地址、联系方式、诊断结果等个人信息一旦被泄露,很可能会对患者造成二次伤害。但某些情况下出于对公众健康的负责以及共享传染病研究成果的需要,如何在保护受试者隐私的前提下,经由伦理委员会、相关医疗卫生机构和相关部门等协调,研究快速合规的获取知情同意新方式[5],有重要的现实意义。因此,建议在伦理审查管理中,完善突发传染病临床研究知情同意及隐私保护相关的伦理审查要点[6-10],如突发传染病事件中考虑受试者和适应证的特殊性以及患者亲自签署知情同意书的可行性,必要时采用替代性的知情同意手段,如电子知情同意等,经由伦理委员会审查其方案的可行性,并在必要时开展现场访视,保证研究充分地进行知情同意。对于隐私保护方面,伦理委员会应着重于审查信息采集、储存和传输,信息使用和删除等方面是否严格遵守相关规定和非必须不公开原则,是否存在未经受试者授权泄漏信息报告给非法定的第三方等情况。
3.3 临床研究设计的合理合法性
突发传染病相关临床研究伦理审查文献分析显示,73.68%的文献关注于临床研究设计的合理合法性[2-6,8-11,13-17]。处置突发传染病事件期间,临床研究不能因为紧迫性而忽视科学性。疫情暴发后,虽然研究者组织项目组人员讯速投入临床研究工作中,但对于新发突发传染病的病因、病理等并不明确,因而很难准确判断疫情的变化,无法预知接下来病毒是否会发生变异、其毒力以及传染力是增强还是削弱,这对临床研究的设计以及实施都是巨大挑战。如研究方案设计方面:即使研究团队制定了较为合理的研究设计,疫情的不确定性也会导致原有计划出现偏差甚至终止[5,17];同时,随着国家强有力防控措施的实施,传染病患者人数急剧减少,研究也会面临受试者样本量不足的情况。干预措施实施方面:新的突发传染病在预防和临床诊治中尚未建立有效的诊疗规范或可及的诊治措施,纳入患者作为受试者需要非常慎重。某些研究涉及的药物属于新药或者是未经批准新用途的老药,其是否合法合规值得考量[10-11]。因此,建议在伦理审查管理中,完善对突发传染病相关临床研究合理合法性的审查力度,加强对临床研究设计合理合法性的评估比重[2-4],包括研究方案科学性(研究设计与方法的科学性、可行性,前期类似研究基础和研究数据等);研究团队结构(是否包含专业统计学人员进行样本量等估算,纳入、排除和退出标准的规范性等);施予干预措施情况(药品或有创性诊疗技术的合规性、诊疗疗效的评价指标及评价标准等)等评估内容。
3.4 临床研究重要资源分配
突发传染病相关临床研究伦理审查文献分析显示,68.42%的文献关注于临床研究的重要资源分配[1-2,4-5,7-10,12-14,17-18]。突发传染病情况下,有限临床研究资源的优化分配及使用是难点问题,传染病的暴发可能短期内急速消耗当地医疗卫生资源,医务人员全力以赴投入疫情防控中,而临床研究需要研究人员有充分的时间、精力投入以确保受试者的安全,医疗资源的相对不足、应急响应紧迫需要与突发传染病临床研究的要求存在着冲突。另外,在国家公共卫生体系采取有效措施控制疾病传播和国家医疗卫生系统全力救治下,疾病传播可能很快得到有效控制、患者人数快速下降,客观上导致临床研究的开展会面临受试者人数不足情况。因此,建议相关主管部门进一步健全关于突发传染病相关临床研究伦理审查及管理的工作指南或特殊规范,如重大突发传染病事件的临床研究信息上报制度[4-5,18],通过专门的突发传染病临床研究监测数据共享平台,高效合规共享临床研究信息资源;重大传染病暴发期间设立国家或省市级层面相关临床研究项目申报审查统筹机制[1-2],控制同一类型临床研究的重复开展率,按临床研究的重要程度,筛选优先研究的防治方案。
3.5 伦理审查方式和效率
突发传染病相关临床研究伦理审查文献分析显示,57.89%的文献关注于伦理审查方式[1-4,8,11,13-14,16-17],42.11%的文献关注于伦理审查效率[1-3,7,9,11,17,19]。在伦理审查实际工作中,面对新发突发传染病情况,相应的临床研究项目不断增加,人员、财力、物力的紧缺及隔离防控、交通管制等状况,给常规医学研究伦理审查过程、伦理委员会及相关临床研究伦理审查带来挑战。伦理审查方式方面:①由于疫情防控需要,线下审查会议难以正常开展,而线上审查作为新的方法,也给伦理委员会的审查组织管理工作提出了新要求;②多中心研究项目协作审查机制不完善,不同地区、不同层级的机构间临床研究能力和管理要求存在差异,多中心传染病临床研究的实施存在如何控制质量的难题[11,14]。如临床研究资质要求,与疫情防控相关的科研攻关项目需要方舱医院等临时性医疗救治点及一些尚未备案的医疗机构的参与,但这些临时性医疗救治点和尚未备案的医疗机构不符合我国相关法规规范关于临床试验机构的规定,研究质量存在不确定性。
伦理审查效率方面:对传染病相关知识认识不足、缺乏针对性伦理审查指导文件、疫情救治的紧急性都会在一定程度上削弱伦理审查效率。突发传染病的预防和诊治还存在很多未知,研究进行过程既存在较大可能性出现非预期不良事件,且部分非预期严重不良事件可能导致研究的暂停或提前终止,也存在因疫情、受试者病情变化等直接或间接原因导致的方案偏离[2-3],且在疫情紧急状况下,对伦理审查的时限也提出了很高的要求,如何在尽可能短的时间内,保障伦理审查质量,对伦理委员会也是极大的考验。
鉴于疫情的紧急需要和传染病相关临床研究的特殊性,须建立健全临床研究机构、伦理委员会和多中心临床研究伦理审查等方面的特殊规范,加强管理能力,如建立临床研究伦理审查的特殊规范指南,健全加快审查机制,在符合伦理规范的情况下,根据实际需要适当加快审查程序,简化行政流程,但加快审查程序并不是简化对研究科学性、伦理合规性的要求。通过远程会议、专项伦理审查、独立顾问、基于互认协议的伦理协作审查模式、跟踪审查、现场访视等多种审查方式,提高伦理委员会审查效率,降低临床研究风险,充分保障突发传染病特殊时期的受试者安全与权益。

