川产黄精组织培养快繁技术研究
姜丽琼,李文俊,肖前刚,陈文灵,徐志萍,浣杰,杨洪燕,杨敏,宋若楠
成都市农林科学院,四川成都 611130
黄精(Polygonatum sibiricum)为百合科黄精属药食同源植物,根茎含有黄精多糖、黄酮及皂甙等多种对人体有益的化学物质和活性物质,具有益肾、润肺、健脾、补气的功效[1],
在医疗、保健、食品等方面的应用具有良好的前景[2,3]。黄精种苗繁育以种子繁殖与块茎繁殖为主,种子存在着生理休眠现象,种胚存在生理后熟,人工催苗步骤复杂、成本大[4,5],块茎繁殖消耗大量的药材资源,繁殖系数低,长期使用该块茎繁殖会导致种性退化、病虫害加剧等问题[6],采用有性繁殖方式和常规无性繁殖手段无法满足生产需要,以致其资源远远不能满足市场的需求[7],优质种苗的匮乏仍是制约四川黄精产业化发展的一个瓶颈[8]。组织培养快繁技术较传统繁殖方式,具有节约成本,不受空间时间制约,繁殖系数高,保留亲本优良性状等优势。目前,有些黄精品种的组培快繁技术研究已经取得成功并应用在生产上[9-15],但四川的黄精品种还没有见过报道。四川黄精不回苗、产量高、品质优等特点,适合四川大量发展。本研究基于本土优良黄精,在诱导、增殖、生根阶段探究不同生长调节剂配比以及基本培养基对组培快繁体系的影响,助力黄精中药材资源的合理开发和保护利用,中药材种植生产和质量标准规范化的GAP研究,促进中药现代化及中药产业可持续发展。
1 试验材料
试验材料采自成都市农林科学院林业研究所科研中药材种质资源圃中的无病虫害、生长健壮、品质优良的黄精单株,3—5月晴天采集黄精带芽块茎作为供试材料。
2 试验方法
2.1 外植体预处理
黄精带芽块茎先用流水中冲洗30 min后,75%乙醇溶液表面消毒1 min,无菌水冲洗1次,然后用0.1%HgCl2溶液分别浸泡10 min、12 min、15 min、18 min与20 min,无菌水冲洗5次,无菌纸吸干水分,然后将块茎表皮、切口与灭菌剂有接触的部位轻轻削去,接种在MS(6-BA 0.2 mg·L−1、NAA 0.2 mg·L−1)培养基中。每3 d观察一次,及时清理污染的培养瓶,30 d后统计试验结果。
2.2 诱导培养基筛选
将预处理完成的外植体接种MS培养基中进行诱导培养,每种培养基分别设置激素水平6-BA和NAA分别为(1.0 mg·L−1、2.0 mg·L−1、5.0 mg·L−1),NAA(0.01 mg·L-1、0.05 mg·L−1、0.1 mg·L−1、0.2 mg·L−1)共12个激素处理,每个处理30瓶,60 d后统计诱导情况。培养温度25℃±2℃,光照强度1500~2 000 lx,光照时间14 h·d−1。
2.3 基本培养基筛选
根据材料在培养基中的诱导培养表现情况,对基本培养基做一些筛选(1/2MS、MS、改良MS、3/2改良MS、1/2改良MS),选择最佳基本培养基,每种培养基接种30瓶,60d后观测生长情况。培养温度25℃±2℃,光照强度1500~2000lx,光照时间14 h·d−1。(MS:Murashige and Skoog培养基;MS改良培养基:在MS培养基的基础上,KNO3上调150%,NH4NO3下调150%;1/2MS,3/2MS为培养基成分调节比例,即大量元素比例,其余含量不变)。
2.4 壮苗培养基的筛选
后期的培养过程中,将长势健壮且生长情况基本一致的小苗接种到增殖培养基上进行增殖培养并对6-BA和NAA做出适当调整并添加不同的物质,6-BA(0.5 mg·L−1、1.0 mg·L−1),NAA(0.05 mg·L−1、0.1 mg·L−1、0.2 mg·L−1)6个激素处理组合,增加基本培养基1/3(Mg2++Fe3+)、1/2KH2PO4含量,每个处理接种10瓶,45 d后观察增殖情况,培养温度25℃±2℃,光照强度1500~2 000 lx,光照时间14 h·d−1。
2.5 生根培养基的筛选
壮苗培养后,选择长势较好的健壮材料进行生根培养,以MS作为基本培养基并添加AC 0.5 g·L−1,分别设置激素水平6-BA(0 mg·L−1、0.02 mg·L−1、0.05 mg·L−1、0.1 mg·L−1),NAA(0.2 mg·L−1、0.5 mg·L−1、1.0 mg·L−1)12个激素处理组合,每个处理接种10瓶,30 d后统计生根情况,培养温度25℃±2℃,光照强度1500~2 000 lx,光照时间14 h·d−1。
2.6 炼苗移栽
将瓶苗从生根培养室移至具有遮阳条件的自然光环境下,逐渐打开瓶盖,摆放7 d后,取出,洗净根部培养基,用0.1%多菌灵浸泡根部15 min后栽植与腐殖土、珍珠岩、椰糠、河沙为原料混合基质中;移栽后用75%的遮阳网覆盖,栽植后第7 d、15 d及30 d,交替喷施0.1%多菌灵、甲基托布津或百菌清,60 d后统计成活率。
3 结果与分析
3.1 黄精外植体预处理
在材料清洗上,要彻底清洗一些褶皱,污染大多为真菌污染,由表1可知,外植体消毒处理随处理时间增加污染率与存活率明显下降,在15 min时,污染率低存活率高,满足黄精的外植体消毒,达到两者之间的一个平衡。与孙骏威[16]等人研究相比,污染率与剔除污染瓶苗后存活率相近,消毒时间更短,避免消毒时间过长对外植造成的影响。

表1 外植体不同处理时间的比较Tab.1 Comparison of different treatment timeof explants
3.2 诱导培养基筛选
由表2可知,随着6-BA浓度升高,黄精组培苗生长势呈现明显的上升趋势,培养基中的6-BA浓度为5.0 mg·L−1时生长势最佳,超过该浓度生长势受到抑制。发芽率,生长势随着NAA浓度上升呈现明显的上升趋势,超过0.1 mg·L−1,叶色受到影响,最佳浓度为0.1 mg·L−1,发芽率高、生长势好、芽易抽长、叶色绿、苗壮、底部有根萌发。综上所述,以MS+6-BA 5.0 mg·L−1+ NAA0.1 mg·L−1为最佳诱导培养基。
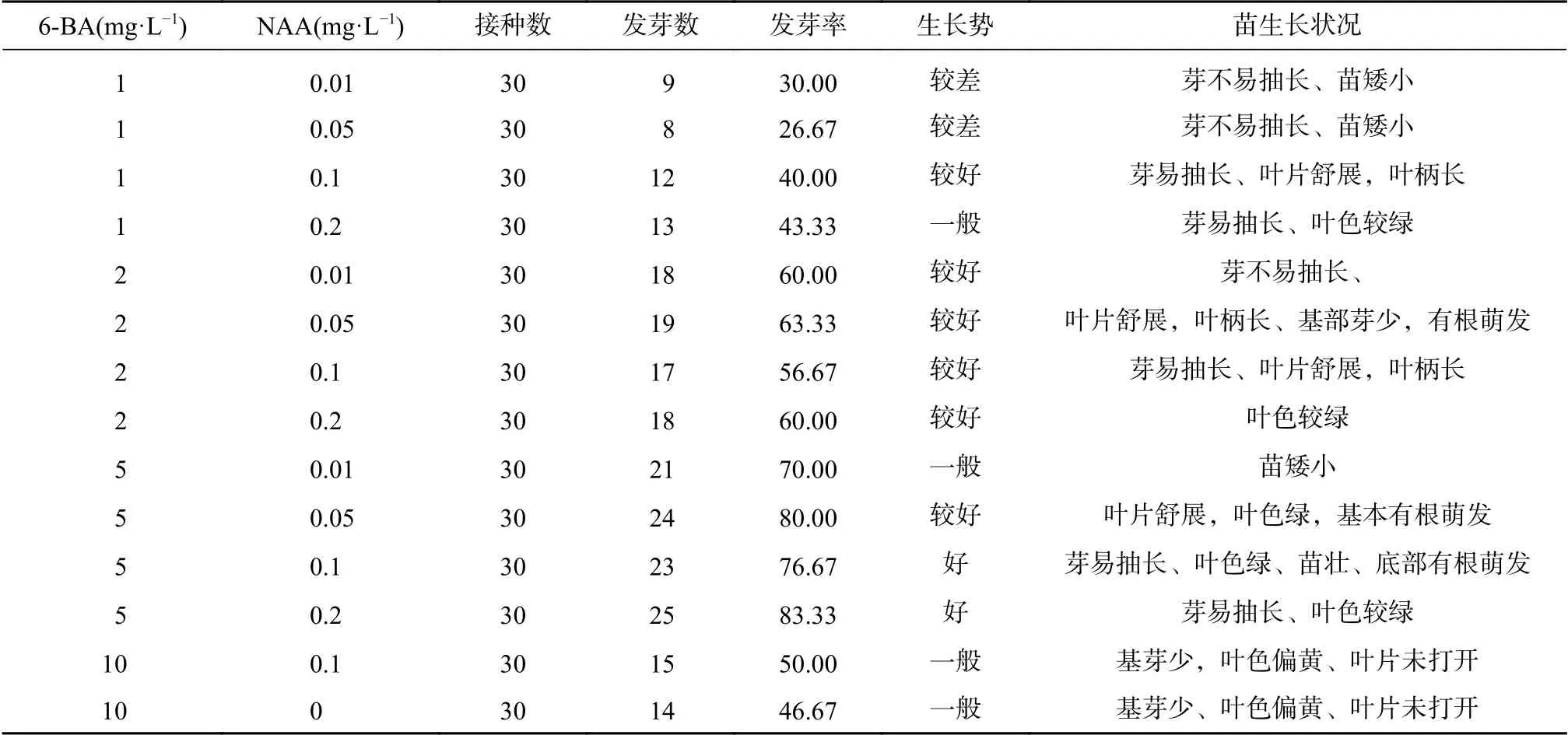
表2 不同培养基激素配比的MS培养基诱导萌芽生长情况表Tab.2 the germination and growth of MS medium with different medium hormoneratio
3.3 基本培养基筛选
根据材料生长情况,对基本培养基进行筛选,在6-BA 5.0 mg·L−1+NAA 0.1 mg·L−1激素水平下,MS培养基表现最佳,改良MS培养基较好,1/2MS培养基表现一般,1/2改良MS、3/2改良MS培养基表现较差(见表3)。

表3 不同基本培养基下生长情况表Tab.3 growth of different basic media
3.4 壮苗培养基筛选
如表4所示,在黄精壮苗培养基的筛选上,随着NAA浓度增加,存在叶变大卷曲现象。6-BA浓度为0.5 mg·L−1时效果最佳,添加1 g·L−1AC有利于叶片舒展,减少褐化现象,增加基本培养基Mg2++Fe3+,1/2KH2PO4利于克服叶片发黄现象,并促进壮苗增殖效果。综上所述,最佳壮苗培养基配方为MS+6-BA0.5 mg·L−1+ NAA0.05 mg·L−1+1/3(Mg2++Fe3+)↑+ 1/2KH2PO4↑+1g·L−1AC。

表4 不同激素配比增殖表现情况表Tab.4 proliferation performance of different hormone ratio
3.5 生根培养基的筛选
由表5可知,黄精生根培养基激素配比上,NAA激素浓度为1 mg·L−1时效果最佳,添加蔗糖与赤霉素的培养基表现效果不佳。6-BA在激素水平上0~0.05 mg·L−1之间效果都比较好,其中以0.05 mg·L−1时效果最佳;培养基添加AC 0.5 g·L−1以防止褐变和有害物质的积累,同时创造的黑暗环境利于根的诱导和根系的生长。综上所述,最佳生根培养基为MS +6-BA0.05 mg·L−1+ NAA1.0 mg·L−1+AC0.5 g·L−1。

表5 不同激素配比生根表现情况表Tab.5 rooting performance of different hormone ratio
3.6 炼苗移栽
将生根的和未生根的材料进行室外移栽,30 d统计成活率,成活率95%以上。
4 结论与讨论
以四川本土优良黄精块茎或新萌发叶柄作为繁殖材料,建立四川本土黄精组培技术体系,外植体最佳预处理方式为75%乙醇溶液表面消毒1 min,然后用0.1%HgCl2溶液浸泡15 min,达到存活率与污染率平衡最佳。
在组培过程中,需要外源生长调节剂调控,NAA促进细胞生长与扩大,诱导形成不定根,与细胞分裂素6-BA相互促进芽的增殖和生长[17,18],过高的浓度干扰正常的蛋白质和核酸代谢过程,产生抑制作用。生长过程中生长素的种类与浓度以及比例,对于植物组织培养有着极其重要的作用。通过梯度试验,得出最佳诱导培养基方案MS+6-BA 5.0 mg·L−1+NAA 0.1 mg·L−1;最佳增殖培养基MS+6-BA0.5 mg·L−1+NAA0.05 mg·L−1+1/3(Mg2++Fe3+)↑+1/2KH2PO4↑+AC 1g·L−1;最佳生根培养基MS +6-BA0.05 mg·L−1+NAA 1.0 mg·L−1+AC 0.5 g·L−1,生根率可达到85%以上,通过炼苗移栽,移植存活率95%以上。黄精无菌体系的建立,为黄精产业发展提供大量优质种苗奠定基础。

图1 黄精组培育苗图Fig.1 cultivation seedlingsof Polygonatum

