地屈孕酮在子宫内膜单纯性增生中的临床治疗效果评估
杨火梅,宋晓霞,张龙,辛佳凌
(新余市人民医院,江西新余 338000)
子宫内膜增生(endometrial hyperplasia,EH)多为非生理性的子宫内膜增生所致,多数患者为单纯性增生,进展较慢,细胞无异型性,癌变风险较小,但该病仍会导致患者出现月经紊乱、子宫异常出血等症状,严重时还可能导致患者不孕,需尽早治疗[1]。现阶段,单纯性增生的治疗以手术及药物保守治疗为主,因手术治疗风险较大,且会影响患者的生育功能,因此,多数患者倾向于选择药物保守治疗。甲羟孕酮、地屈孕酮均属孕激素类药物,可拮抗雌激素刺激造成的子宫内膜增生,但有研究表明,甲羟孕酮易造成乳溢、闭经等不良反应,影响治疗效果[2]。基于此,本研究探究地屈孕酮治疗子宫内膜单纯性增生患者的应用效果,旨在为子宫内膜单纯性增生的治疗提供指导,现报道如下。
1 资料与方法
1.1 临床资料选取2018年1月至2019年12月于本院就诊的80例子宫内膜单纯性增生患者,采用随机数字表法分为对照组和观察组,每组40例。对照组年龄21~57岁,平均(36.12±5.32)岁;子宫内膜厚度9~16 mm,平均(12.19±1.23)mm;病程2~6年,平均(3.15±0.74)年;文化水平:小学及以下3例,初中10例,高中及以上27例。观察组年龄21~56岁,平均(35.52±4.21)岁;子宫内膜厚度10~16 mm,平均(12.16±1.18)mm;病程2~6年,平均(3.12±0.76)年;文化水平:小学及以下3例,初中9例,高中及以上28例。两组患者临床资料比较差异无统计学意义,具有可比性。所有患者均对本研究知情同意,并自愿签署知情同意书。本研究已通过医院伦理委员会审核批准。
1.2 纳入及排除标准纳入标准:①符合《中国子宫内膜增生诊疗共识》[3]内AEH相关诊断标准;②经组织病理学检查确诊为子宫内膜单纯性增生;③患者存在月经异常、疼痛等症状;④患者近期内未接受其他相关治疗。排除标准:①妊娠期女性;②对本研究所用药物不耐受者;③合并肝肾功能障碍者;④患有精神疾病不能配合者;⑤合并心力衰竭者;⑥合并子宫肌瘤、子宫内膜息肉等其他妇科疾病者;⑦合并糖尿病及血液系统疾病者。
1.3 方法两组均于饭后口服维生素C片(陕西颐生堂药业有限公司,生产批号:20170605、20180702,规格:0.1 g/片),每次0.1 g,每天1次;贫血患者给予琥珀酸亚铁片(湖南九典制药股份有限公司,生产批号:20170402、20181103,规格:0.1 g/片),每次0.1 g,每天3次,控制血红蛋白水平≥110 g/L;调整患者饮食结构、增加有氧运动等。
1.3.1 对照组对照组采用甲羟孕酮(上海全宇生物科技确山制药有限公司,生产批号:20170604、20180503,规格:2 mg/片)治疗:口服醋酸甲羟孕酮片,每次8 mg,每天1次,根据患者孕激素水平适量调整用药,在患者月经来潮第5天后继续用药10 d,连续用药3个月。
1.3.2 观察组观察组采用地屈孕酮(Abbott Healthcare Products B.V.,国药准字H20170221,规格:10 mg/片)治疗,从月经的第15天后开始口服地屈孕酮片,每次10 mg,早晚各1次,口服7~10 d为1个周期。连续用药3个月。
1.4 观察指标①治疗效果:根据《中国子宫内膜增生诊疗共识》[3]中相关标准评价治疗效果,用药后患者子宫内膜组织病理学检查提示明显逆转,撤退性出血量正常为显效;用药后患者子宫内膜组织病理学检查提示有所改变,撤退性出血量减少为有效;用药后子宫内膜组织病理学检查无显著改变或加重,撤退性出血量增加为无效。总有效率=(显效+有效)/总例数×100%。②子宫内膜厚度:采用彩色多普勒超声诊断仪(杭州远想医疗设备有限公司,TCC-02)经阴道超声测量并记录患者子宫内膜厚度变化。③血清学指标:抽取空腹静脉血10 mL,3 500 r/min离心10 min,离心半径为13 cm,选择酶联免疫吸附法检测血清基质金属蛋白酶-3(MMP-3)、血管内皮生长因子(VEGF)及糖类抗原125(crbohydrate antigen 125,CA125)水平,试剂盒购自上海酶联生物科技有限公司。④性激素水平:采用全自动化学发光免疫分析仪(深圳迈瑞生物医疗电子股份有限公司,CL-2200i型)检测患者雌二醇(estradiol,E2)、促卵泡激素(follicule-stimulating hormone,FSH)及促黄体生成素(luteinizing hormone,LH)水平。⑤月经情况:采用月经量评分量表(Pictorial Blood Assessment Chart,PBAC)[4],根据患者卫生巾使用数量及染血面积评估患者出血量。评分>100分为月经量过多。
1.5 统计学方法采用SPSS 25.0统计软件进行数据分析,计量资料以“±s”表示,比较采用t检验,计数资料用[n(%)]表示,比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组临床疗效比较观察组治疗总有效率明显高于对照组,差异有统计学意义(P<0.05),见表1。
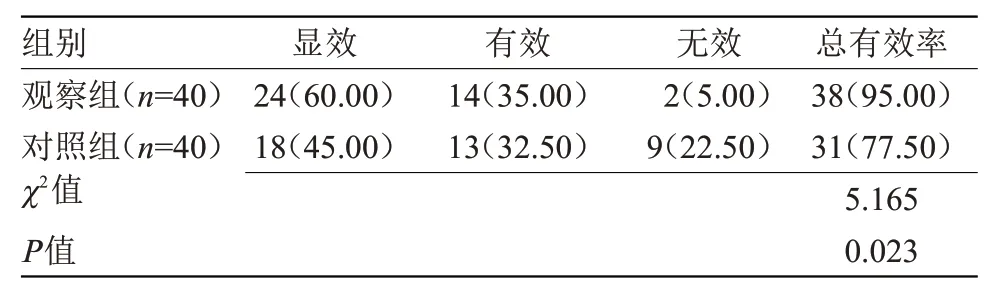
表1 两组临床疗效比较[n(%)]Table 1 Comparison of clinical efficacy between the two groups[n(%)]
2.2 两组治疗前后子宫内膜厚度比较治疗前,两组子宫内膜厚度比较差异无统计学意义;治疗3个月,两组子宫内膜厚度均低于治疗前,且观察组低于对照组,差异有统计学意义(P<0.05),见表2。
表2 两组治疗前后子宫内膜厚度比较(±s,mm)Table 2 Comparison of endometrial thickness between the two groups before and after treatment(±s,mm)

表2 两组治疗前后子宫内膜厚度比较(±s,mm)Table 2 Comparison of endometrial thickness between the two groups before and after treatment(±s,mm)
组别观察组(n=40)对照组(n=40)t值P值治疗前12.16±1.18 12.19±1.23 0.111 0.912治疗3个月后6.84±1.23 9.45±1.21 9.567<0.001 t值19.740 10.044 P值<0.001<0.001
2.3 两组血清学指标比较治疗前,两组VEGF、MMP-3、CA125水平比较,差异无统计学意义;治疗3个月后,两组VEGF、MMP-3、CA125水平均低于治疗前,且观察组低于对照组,差异有统计学意义(P<0.05),见表3。
表3 两组治疗前后血清学指标比较(±s)Table 3 Comparison of serological indexes between the two groups before and after treatment(±s)
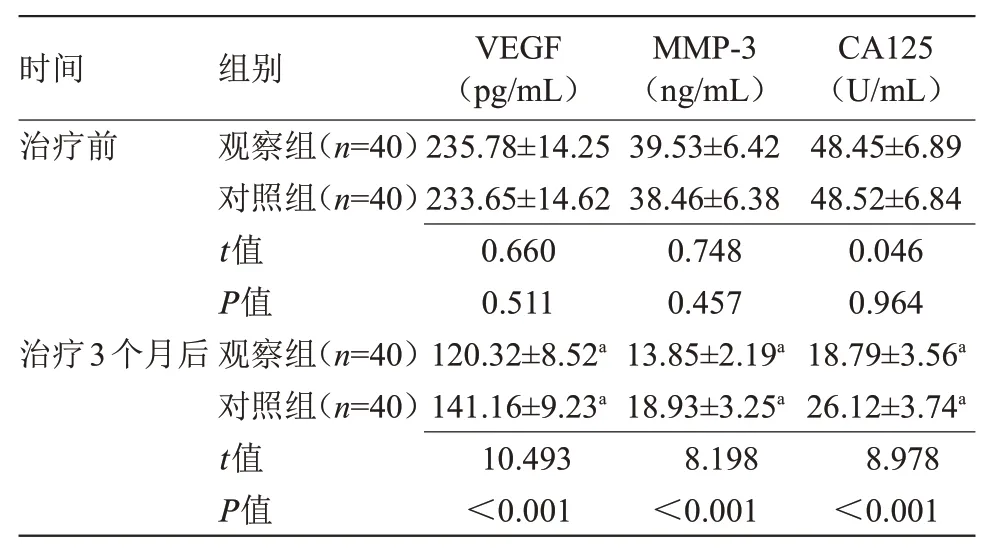
表3 两组治疗前后血清学指标比较(±s)Table 3 Comparison of serological indexes between the two groups before and after treatment(±s)
注:VEGF,血管内皮生长因子;MMP-3,基质金属蛋白酶-3;CA125,糖类抗原125。与本组治疗前比较,aP<0.05
时间治疗前治疗3个月后组别观察组(n=40)对照组(n=40)t值P值观察组(n=40)对照组(n=40)t值P值VEGF(pg/mL)235.78±14.25 233.65±14.62 0.660 0.511 120.32±8.52a 141.16±9.23a 10.493<0.001 MMP-3(ng/mL)39.53±6.42 38.46±6.38 0.748 0.457 13.85±2.19a 18.93±3.25a 8.198<0.001 CA125(U/mL)48.45±6.89 48.52±6.84 0.046 0.964 18.79±3.56a 26.12±3.74a 8.978<0.001
2.4 两组治疗前后性激素水平比较治疗前,两组E2、FSH、LH水平比较差异无统计学意义;治疗3个月后,两组E2、FSH、LH水平均低于对照组,且观察组低于对照组,差异有统计学意义(P<0.05),见表4。
表4 两组治疗前后性激素水平比较(±s)Table 4 Comparison of sex hormone levels between the two groups before and after treatment(±s)

表4 两组治疗前后性激素水平比较(±s)Table 4 Comparison of sex hormone levels between the two groups before and after treatment(±s)
注:E2,雌二醇;FSH,促卵泡激素;LH,促黄体生成素。与本组治疗前比较,aP<0.05
时间治疗前治疗3个月后组别观察组(n=40)对照组(n=40)t值P值观察组(n=40)对照组(n=40)t值P值E2(μmol/L)335.66±21.26 338.62±21.41 0.621 0.537 129.17±11.02a 146.32±15.13a 5.795<0.001 FSH(U/L)12.53±2.19 12.51±2.17 0.041 0.967 5.65±0.92a 7.43±1.13a 7.726<0.001 LH(U/L)10.66±2.07 10.63±2.15 0.064 0.950 4.71±0.76a 6.14±0.94a 7.482<0.001
2.5 两组治疗前后月经量评分比较治疗前,两组月经量评分比较差异无统计学意义;治疗3个月后,两组月经量评分均低于治疗前,且观察组低于对照组,差异有统计学意义(P<0.05),见表5。
表5 两组治疗前后月经量评分比较(±s,分)Table 5 Comparison of menstrual volume scores between the two groups before and after treatment(±s,scores)

表5 两组治疗前后月经量评分比较(±s,分)Table 5 Comparison of menstrual volume scores between the two groups before and after treatment(±s,scores)
组别观察组(n=40)对照组(n=40)t值P值治疗前118.26±12.28 119.21±12.19 0.347 0.729治疗3个月46.54±5.13 78.21±8.62 18.076<0.001 t值32.658 17.368 P值<0.001<0.001
3 讨论
EH属于癌前病变,多数患者内膜增生症状较轻,为良性状态,但仍有部分患者会在一段时间后发展为子宫内膜癌。子宫内膜单纯性增生多发于年轻女性,其发病因素尚未明确,临床多认为与患者性激素水平有关,患者通过下丘脑-垂体-卵巢轴调节机体孕激素水平,如其中某一环节失调,患者会出现孕激素分泌下降,此时子宫内膜会因缺乏孕激素而持续性受到雌激素刺激,造成子宫内膜持续增生[5]。因此,临床治疗单纯性增生时多采用孕激素类药物。甲羟孕酮为临床上常用孕激素类药物,该药性质接近天然孕酮,可调节患者月经并起到拮抗雌激素作用;且该药还可负反馈作用于大脑垂体,抑制LH、VEGF等生长因子分泌,利于限制患者子宫内膜增生[6]。但长期使用甲羟孕酮会损害患者肝功能,诱发头痛、体液潴留等不良反应,因此,还需寻找其他安全有效的治疗方案。
E2、FSH、LH为常见的性激素指标,其中E2主要由卵巢分泌,在患者机体孕激素分泌不足时会持续刺激患者子宫内膜,促进子宫内膜增生;FSH可促进卵泡发育,使整个卵巢增大,其含量随月经周期变化,如患者体内孕激素水平增加,其分泌会受到抑制;LH为腺垂体分泌的一种蛋白质,可与FSH共同作用,促进排卵及分泌雌激素,其水平升高提示患者卵巢功能异常。本研究结果显示,观察组治疗有效率高于对照组,且治疗后,观察组子宫内膜厚度、E2、FSH、LH、PBAC水平均低于对照组(P<0.05),表明地屈孕酮治疗子宫内膜单纯性增生患者效果显著,可有效控制患者子宫内膜厚度,降低患者性激素水平,使月经恢复正常。分析原因为,地屈孕酮为天然的孕激素,在口服进入患者体内后可在短时间内被肠道吸收,能作用于子宫平滑肌,降低患者子宫平滑肌的敏感性,使处于增殖期的子宫内膜转变为分泌期,限制患者子宫内膜过度增生,避免患者病情加重或复发[7]。地屈孕酮可作用于垂体,影响下丘脑-垂体-卵巢轴调节功能,抑制性腺激素分泌,降低患者E2、FSH、LH水平,改变患者月经紊乱状态,促进患者恢复。
VEGF具有促进血管生长的作用,其能够促进患者血管通透性增加,改变患者子宫内膜腺体细胞基质外成分,使血管内皮细胞向内迁移,对促进子宫内膜单纯性增生患者子宫内膜内新生血管的形成具有重要意义,可促进患者子宫内膜增生;MMP-3能够降解细胞基质外的蛋白质成分,改变患者子宫内膜细胞通透性,促进子宫内膜腺体间质生长;CA125属高分子糖蛋白,常见于患者卵巢,亦属于子宫内膜癌标志物,患者子宫内膜增生时可见其含量增加。本研究结果显示,治疗后,观察组VEGF、MMP-3、CA125水平低于对照组(P<0.05),说明地屈孕酮改善子宫内膜单纯性增生患者VEGF、MMP-3、CA125水平的效果优于甲羟孕酮。分析原因为,地屈孕酮可直接作用于患者子宫内膜病灶,影响其上皮细胞,减少病灶活性,并激活上皮细胞自噬活性[8],改变核糖核酸表达,干扰雌激素合成,缓解患者子宫内膜处炎症程度,促使VEGF、MMP-3、CA125等血清学指标水平改善,并使患者子宫内膜呈萎缩方向发展,降低患者子宫内膜癌变风险[9]。此外,该药安全性较高,经人体吸收72 h内可完全代谢清除,代谢物可经尿液排出体外,不会造成药物残留,对患者机体损伤较小,利于患者术后恢复[10]。
综上所述,地屈孕酮用于子宫内膜单纯性增生患者效果显著,可有效控制子宫内膜厚度,改善患者VEGF、MMP-3、CA125指标,降低患者性激素水平,促进患者月经恢复正常,值得临床推广运用。

