高通量小间距细胞电穿孔装置设计及实验测试
王 忠 崔金明* TOKUYASU Taku Andrew
1(广州中国科学院先进技术研究所 广州 511458)
2(中国科学院深圳先进技术研究院 深圳 518055)
1 引 言
细胞电穿孔技术又称电转染技术,是细胞转染技术中常用的一种途径,最早在 1982 年由Neumann 等[1]报道。该技术通过施加一定的电场强度可逆地击穿细胞膜,在细胞膜上形成小孔或通路,从而将遗传物质引入细胞内[2],是基因工程领域以及新兴的合成生物学领域的重要环节。目前,市场上的电穿孔仪多为传统电穿孔仪,包括一个电压发生器和一个带有两个金属电极的标准电击杯。其中,标准电击杯的电极间距一般为1 mm,电穿孔时需要对其施加几百伏到几千伏的电压,存在操作危险、依赖人工操作、难以实现自动化运行等局限性。为解决传统电穿孔仪的局限,微型电穿孔技术在 2000 年被首次提出[3]。微型电穿孔仪弥补了传统电穿孔仪的部分不足,能够提高细胞存活率和细胞转染率,甚至实现了对单个细胞的电穿孔操作[4-9],但微型电穿孔仪处理的细胞数量偏少,而在生物学实际应用中,往往需要一定的细胞数量,才能获得足够的基因型和表型多样性用于筛选。为此,本实验设计了一种高通量小间距细胞电穿孔装置,既降低了细胞电穿孔所需电压,又能高通量操作,提高细胞处理量。
2 高通量小间距细胞电穿孔装置设计
细胞电穿孔的成功率主要受电场强度、电压波形、电压持续时间、温度和 pH 等多种因素的影响[10-16]。本研究从降低细胞电穿孔所需电压以及提高细胞处理量的角度出发,设计了一种由绝缘薄膜隔离电极的高通量小间距细胞电穿孔装置。其中,采用电绝缘的聚氯乙烯(Polyvinyl Chloride,PVC)薄膜来隔离两个电极,二者的间距完全由 PVC 薄膜的厚度决定。本实验采用厚度为 0.08 mm(80 μm)的PVC 薄膜,因而电极间距为 80 μm。
该细胞电穿孔装置的电极间距比实验室常用的标准电击杯(毫米级)低了一个数量级,但又比微型电穿孔仪采用的电极间距(微米级)高了一个数量级,因而实现细胞电穿孔所需的电压比标准电击杯明显降低,而每次细胞电穿孔的处理量又比微型电穿孔仪多;同时,装置的出入口可以通过硅胶软管与蠕动泵或注射器相连,实现高通量操作,显著提高细胞处理量,提高实验效率。该细胞电穿孔装置的实物图、三维模型的剖视图和爆炸视图如图 1 和图 2 所示。

图1 由薄膜隔离电极的高通量小间距细胞电穿孔装置Fig.1 High throughput and small distance electroporation device with thin film isolated electrodes
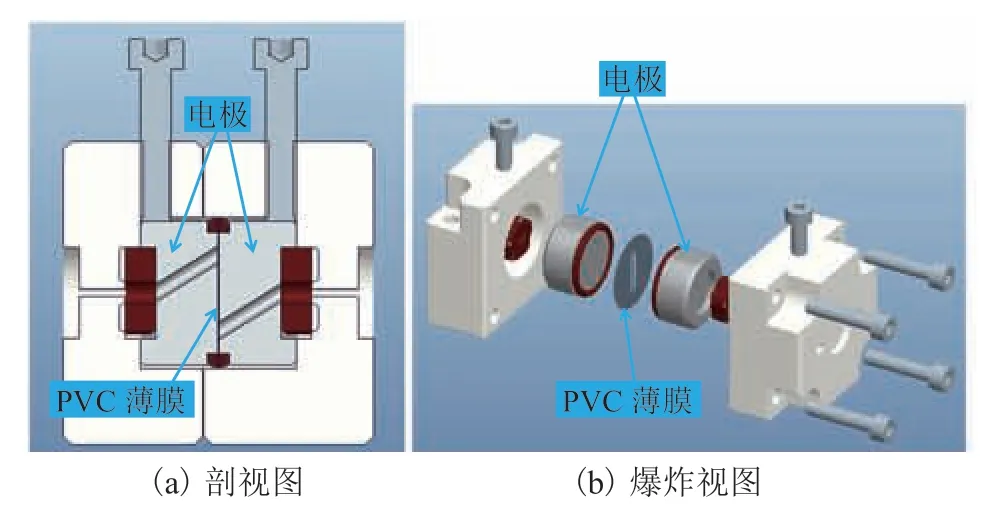
图2 剖视图和爆炸视图Fig.2 Cutaway view and explosion view
3 实验测试
为了验证所设计装置的细胞电穿孔情况并测量电穿孔的效率,分别采用大肠杆菌 MG1655 转染质粒 pUC57、毕次酵母 GS115 转染质粒 pPIC9K进行电穿孔实验测试。为了避免引入其他不确定因素,采用实验室常用的 Bio-Rad MicroPulser 电穿孔仪作为脉冲发生器,对该高通量小间距细胞电穿孔装置和 1 mm 标准电击杯进行对比测试。为能测试不同电压条件下的电穿孔效果,在电穿孔电路中设置了一个分压电阻。电穿孔实验原理图和实物图分别如图 3 和图 4 所示。
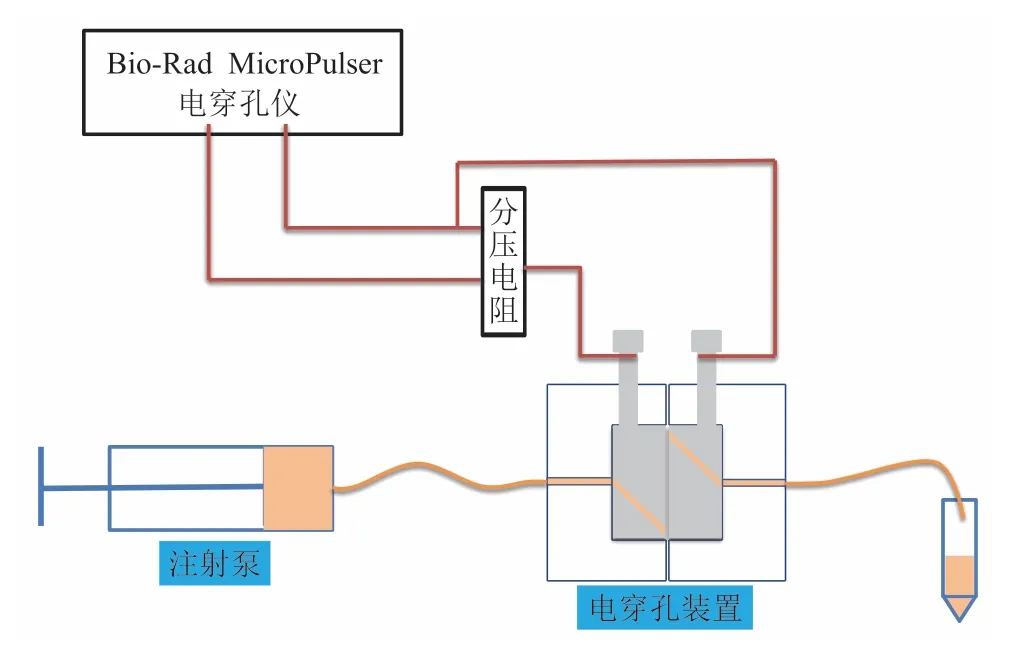
图3 电穿孔实验原理图Fig.3 Schematic diagram of the electroporation experiment

图4 电穿孔实验实物图Fig.4 Picture of the electroporation experiment
3.1 大肠杆菌 MG1655 转染质粒 pUC57 测试
(1)菌株:E.coliMG1655 购自 Invitrogen公司。
(2)质粒:pUC57 购自 Novagen 公司,质粒浓度为 122.127 ng/μL。
(3)实验参数:选择 Bio-Rad MicroPulser 电穿孔仪的 Manual 模式,设定脉冲电压;该高通量小间距电穿孔装置的两个电极之间的电穿孔腔体体积为 2 μL,控制脉冲发生器每 5 s 施加一次脉冲电压,设定注射泵的注射速度为 0.4 μL/s,以确保流过装置的细胞液完全接受脉冲电压的作用。
(4)实验过程:往 100 μL 的感受态细胞液内加入 1 μL 质粒,混匀后通过注射泵以 0.4 μL/s的速度注入电穿孔装置进行电穿孔(整个操作在冰水环绕环境下进行)。为了探索不同电压情况下的细胞电穿孔效果,分别采用 200 V、220 V、240 V、260 V、280 V 和 300 V 电压进行实验。作为对照组,往 100 μL 的感受态细胞液内加入1 μL 质粒,置于 1 mm 标准电击杯内,施加大肠杆菌通常采用的 1.8 kV 脉冲电压进行细胞电穿孔。电穿孔后,先将细胞液与 900 μL SOC 缓冲液混合,放入 37 ℃ 摇床复苏 1 h;然后,将细胞液涂布于含卡那霉素(终浓度为 50 mg/μL)的 LB(Luria-Bertani)琼脂培养基上,放入 37 ℃ 温箱过夜培养,第 2 天早上统计 LB 琼脂板上的菌落数。
(5)实验结果:第 2 天早上发现 6 种测试电压下的 LB 琼脂板上均有菌落长出,表明这些电压条件下都有细胞成功电穿孔,菌落数量及转化效率计算结果如表 1 所示。其中,电穿孔转化效率计算公式为:

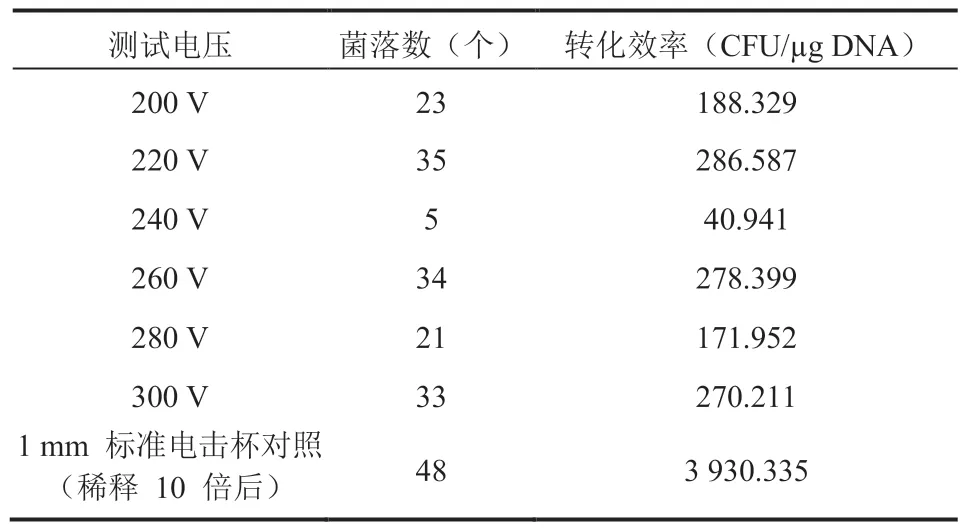
表1 电穿孔实验结果Table 1 Results of electroporation experiments
E.coliMG1655 转染质粒 pUC57 的电穿孔实验结果表明,相比于采用 1 mm 标准电击杯,虽然该电穿孔装置成功进行电穿孔所需的电压降低了一个数量级,但是电穿孔转化效率也降低了一个数量级。
3.2 毕次酵母转染质粒 pPIC9K 测试
(1)菌株:Pichia pastorisGS115 购自Invitrogen 公司。
(2)质粒:pPIC9K 购自 Invitrogen 公司,质粒浓度为 224.600 ng/μL。
(3)实验参数:依然选择 Bio-Rad MicroPulser电穿孔仪的 Manual 模式,设定脉冲电压;控制脉冲发生器每 5 s 施加一次脉冲电压,设定注射泵的注射速度为 0.4 μL/s,以确保流过装置的细胞液完全接受脉冲电压的作用。
(4)实验过程:往 100 μL 的感受态细胞液内加入 1 μL 质粒,混匀后通过注射泵以 0.4 μL/s的速度注入电穿孔装置进行电穿孔(整个操作在冰水环绕环境下进行),电穿孔电压采用 150 V。作为对照组,往 100 μL 的感受态细胞液内加入1 μL 质粒,置于 1 mm 标准电击杯内,施加毕次酵母通常采用的 1.5 kV 脉冲电压进行细胞电穿孔。电穿孔后,先将细胞液与 900 μL 1 mol/L 的D-山梨醇溶液混合,放入 30 ℃ 摇床复苏 1 h;然后,将细胞液涂布于 MD (Minimal Dextrase) 培养基平板上,放入 30 ℃ 温箱中培养 3 天,第 4天早上统计 MD 平板上的菌落数。
(5)实验结果:第 4 天早上发现实验组的MD 平板上有菌落长出,但菌落数量比对照组低了一个数量级,如图 5 所示。
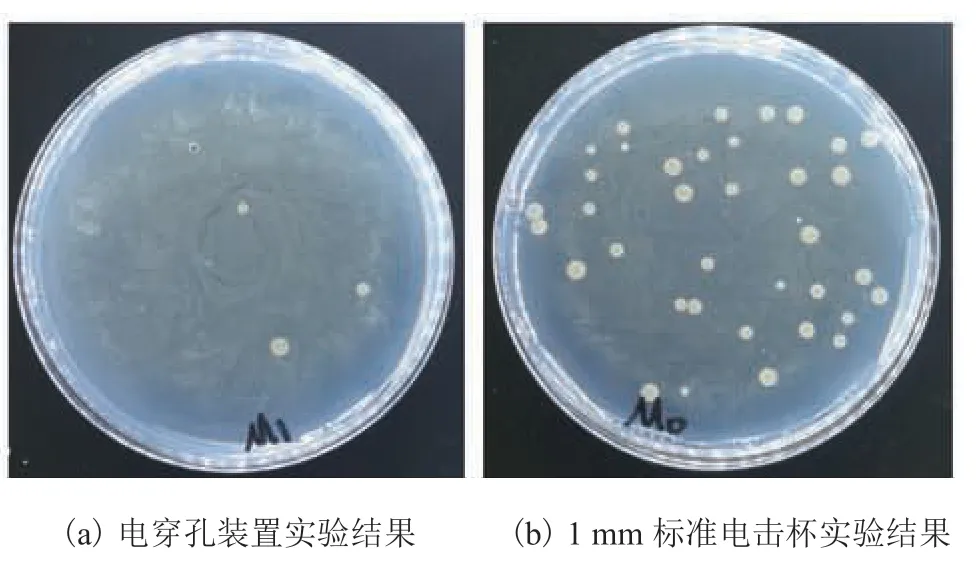
图5 毕次酵母转染质粒 pPIC9K 实验结果Fig.5 Results of plasmid pPIC9K transfected by Pichia pastoris
毕次酵母转染质粒 pPIC9K 的实验结果表明,相比于采用 1 mm 标准电击杯,该电穿孔装置成功进行电穿孔所需的电压降低了一个数量级,但电穿孔转化效率也降低了一个数量级。
4 结语
本实验采用电绝缘的 PVC 薄膜,设计了一种电极间距为 0.08 mm(80 μm)的电穿孔装置,加工制作方便,而且电极间距可以通过选用不同厚度的 PVC 薄膜来改变;相比实验室常用的1 mm 标准电击杯,实现细胞电穿孔所需的电压降低了一个数量级,提高了电穿孔实验的安全性;相比微型电穿孔仪,细胞处理量得到较大提高;而且装置可以通过硅胶软管与蠕动泵或注射器相连,实现高通量操作,提高了细胞处理量和实验效率。
E.coliMG1655 转染质粒 pUC57 实验以及PichiapastorisGS115 转染质粒 pPIC9K 实验结果表明,本文提出的高通量小间距细胞电穿孔装置可以成功实现细胞电穿孔,所需要的电压比 1 mm标准电击杯降低了一个数量级,显著提高了实验操作的安全性,但电穿孔效率比 1 mm 标准电击杯低了一个数量级。
电穿孔效率低的原因可能有两方面:(1)该装置电穿孔腔横截面的长宽比(长度 2 mm、宽度0.08 mm)较大,导致更多细胞处于靠近电极的区域,而该区域在施加电压过程中的温度、pH 变化较大,影响电穿孔效率;(2)针对该电穿孔装置所采用的电压波形、持续时间等参数不够理想。若想实现更高的电穿孔效率,则需对 PVC薄膜通道的形状(影响电穿孔腔横截面的长宽比)、细胞电穿孔施加的电压波形、大小等实验参数进一步优化。

