CD317 促进巨噬细胞 TLR4 信号转导的作用机制研究
逯晓旭 邓 湉 张鹏超 章桂忠* 万晓春*
1(中国科学院深圳先进技术研究院 深圳 518055)
2(中国科学院大学 北京 100049)
1 引 言
天然免疫是机体抵御病原微生物入侵的第一道防线。天然免疫细胞(如巨噬细胞、树突状细胞等)通过表达其上的模式识别受体(Pattern Recognition Receptors,PRRs)识别特定病原相关分子模式(Pathogen-Associated Molecular Patterns,PAMPs)[1-2],激活下游免疫应答信号,发挥抗感染作用。其中,PRRs 是天然免疫应答的关键,负责对病原体 PAMPs,如双链 RNA、非甲基化 CpG DNA、细菌蛋白及脂多糖(Lipopolysaccharide,LPS)等的识别。PRRs 包含 Toll 样受体(TLRs)、Nod 样受体(NLRs)、视黄酸诱导基因 I(Retinoic Acid-Inducible Gene I,RIG-I)样受体(RLRs)、甘露糖受体(MR)、清道夫受体(SR),这些受体能各自识别对应的病原体 PAMPs[3-6]。
Toll 样受体 4(TLR4)是 TLRs 家族中第一个被鉴定的成员[7],主要定位于细胞膜上,能特异性地识别细菌微生物并将细胞外抗原识别信息向细胞内传递。TLR4 是类跨膜模式识别受体,其胞外域识别 LPS[8-9],通过胞内 Toll/IL-1 受体(TIR)结构域与骨髓分化初级反应蛋白 88(Myeloid Differentiation Primary Response Protein 88,MyD88)、TNF 受体相关因子 6(TNF Receptor Associated Factor 6,TRAF6)等接头蛋白结合,激活下游的核因子 κB(Nuclear Factor Kappa-B,NF-κB)以及丝裂原活化蛋白激酶(Mitogen-Activated Protein Kinase,MAPK)等信号通路[10-11],发挥抗感染作用。TLR4 信号缺陷会导致机体对革兰阴性菌高度易感,表现为炎症因子释放减少,对革兰阴性菌的清除能力下降,生存率降低[12]。反之,TLR4 信号异常激活会造成免疫损伤,诱发多种炎症疾病,如结肠炎、肾炎、肺炎、肝炎和新生儿坏死性小肠结肠炎(Necrotizing Enterocolitis)等[13-14],而敲除小鼠的Tlr4对局灶性脑缺血有神经保护作用[15]。近年来越来越多的研究表明,肿瘤的形成也与慢性感染、炎症刺激相关。其中,TLR4 信号异常是一个常见因素,迄今已知与 TLR4 相关的肿瘤至少有 9 种[16]。因此,需要加深对 TLR4 信号通路的认识,寻找合适的调控靶点,为相关疾病的诊疗、干预提供指导。
CD317 又称为骨髓基质细胞抗原 2(Bone Marrow Stromal Cell Antigen 2)、Tetherin 或HM1.24,分布于细胞膜和其他细胞内膜上,有着独特的脂筏相关的双跨膜“桥式”蛋白结构[17]。基于其特殊的结构,CD317 可以将囊膜病毒束缚在宿主细胞表面,抑制病毒扩散或将病毒内吞后通过泛素依赖的途径降解[18-21]。不仅如此,CD317 还具有信号转导、免疫调节等功能。有文献指出,CD317 可以激活 NF-κB 调控机体的抗病毒炎症反应[22-23];或通过与 ILT7 相互作用抑制类浆性树突状细胞活化,从而减少干扰素的产生[24]。此外,CD317 还可以通过招募E3 泛素连接酶 MARCH8(Membrane Associated RING-CH Proteins)将线粒体抗病毒信号蛋白(Mitochondrial Antiviral Signaling Protein)靶向核点蛋白 52(Nuclear Dot Protein 52)介导的自噬途径,负调控视黄酸诱导基因样受体介导的干扰素(Interferon,IFN)产生的作用[25]。尽管如此,目前仍未清楚 CD317 对 TLR4 信号转导是否有调控作用。
2 材料和方法
2.1 实验材料
THP-1、HEK293T 细胞购于美国模式培养物集存库(American Type Culture Collection,ATCC)。细胞培养基 RPMI-1640、磷酸盐缓冲液(Phosphate Buffered Saline,PBS)、青霉素-链霉素混合双抗均购于美国 Hyclone 公司。DMEM (Dulbecco Modified Eagle Medium)、胎牛血清(澳源)、Opti-MEM购于美国 Gibco 公司。佛波酯(Phorbol 12-Myristate 13-Acetate,PMA)、脂多糖(LPS)购于美国 Sigma-Aldrich公司。Lipofectamine 3000 购于 Invitrogen 公司。TransZol Up Plus RNA Kit、One-Step gDNA Removal and cDNA Synthesis SuperMix 及 SYBR GreenRealtime PCR Mix 购于北京全式金公司。巯基乙酸盐肉汤培养基(211716)购于美国 BD 公司。Phospho-NF-κB p65 (Ser536) (93H1) Rabbit mAb (3033)、Phospho-p38 MAPK (Thr180/Tyr182)Rabbit mAb (4511)购于美国 Cell Signaling Technology (CST)公司。BST-2 (M-100) (Rabbit pAb,sc-99193) 购于美国 Santa 公司。APC Goat anti-mouse IgG poly 4053 (405308)、HRPanti-HA.11 抗体(901519)购于 Biolegend 公司。GAPDH (MB001)购于美国 Bioworld Technology公司。小鼠抗 β-Actin 单克隆抗体(A5441)购于美国 Sigma 公司。小鼠抗 CD317 单克隆抗体(1C12C6)由本文作者团队制备。HRP-anti-Flag抗体(200-303-383)购于 Rockland 公司。
2.2 实验方法
2.2.1 细胞培养
THP-1 细胞采用 RPMI-1640 完全培养基(含10% 血清和 1% 青链霉素混合双抗)进行培养、传代;HEK293T 细胞采用 DMEM 完全培养基(含 10% 血清和 1% 青链霉素混合双抗)进行传代培养。培养箱环境为 37 ℃、5% CO2。
2.2.2CD317敲基因小鼠制备及基因型鉴定
本实验委托赛业生物公司制备CD317敲基因小鼠——利用 CRISPR/Cas9 技术敲除CD317位于 1~3 号外显子附近长度约为 2 500 bp 的DNA 片段。小鼠基因型鉴定采用聚合酶链式反应(Polymerase Chain Reaction,PCR)扩增方法,所用 gRNA 序列及 PCR 扩增引物序列如下。


2.2.3 小鼠腹腔巨噬细胞诱导和提取
选取 6~8 周龄小鼠,连续 3 天向其腹腔注射 1 mL 3% (w/v)的巯基乙酸肉汤培养基,然后脱颈处死;用 75% 的乙醇溶液浸泡小鼠 5 min后,用注射器向其腹腔注射 10 mL 经 4 ℃ 预冷的 PBS 缓冲液;轻揉小鼠腹部 3 min 后,将其腹腔内液体吸出并置于离心管中;400 g 离心10 min,弃上清液,用含 10% 胎牛血清(Fetal Bovine Serum,FBS)的 DMEM 培养基将细胞密度调整至 1.5×106cell/mL 并接种到细胞板中。在 5% CO2、37 ℃ 恒温箱培养过夜后,用 PBS 缓冲液冲洗去除未贴壁的细胞,即得到小鼠腹腔巨噬细胞(Peritoneal Macrophages,PMs)。本文实验动物方案经由中国科学院深圳先进技术研究院动物伦理委员会审查(SIAT-IACUC-210310-YYSZGZ-A1783)通过。
2.2.4 THP-1 来源的人巨噬细胞诱导
THP-1 来源的人巨噬细胞(THP-1 Drived Macrophages,TDMs)采用 PMA 诱导法,取状态良好的 THP-1 细胞,离心(150 g、5 min)并重悬后进行细胞计数,调整细胞密度至 1×106cell/mL,同时加入 25 ng/mL PMA,混匀后将其接种到细胞板中,在培养箱诱导分化 18 h 后,用 PBS 缓冲液清洗 3 遍并加入完全培养基。
2.2.5 转染
采用汇合度 60%~80% 左右、生长状态良好的细胞作为受体细胞,利用 Lipofectamine 3000 转染试剂进行小干扰 RNA(siRNA)或质粒的转染,Plvx-hCD317-HA 质粒由本文作者所在实验室构建,pEnter-hTRAF6-flag-His 和 pEnterhMyD88-flag-His 购于山东维真生物科技有限公司;所用 siRNA 序列共 3 个。

2.2.6 RNA 提取、逆转录及实时荧光定量 PCR
PMs 铺板过夜或者 TDMs 转染 siRNA 48 h后,去除培养基,加 LPS 刺激并于刺激后 0 h、2 h、4 h、6 h 收集细胞。使用 TRIZOL 剂提取总 RNA,进一步利用试剂盒将 RNA 反转录成cDNA,以用于实时荧光定量 PCR 检测。所用引物由金唯智公司合成,引物序列见表 1。扩增结束后,以ATCB和Atcb为内参基因,采用 2-ΔΔCT方法对数据进行相对定量分析。

表1 引物序列Table 1 Primer sequence
2.2.7 免疫共沉淀(co-IP)
将 Plvx-hCD317-HA/pEnter-hTRAF6-flag-His 或 Plvx-hCD317-HA/pEnter-hMyD88-flag-His(1 μg/1 μg)质粒组合转染至 HEK293T 细胞中。48 h后收集细胞,将其用 IP(Immunoprecipitation)裂解液重悬并在冰上裂解 30 min;将裂解液以13 000 r/min 离心 15 min 后收集上清液;每个样品取部分作为上样对照(Input),将剩余上清液平均分配后分别加入 1 μg 小鼠抗 Flag 抗体或小鼠IgG 抗体;混匀后将其在 4 ℃ 旋转孵育 1 h;随后再将其加入经 IP 裂解液洗涤的 Protein A/G 磁珠(ThermoFisher,88802),4 ℃ 转动孵育过夜。孵育结束后,以预冷的 IP 裂解液洗涤磁珠 5 次,用 2×SDS Loading Buffer 重悬磁珠,并于 100 ℃加热 8 min 进行蛋白变性。最后样品采用蛋白质免疫印迹法(Western Blot)进行检测,所用抗体为 HRP-anti-HA.11(1∶5 000)和 HRP-anti-Flag(1∶20 000)。
2.2.8 蛋白质免疫印迹法
收集细胞并用 RIPA 裂解液重悬,冰上裂解30 min 后,以 13 000 r/min 离心 15 min,转移上清液至新的 EP 管;取适量样品用 BCA 定量法测定蛋白浓度,其余加入 5×SDS Loading Buffer 混匀至终浓度为 1×,并在 100 ℃ 变性 8 min。蛋白样品经 SDS-聚丙烯酰胺凝胶电泳、转膜及 5%牛血清白蛋白(Bovine Albumin)封闭后,加入按建议比例稀释的一抗工作液,置于往复式摇床 4 ℃孵育过夜;使用 PBST 充分洗涤以去除残留抗体,加入辣根过氧化物酶(Horseradish Peroxidase,HRP)标记的二抗,室温孵育 1 h;PBST 清洗后用多功能成像仪检测蛋白信号。
2.2.9 流式分析
用 100 ng/mL LPS 刺激 PMs 后收集细胞,将其用 PBS 充分洗涤并重悬,加入 Anti-CD317(M100)抗体(1/100),在 4 ℃ 下孵育30 min;经 PBS 充分洗涤以去除未结合抗体,而后加入 APC anti-mouse IgG(1/200),避光孵育30 min 后,再用 PBS 洗涤 3 遍,流式检测APC(别藻青蛋白) 荧光信号。
2.3 统计分析
使用 GraphPad Prism 8.0 软件对所有组内及组间数据进行分析并作图。所有数值均以“平均值±标准误差”表示;采用非配对 t 检验分析组间数据是否具有统计学差异。当P<0.05 时,认为两组数据间具有统计学差异;当P<0.01 时,认为两组数据间具有显著统计学差异;当P<0.001时,认为两组数据间具有极显著统计学差异。
3 实验结果
3.1 TLR4 信号激活上调 CD317 的表达
为了研究 CD317 对 TLR4 信号转导的作用,首先用 LPS 刺激小鼠腹腔内的巨噬细胞(PMs)和 THP-1 来源的人巨噬细胞(TDMs);然后,分别于 LPS 刺激后 0 h、2 h、4 h、6 h 收集细胞;最后,利用荧光定量 PCR 技术对CD317mRNA的表达水平进行检测。图 1(a,b)结果显示,LPS刺激显著促进小鼠和人巨噬细胞中CD317的表达。进一步利用蛋白质免疫印迹法或流式细胞术对蛋白水平进行验证,结果与 mRNA 水平的变化趋势一致,LPS 刺激可以显著提高 PMs 和TDMs 细胞中 CD317 的表达(图 1(c,d))。这些结果说明 CD317 能够被 TLR4 信号诱导表达,极可能参与 TLR4 信号转导或功能实现过程。

图1 LPS 刺激对 THP-1 诱导的巨噬细胞和小鼠原代腹腔巨噬细胞 CD317 表达的影响Fig.1 The expression of CD317 in THP-1-induced macrophage and primary peritoneal macrophage induced by LPS
3.2 CD317 基因敲除小鼠构建
为了研究 CD317 是否参与 TLR4 信号转导调控,利用 CRISPR/Cas9 基因编辑技术靶向敲除CD317基因 1~3 号外显子,构建基因敲除小鼠(图 2(a)),并利用 PCR 对子代小鼠基因进行鉴定,结果如图 2(b)所示。与杂合子小鼠相比,纯合子基因敲除鼠由于片段缺失,Primer-Wt/Het-R引物失去互补位点,PCR 反应只能由 Primer-F和 Primer-R 介导,因此仅约有 540 bp 的扩增片段。这表明成功获得了CD317基因敲除小鼠。随后,进一步分离野生型(Wild Type,WT)和敲基因(Knock Out,KO)小鼠的腹腔巨噬细胞并利用流式细胞术对 CD317 表达进行检测,从蛋白水平对敲除效果进行验证。图 2(c)结果显示,不管是在正常状态还是 LPS 刺激后,KO 小鼠腹腔巨噬细胞均未检出阳性信号;而 WT 小鼠的CD317 表达阳性且表达水平随着 LPS 刺激的增强而升高。该结果从蛋白水平验证了CD317的敲除效果。
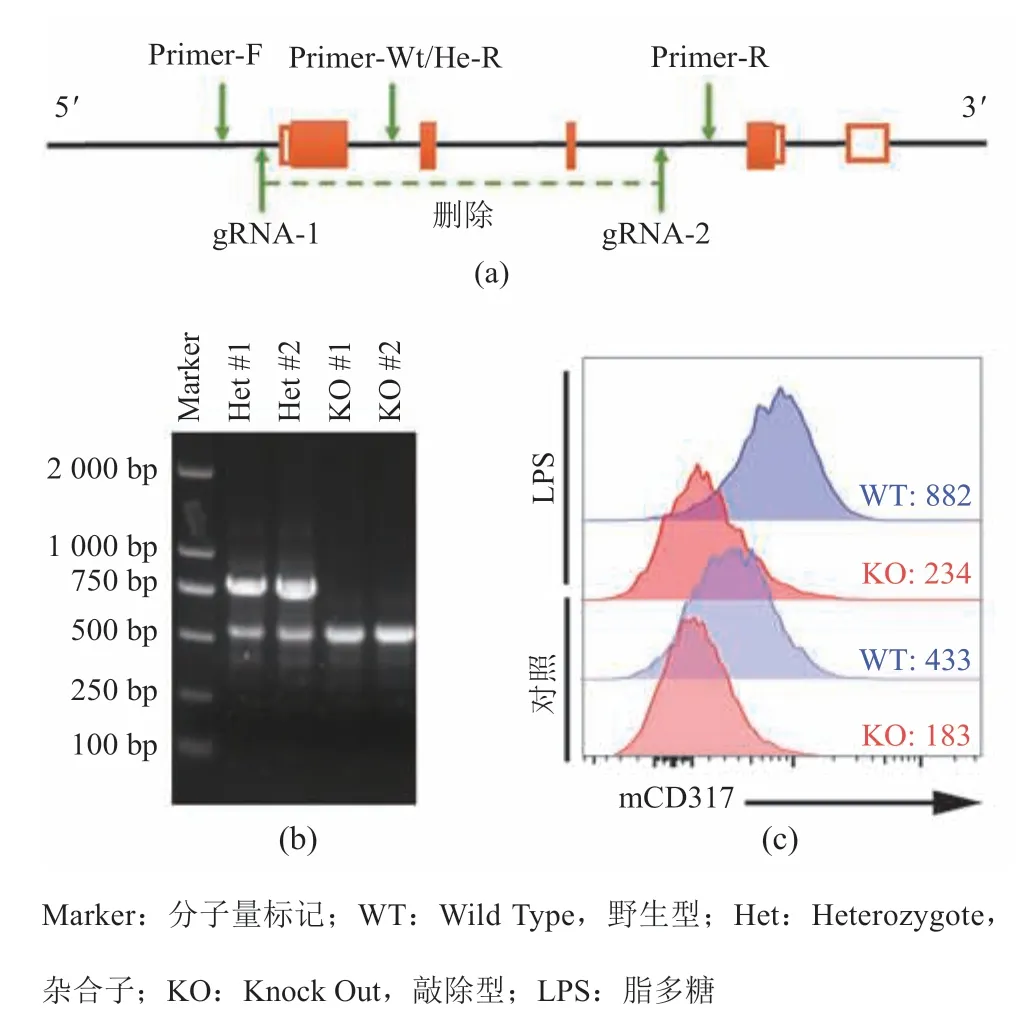
图2 CD317 基因敲除鼠构建及鉴定Fig.2 Creation and identification of CD317 knockout mouse
3.3 CD317 敲减/敲除抑制促炎细胞因子的表达
为了研究 CD317 对 TLR4 信号转导的影响,首先用 LPS 刺激 WT 和CD317KO 小鼠来源的腹腔巨噬细胞,于不同时间点收集细胞。通过实时荧光定量 PCR 技术对CD317以及Tnf、Il1b、Il6等促炎细胞因子 mRNA 的表达进行检测,结果如图 3(a~d)所示。LPS 以时间依赖的方式上调WT 小鼠腹腔巨噬细胞中CD317以及相关促炎细胞因子的表达,而 KO 小鼠腹腔巨噬细胞由于缺失了CD317,Tnf、Il1b、Il6以及Il12bmRNA 的表达都受到不同程度的影响,总体水平显著低于WT 小鼠腹腔巨噬细胞。结果表明,CD317 促进TLR4 介导的促炎细胞因子表达。这一观点在人源 TDMs 细胞中也得到了验证,如图 3(e~i)所示。这表明CD317敲减显著抑制了 LPS 诱导的CD317 以及相关促炎细胞因子的表达。
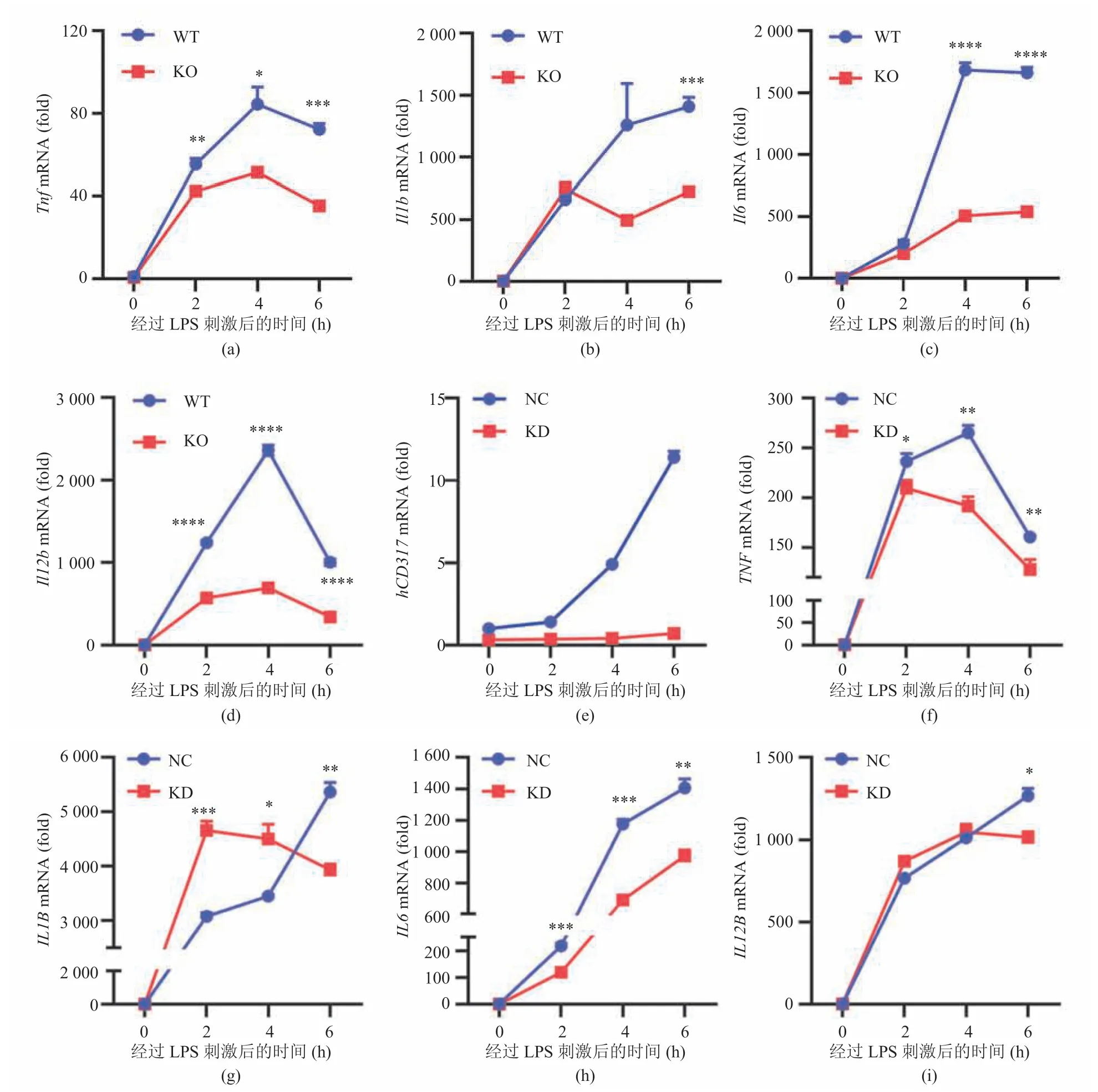
图3 CD317 敲减/敲除抑制巨噬细胞促炎细胞因子表达水平Fig.3 CD317 knockout/knockdown inhibited the expression of pro-inflammatory cytokines in macrophages
3.4 CD317 敲减/敲除抑制 NF-κB 信号通路
为进一步研究 CD317 影响 TLR4 介导的促炎细胞因子产生的机制,对 TLR4 下游关键的通路进行分析。结果发现,CD317敲除显著抑制了腹腔巨噬细胞中 NF-κB 的活化,而对 p38 信号通路基本没有影响(图 4(a))。这一结果在CD317敲减的 TDMs 细胞模型中也得到了验证(图 4(b))。

图4 CD317 敲减/敲除抑制 LPS 诱导的巨噬细胞 NF-κB 通路活化Fig.4 CD317 knockdown/knockout suppresses LPS-mediated NF-κB activation in macrophage
3.5 CD317 和 MyD88、TRAF6 存在相互作用
为进一步探索 CD317 参与 TLR4 信号调控的可能机制,将 CD317 分别和 MyD88、TRAF6表达质粒在 HEK293T 中共表达,然后利用免疫共沉淀方法研究 CD317 是否能够与 TLR4 下游关键蛋白 MyD88、TRAF6 相互作用。图 5显示,CD317 能够与 MyD88、TRAF6 相互作用。因此,CD317 可能通过与 MyD88、TRAF6的相互作用来增强 NF-κB 活化,但具体的分子机制还需要进一步研究。
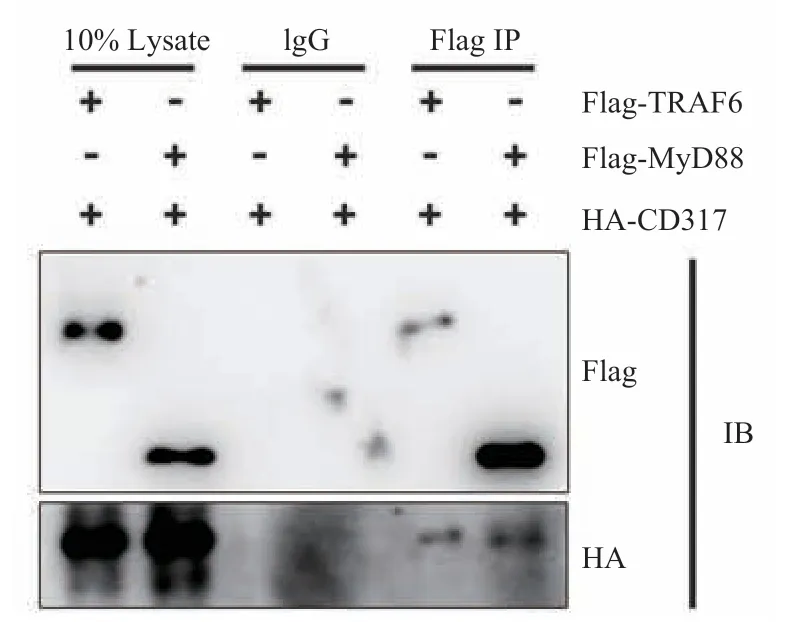
图5 CD317 与 MyD88、TRAF6 存在相互作用Fig.5 CD317 interacts with MyD88 and TRAF6
4 讨论与分析
TLR4 是一个重要的固有免疫识别受体,在机体抗感染免疫中发挥重要作用。TLR4 信号异常不仅与细菌感染相关,同时也是一些自身免疫疾病,如类风湿性关节炎(Rheumatoid Arthritis)、系统性红斑狼疮(Systemic Lupus Erythematosus)等的致病因素[26-28]。因此,TLR4 信号需要被精准调控,以确保其适度的活化。对 TLR4 信号转导关键调控蛋白的研究和鉴定,有助于理解 TLR4免疫机制和开发新的临床干预方法。
尽管 CD317 具有病毒束缚功能,但人类免疫缺陷病毒(Human Immunodeficiency Virus,HIV)、乙型肝炎病毒(HBV)、SARS-CoV 等多种病毒可以通过不同机制逃避该作用[31-32]。以 HIV为例,病毒可以通过 Vpu、Env 等蛋白与 CD317结合从而将其从细胞膜移除或靶向蛋白酶体途径的降解[20,33]。这种病毒介导的逃避机制可能无意中降低了被感染巨噬细胞 CD317 的表达水平,从而损伤 TLR4 信号转导,造成病毒/细菌复合感染。世界卫生组织(WHO)统计数据显示,HIV-1感染者患结核病的风险是未感染者的 16~27 倍,仅 2015 年 1 年就有 39 万艾滋病毒感染者的死亡与结核病有关[34]。结核杆菌的主要免疫清除机制是巨噬细胞介导的吞噬作用以及呼吸爆发产生的杀菌效应[35]。巨噬细胞通过 TLR4 等模式识别受体识别结核杆菌[36],诱发炎症反应抵抗感染[37],对结核病的转归具有关键的作用。在 HIV感染过程中,除了 CD4+T 细胞,巨噬细胞也是其主要的宿主细胞[38]。因此,HIV 感染巨噬细胞后,Vpu 等蛋白介导的 CD317 降解可能损伤 TLR4信号转导,导致巨噬细胞天然免疫应答受到抑制,无法有效应对结核分支杆菌等微生物的侵袭。从这个角度来看,本文研究结果为临床上 HIV 患者易感结核杆菌提供了一种潜在的解释,也为 HIV 等病毒损伤固有免疫应答提供了新的证据。
5 结论
本研究利用敲基因小鼠腹腔巨噬细胞和THP-1 来源的人巨噬细胞,较为系统地研究了CD317 对 TLR4 信号通路的影响。结果显示,CD317 促进 TLR4 介导的 NF-κB 活化及促炎细胞因子的产生,并初步发现 CD317 与 TLR4 信号转导关键蛋白 MyD88、TRAF6 存在相互作用,为分子机制探索指明了方向。该研究结果不仅丰富了对 CD317 功能尤其是其在抗感染天然免疫调控中的作用的认识,也为相关疾病的治疗策略开发提供新的靶点和理论指导。

