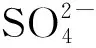硫酸根对钙基层状双金属氢氧化物去除SDS的影响
何 涛,褚航,相明雪,章 萍,b*
(南昌大学a.资源环境与化工学院,江西 南昌 330031;b.鄱阳湖环境与资源利用教育部重点实验室,江西 南昌 330047)
十二烷基硫酸钠(sodium dodecyl sulphate,简称SDS),一种常见的阴离子型表面活性剂,常被用于工业中的金属处理、矿物浮选以及日常生活中的洗涤、杀虫等产品中[1]。研究发现含高浓度SDS的工业及生活废水若不经处理直接排放会对环境和人体造成严重危害[2]。目前,针对废水中SDS的去除主要有生物降解、化学沉淀及吸附等方法,其中吸附法因处理成本低和操作简单等优点应用最为广泛[3]。

1 实验方法
1.1 实验材料和仪器
试剂:氧化钙(CaO,分析纯);氢氧化铝(Al(OH)3,分析纯);氯化钙(CaCl2,分析纯);十二烷基硫酸钠(SDS,分析纯)。
仪器:X射线衍射仪(XRD,D8 ADVANCE,德国BRUKER公司);傅里叶红外光谱分析仪(FT-IR,Nicolet Avatar 370,美国Thermo公司);场发射扫描电子显微镜(SEM,JSM 6071F,日本电子株式会社);电感耦合等离子体原子发射光谱仪(ICP-AES,EA 3000,意大利Eurovector公司);热重-差热分析仪(TG-DTA,TGA 4000,美国PerkinElmer公司);超高效液相色谱仪(Ulti Mate 3000,美国Thermo Fisher Scientific公司);数显鼓风干燥箱(GZX-9140 MBE,上海博讯实业有限公司医疗设备厂);高速离心机(TG16G,北京华瑞科学器材);电子天平(AR224CN,奥豪斯仪器(常州)有限公司)。
1.2 CaAl-LDH-Cl的制备
将CaO和Al(OH)3按摩尔比3:1放置于石英坩埚中,于300 ℃~1 350 ℃高温下混合均匀后压片,保温4~5 h。将所得固样研磨均匀,重复上述操作数次直至产物中游离的CaO含量低于0.5%时,即制得C3A。称取一定量C3A,在氮气氛围下将其投至饱和氯化钙溶液中,于55 ℃下振荡18 h,震荡后过滤悬浮液并用超纯水洗涤固样,直至滤液中无Cl-后,将固样于105 ℃下烘干并研磨,即制得CaAl-LDH-Cl。
1.3 吸附实验
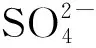
Qe=(C0-Ce)V/m
(1)
式中,C0为SDS的初始浓度,mmol·g-1;Ce为吸附后的平衡浓度,mmol·g-1;V为溶液的体积,L;m为CaAl-LDH-Cl的质量,g。
1.4 材料表征
对反应前后固样形貌进行表征。利用X射线衍射仪对样品进行XRD分析,测试条件为:铜Kα射线,管电压40 kV,管电流100 mA,扫描角度1°~5°,5~65°,扫描速度0.5°·min-1,6°·min-1;利用傅里叶红外光谱仪进行FTIR分析,测试范围为4 000~400 cm-1,分辨率为4 cm-1;利用场发射扫描电子显微镜进行SEM分析,测试电压为30 kV。
2 结果与讨论
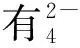
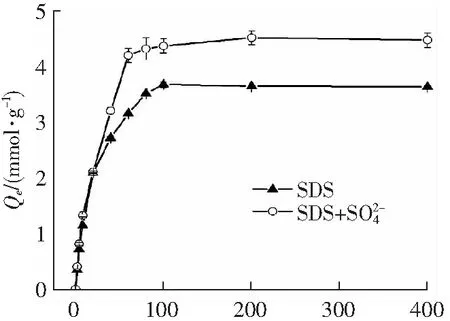
Initial Concentration of SDS/(mmol·L-1)
Langmuir吸附等温线方程:
1/Qe=1/(Qm·KL·Ce)+1/Qm
(2)
Freundlich吸附等温线方程:lgQe=lgKF+1/n·lgCe
(3)
式中,Ce为吸附平衡时SDS的浓度,mmol·L-1;Qe为平衡吸附量,mmol·g-1;Qm为饱和吸附量,mmol·g-1;KL为Langmuir平衡参数;KF和n为Freundlich平衡参数。Freundlich和Langmuir吸附等温线见图2,拟合参数结果见表1。
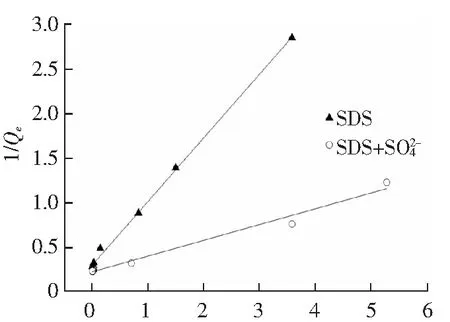
1/Ce(a) Langmuir model
通过比较表1两种模型拟合的相关性系数R2
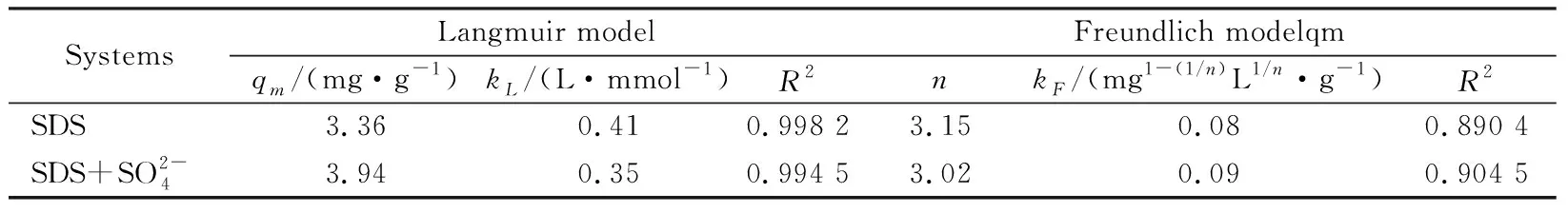
表1 CaAl-LDH-Cl对SDS的等温吸附拟合参数
2.2 固体产物结构、形貌分析
2.2.1 XRD分析
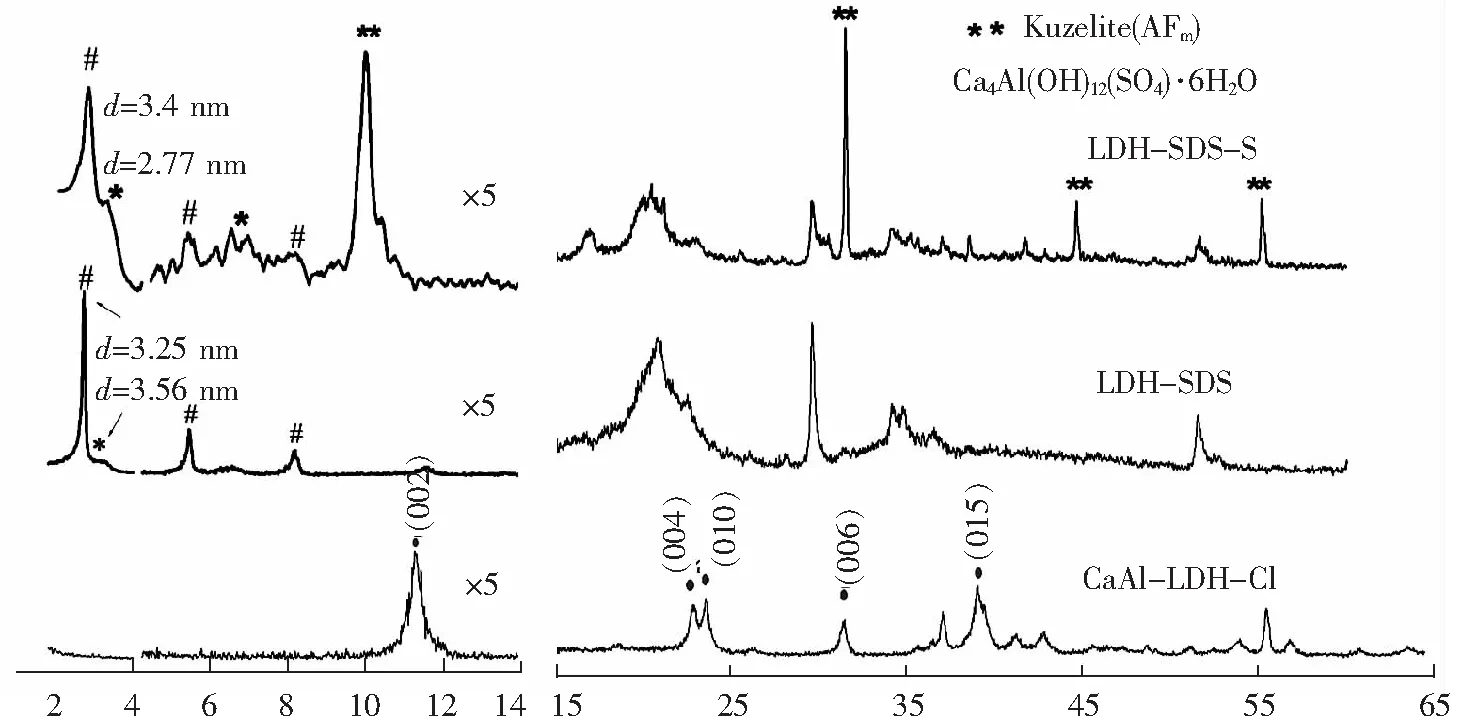
2θ/degree
2.2.2 FTIR分析
图4为SDS,CaAl-LDH-Cl,LDH-SDS和LDH-SDS-S的FTIR图谱。由图可知,吸附SDS前,在400~800 cm-1波段出现金属氧键M-O的伸缩振动峰(M为Ca或Al);在1 620~1 660 cm-1波段内出现层间水分子的弯曲振动峰;在3 500~3 600 cm-1波段出现由层板羟基和层间水分子伸缩振动引起的O-H振动峰[11],说明实验成功制得CaAl-LDH-Cl。CaAl-LDH-Cl吸附SDS后的产物在1 475 cm-1处出现C-H的吸收振动峰,1 255~1 050 cm-1波段出现S=O的弯曲振动峰[12],证实

λ/cm
2.2.3 SEM分析


图5 CaAl-LDH-Cl(a),LDH-SDS(b)和LDH-SDS-S(c)的SEM图谱
2.2.4 热重分析
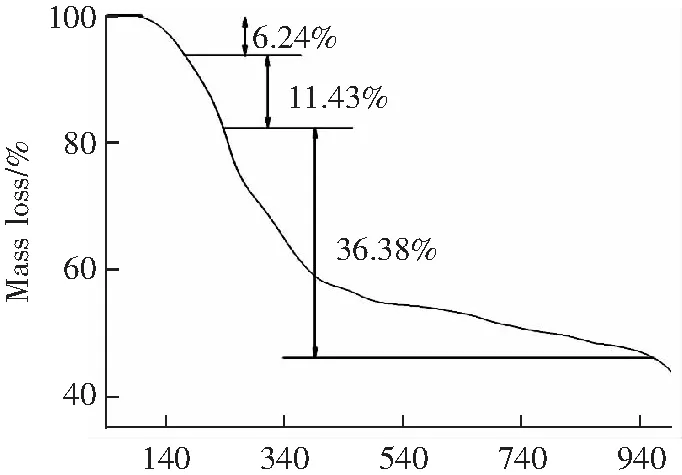
T/℃(a)
3 反应机理


图7 硫酸根对CaAl-LDH-Cl去除SDS的影响机理图
4 结论