红叶石楠叶斑病病原鉴定及其生物学特性研究
朱轶慧 刘玉军 毕飞虎 蒋欢 赵本文 鲁林琴 陈名君

摘要 红叶石楠是我国园林绿化常用的彩叶树种。近来,安徽合肥市红叶石楠叶斑病发生严重,导致叶片枯萎脱落甚至植株死亡,严重影响其观赏价值。为科学防控红叶石楠叶斑病,对其病原菌种类和生物学特性进行了研究。本研究采用组织分离法获得红叶石楠叶斑病的病原菌,并通过显微形态观察结合系统发育树的方法,最终将其病原菌鉴定为小孢拟盘多毛孢Pestalotiopsis microspora。生物学特性测定结果表明:适宜菌丝生长的最佳碳源和最佳氮源分别为蔗糖和蛋白胨,最适生长温度和pH分别为25℃和6。研究结果为该病害的正确诊断提供了较为可靠的科学依据。
关键词 红叶石楠; 叶斑病; 小孢拟盘多毛孢; 分子鉴定; 生物学特性
中图分类号: S 436.85
文献标识码: A
DOI: 10.16688/j.zwbh.
2020280
Identification and biological characteristics of the pathogen causing leaf spot disease on Photinia×fraseri
ZHU Yihui1, LIU Yujun2, BI Feihu1, JIANG Huan1, ZHAO Benwen1, LU Linqin1, CHEN Mingjun1*
(1. Anhui Provincial Key Laboratory of Microbial Control, Anhui Agricultural University, Hefei 230036, China;
2. Anhui Academy of Science and Technology, Hefei 230031, China)
Abstract
Photinia×fraseri has commonly been used as color leaf landscaping tree in China. Recently, the leaf spot disease of Photinia×fraseri has seriously occurred in Hefei, Anhui, and causes the leaf to wither and fall off or the plant to die, which greatly lost its ornamental value. In order to effectively control the disease, the identification and biological characteristics of the pathogen were investigated. The pathogen was obtained by tissue isolation from the infected Photinia×fraseri leaves, and was identified as Pestalotiopsis microspora according to microscopically morphological observation and phylogenetic tree. The results showed that the optimal carbon source and nitrogen source were glucose and peptone, respectively. The optimal growth temperature and pH value were 25℃ and 6.0, respectively. The results will provide a scientific basis for the correct diagnosis of the leaf spot disease on Photinia×fraseri.
Key words
Photinia×fraseri; leaf spot disease; Pestalotiopsis microspora; molecular identification; biological characteristics
红叶石楠Photinia×fraseri Dress属蔷薇科、石楠属的杂交树种,为灌木或常绿小乔木,因其鲜红的嫩叶、新梢而得名[1],亦有“红叶绿篱之王”和“红衣卫士”等美誉[2]。‘红罗宾和‘红唇是红叶石楠中常见的两个品种,前者因为更加鲜艳亮丽的叶子,更具有观赏性。红叶石楠凭借其强大的生命力,在温暖潮湿和低温干燥的环境下都可以良好生长,色彩持久鲜艳。因此,在城市园林建设中应用越来越广泛[3],也常被用于道路边坡固土建设[4]。近年来,红叶石楠引起研究者們极大兴趣,但主要集中在红叶石楠栽培技术[5]、生理特征[6]和干旱胁迫[7]等方面。随着红叶石楠种植范围和规模的扩大,病害发生情况也日趋严重[8]。发生在红叶石楠上的常见病害多为叶部病害。如:红叶石楠叶斑病、灰霉病、炭疽病、锈病、白粉病、煤污病、黄化病等[8]。但有关红叶石楠病害病原菌的分离鉴定和生物学特征研究少见报道。
近年来,对合肥市区红叶石楠病害调查发现,有一种叶斑病对红叶石楠的为害程度十分严重且发展迅速。染病初期,叶片出现零星褐色小斑点,发病后期褐色斑点布满整个叶面导致整叶枯死。病原菌可以多次侵染,所以病害经常反复发生,严重影响了红叶石楠的观赏价值。本文采集感病叶片,通过组织分离、柯赫氏法则验证、病原菌形态学观察并结合系统发育树等方法,鉴定了该病害的病原种类,系统研究了病原菌的生物学特性,为该病害的正确诊断和及时准确预测预报奠定了理论基础。
1 材料与方法
1.1 材料采集
2019年春季,在合肥市安徽农业大学校园及农萃园内,采用五点取样法采集约20年生的红叶石楠感病叶片。每点随机选取10株红叶石楠,每株红叶石楠随机选取10片病叶做标记,每15 d左右记录观察症状发生发展状况。
1.2 病原真菌的分离与纯化
本试验采用组织分离法分离病原真菌,将每片病叶病斑及周围组织一并剪下作为分离材料。分离材料先用无菌水清洗5 s,重复3次,再在75%乙醇中消毒5 s,最后在无菌水中清洗5 s,并用无菌纸吸去水分,放置在无菌培养皿上晾干。用剪刀将分离材料剪成约3 mm×3 mm小块,于超净工作台中将剪好的病组织转移至PDA培养基(葡萄糖20 g/L、去皮土豆200 g/L、琼脂20 g/L)上。每个培养皿中均匀放置3片病叶组织,并在培养皿上注明日期、编号,置于25℃的培养箱中黑暗培养。约4 d后挑取病叶组织边缘的菌丝进行分离纯化,纯化得到的菌株储存于4℃冰箱备用。
1.3 病原菌形态观察和分子鉴定
将纯化后得到的菌株转接到PDA培养基上,置于25℃的培养箱中培养7 d左右,记录菌落正反面颜色、形状、质地等特征。待产生孢子后,显微镜下观察产孢结构及分生孢子形状和大小,并拍照记录。
将从自然感病叶片分离的菌株AH1900408、AH190412、AH190413、AH190414,柯赫氏法则试验分离得到的菌株AH190409、AH190410和AH190411接种于PDA培养基上,25℃培养箱中培养约3 d,待长出大量菌丝后收集菌丝并采用CTAB法提取总DNA,以ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)为引物进行PCR扩增并测序,测序整理后得到的序列在NCBI网站上进行比对,参考文献并从GenBank中筛选出相关菌株的ITS序列,用MEGA 6.06软件进行系统发育分析,以狭窄平截盘多毛孢Truncatella angustata为外群,构建rDNA-ITS序列系统发育树。
1.4 致病性测定
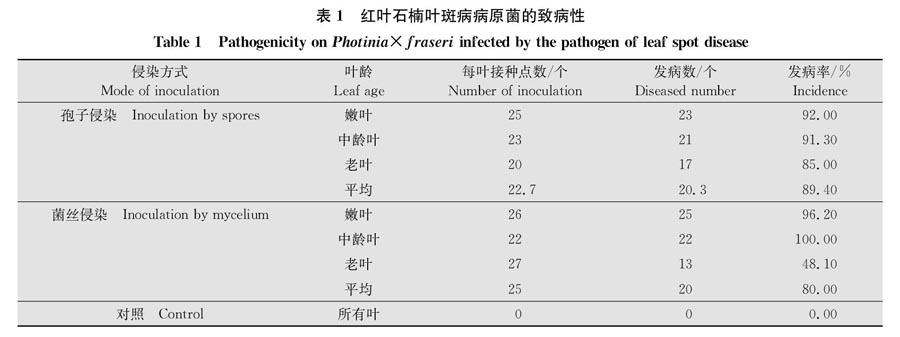
采用孢子接种法和菌丝接种法对菌株进行室内离体致病性测定,选择健康红叶石楠的叶片,挑选老叶、中龄叶和嫩叶3种状态的叶片进行有伤接种(针刺法)处理。用无菌的昆虫针刺伤红叶石楠叶片,取菌液浓度为1.0×106孢子液10 μL和相同培养时的约3 mm菌丝块点接在上述接种点上(每种叶片各5片,每片叶片5个接种点)。以点接无菌水为空白对照。接种后置于生物测定箱中25℃恒温保湿培养(湿度80%,L∥D=12 h∥12 h),每天观察记录并计算其发病率,再对新产生的病斑进行病原菌的分离。发病率=发病叶片数/总叶片数×100%。
1.5 生物学特性分析
1.5.1 最佳碳源试验
在PDA培养基里分别加入2%的乳糖、葡萄糖、麦芽糖、蔗糖和可溶性淀粉,配成不同碳源的培养基,并设置PDA为空白对照组, 121℃灭菌20 min。用直径5 mm的打孔器取菌饼接种于上述的培养基上,于25℃培养箱中培养,每个处理重复5次。各处理在培养1 d后采用十字交叉法每天进行测量,记录菌落的平均直径。试验结果用SPSS进行差异显著性分析。菌丝生长速度(mm/d)=菌落平均直径(mm)/生长天数(d)。
1.5.2 最佳氮源试验
在配制好的PDA中分别加入0.2%的蛋白胨、硫酸铵、硝酸铵、硝酸钠、牛肉膏和尿素,配制成本研究所需的培养基。试验方法与1.5.1相同。
1.5.3 最适温度试验
配制PDA培养基,接种与数据处理方法同1.5.1。分别于16、20、23、25、28℃与37℃的培养箱里进行培养,每个温度重复5次。
1.5.4 最适 pH试验
配制PDA培养基,用盐酸和氢氧化钠将pH分别调到4、5、6、7、8、9,接种与数据处理方法同1.5.1,每组重复5次。接种后置于25℃的恒温培养箱中培养。
2 結果与分析
2.1 红叶石楠叶斑病病症、病原菌形态特征及致病性测定
在自然发病的植株上,病菌既可危害嫩叶也可危害中龄叶和老叶。感病初期,叶片上产生褐色小斑点,通常整个叶片都可感染。之后病斑逐渐扩大,呈不规则形,病健交界处有一圈较窄的黄色晕圈,内侧为较宽的红色晕圈,病斑中央颜色变成灰白色;发病后期叶片正面着生黑色颗粒物且整个叶片变成黑黄色枯萎(图1a)。经组织分离得到的菌落为圆形具轮纹,菌丝初期白色,后期颜色加深,呈现灰白色,绒毛状;菌落边缘整齐,菌落背面初期呈黄白色,后期呈黄褐色和褐色,轮纹较明显。培养10 d左右,菌落上产生黑色墨汁状分生孢子团,初期颗粒较小,后逐渐增大,分布较密(图1b~c)。
菌株培养在PDA培养基上7 d左右可长满直径90 mm的培养皿。菌落圆形,取菌丝于载玻片上置于显微镜下观察,分生孢子梗短,无色;分生孢子为纺锤形,具有4个隔膜将其分割成5个细胞,隔膜明显但分割处缢缩不明显,孢子直或稍弯曲,(22.5~26.4)μm×(6.2~8.3)μm。中间3个细胞有色,成熟后,3个有色细胞中,前面两个细胞颜色最深,为褐色,第3个有色细胞颜色较浅,为淡褐色;两端细胞无色透明,为三角形,顶端细胞着生2~4根(多数为3根)无色附属丝,不分枝,长约26~38 μm;基部细胞着生1根中生式尾毛,长2.5~6.2 μm(图1)。从该菌形态特征,查阅文献[9-11]可初步鉴定为小孢拟盘多毛孢Pestalotiopsis microspora。
室内接种试验结果表明,室内孢子接种的平均发病率为894%,菌丝接种的平均发病率为800%。室内接种3 d左右即可观察到病斑,且病斑发展迅速(图1f,h)。组织分离法获得接种病叶中的病原菌,与林间采集病叶上分离得到的病原菌形态特征一致(图1e)。通过柯赫氏法则证明,所分离得到的病原菌为红叶石楠叶斑病的致病菌。
2.2 病原菌的分子鉴定
将病原菌AH190408、AH190409、AH190410、AH190411、AH190412、AH190413和AH190414的PCR产物测序得到的ITS序列,通过与GenBank数据库中核酸序列BLAST同源性比对,结果表明,分离得到的菌株与小孢拟盘多毛孢菌P. microspora的同源性达100%。
将分离得到的菌株rDNA-ITS序列与GenBank中相关菌株的基因序列通过软件BioEdit进行比对,再运用MEGA 6.06软件构建基于邻接法的系统发育树。从构建的发育树可以看出,从自然感病病叶上分离得到的病原菌菌株AH1900408、AH190412、AH190413、AH190414以及通过柯赫氏法则试验分离得到的菌株AH190409、AH190410、AH190411,都与模式菌小孢拟盘多毛孢菌P. microspora菌株DQ456865和DQ001009亲缘关系最近,为同一分支(图2),进一步说明所分离的病原菌为小孢拟盘多毛孢。结合形态特征、分子鉴定以及致病性测定结果,可以确定红叶石楠叶斑病病原为小孢拟盘多毛孢。
2.3 红叶石楠叶斑病的生物学特性
2.3.1 不同碳源对病原菌菌落生长的影响
由表2可知,小孢拟盘多毛孢在不同的碳源条件下,菌丝生长势和生长速度差异并不明显。以蔗糖为碳源时,生长速度最快,达到5.29 mm/d,菌丝长势良好。葡萄糖和麦芽糖作为碳源时,生长速度接近,分别为5.21 mm/d和5.19 mm/d,长势良好。乳糖为碳源时的生长速度 5.10 mm/d,菌丝洁白且致密。碳源为可溶性淀粉时生长速度为485 mm/d,菌丝颜色浅白且长势较差。说明该小孢拟盘多毛孢对于各种碳源的吸收都比较好,最适碳源为蔗糖。
2.3.2 不同氮源对病原菌菌落生长的影响
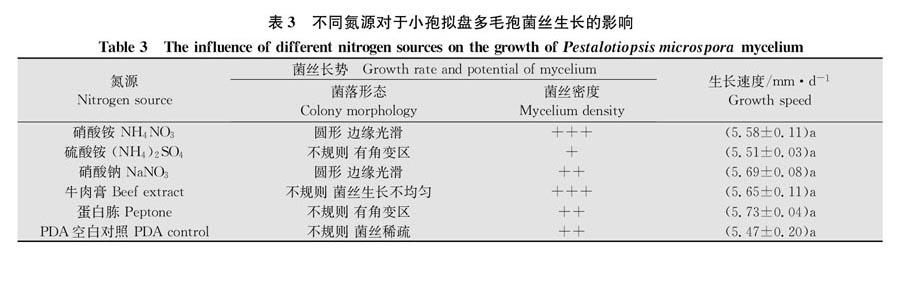
由表3可知,在不同的氮源条件下,菌丝的生长势及生长速度差异不明显。比较而言,当蛋白胨作为氮源时,菌丝生长速度最快,可以达到5.73 mm/d,菌丝洁白且致密。当提供的氮源为NH4NO3、NaNO3和牛肉膏时,菌丝生长速度较快,分别为558、5.69 mm/d和5.65 mm/d,生长旺盛,菌丝洁白致密。但当氮源为(NH4)2SO4时,菌丝生长速度略低,为5.51 mm/d。由此可知,该菌对有机氮和无机氮吸收的差异并不明显,但相对而言有机氮吸收比无机氮吸收得更好。在供试有机氮中以蛋白胨为最佳,无机氮中以NaNO3为最佳。
2.3.3 温度对病原菌菌落生长的影响
由表4可知,小孢拟盘多毛孢在16~28℃下均能生长。当温度为16~25℃时,温度与生长速度呈正相关,即温度越高生长速度越快。其中,当温度为25℃时,菌丝生长势旺盛,且生长速度最快,可达到7.82 mm/d。温度为28℃时,菌丝生长速度次之,生长速度为7.42 mm/d。当温度为37℃时,菌丝生长明显受到抑制,生长微弱,仅见微小菌落。
2.3.4 pH对病原菌菌落生长的影响
由图3可知,小孢拟盘多毛孢在pH为6~9条件下均可生长。pH为4和5时培养基为液态,菌丝生长速度也明显受到抑制。pH为6时菌丝生长速度略快,培养5 d菌丝生长直径达7.293 cm。但从图3可见,生长后期4个pH对菌丝生长的影响区别不明显。由此得出,pH过高或过低都不利于该菌丝生长,且其生长最适宜的pH为6。
3 讨论
拟盘多毛孢菌属真菌在自然界中广泛存在,其大多数种类为植物病原物[12]。本研究分离鉴定出红叶石楠叶斑病病原为小孢拟盘多毛孢,这一结果与管斌等[13]研究结果相同。小孢拟盘多毛孢寄主范围广泛,是植物重要的病原真菌。熊朝伟等[14]系统研究了油茶叶枯病的病原真菌小孢拟盘多毛孢的分子鉴定和防治药剂筛选;陈全助等[15]研究了小孢拟盘多毛孢引起闽楠叶斑病的分离鉴定及生物学特性。本试验研究小孢拟盘多毛孢的生物学特性时发现,该菌对碳源适应性比较强,通过菌丝生长速度來看,对于各种碳源的吸收都比较好。氮源是构成菌体或代谢产物中氮素来源的营养物质,该菌对于有机氮和无机氮的吸收差异并不明显,但总体而言有机氮中以蛋白胨为最佳,无机氮中以NaNO3为最佳。研究发现,该菌最适生长温度是20~28℃,在此温度下菌丝生长的速度较快,但当温度大于37℃时,菌丝生长受到严重抑制,据此可以对小孢拟盘多毛孢的流行季节进行预测。pH对小孢拟盘多毛孢的生长也有一定的影响,pH为6~9时菌丝都能较好地生长,最适生长的pH是6。这一研究结果与陈全助等[15]研究有相似之处,但是生物学特征也有一定差异,这可能与小孢拟盘多毛孢不同寄主来源或不同地理来源菌株生物特征有差异有关。
目前,化学防治作为农林业病虫害最主要的防治手段,具有收效迅速、方法简单等多种优势,但是其负面影响也不容忽视。红叶石楠作为常见的园林绿化观赏树种,化学防治叶斑病可能会对人体健康和环境造成较大的危害。因此,通过研究其生物学特性,以期预测其病害的发生规律,采用营林措施,通过改善土壤条件、调节红叶石楠的郁闭度等预防病害的发生,为安全有效防治红叶石楠叶斑病提供参考。
参考文献
[1] 唐安玲. 红叶石楠的特征特性及防治栽培技术[J]. 安徽农学通报, 2019, 25(13): 78-79.
[2] 赵晓伟, 黄美娟, 黄海泉. 彩叶树种红叶石楠的开发与应用[J]. 北方园艺, 2008, 32(6): 161-163.
[3] 屠凯, 温国胜, 侯平. 红叶石楠绿叶与红叶的光合蒸腾特性比较[J]. 安徽农学通报, 2019, 35(15): 110-115.
[4] 芦建国, 梁同江, 孔凡海. 8种灌木根系分布对高速公路生态边坡的影响[J]. 南京林业大学学报(自然科学版), 2011,35(5): 155-159.
[5] 王政, 刘伟超, 何松林, 等. LED红蓝光质比对红叶石楠试管苗生長和抗氧化酶活性的影响[J]. 西北农林科技大学学报(自然科学版), 2018, 46(10): 49-56.
[6] 谷月, 宋盈颖, 方敬雯, 等. 盐胁迫对红叶石楠红罗宾生理特征影响的实验研究[J]. 生态科学, 2017, 36(2): 152-157.
[7] 曹晶, 姜卫兵, 翁忙玲, 等. 夏秋季旱涝胁迫对红叶石楠光合特性的影响[J]. 园艺学报, 2007, 34(1): 163-172.
[8] 蔡凌云. 简述红叶石楠主要病害防治[J]. 现代园艺, 2014(17): 120-121.
[9] MAHARACHCHIKUMBURA S S N, GUO L D, CHUKEATIROTE E, et al. Pestalotiopsis — morphology, phylogeny, biochemistry and diversity [J]. Fungal Diversity, 2011, 50(1): 167-187.
[10]管斌, 徐超,张红岩, 等. 红叶石楠叶斑病病原分离鉴定及致病性测定研究[J]. 西部林业科学, 2013, 42(2): 56-61.
[11]蒋桂芝, 陶亮, 岳海, 等. 云南澳洲坚果春季病害调查及主要病原防治药剂筛选[J]. 热带农业科技, 2018, 41(4): 27-31.
[12]薛德胜, 邵兆浩, 李保华, 等. 防治蓝莓棒状拟盘多毛孢菌化学药剂的室内筛选[J]. 山东农业科学, 2018, 50(9): 115-118.
[13]管斌, 吕兴萍, 徐超, 等. 红叶石楠小孢拟盘多毛孢叶斑病化学防治试验[J]. 西北林学院学报, 2013, 28(2): 131-135.
[14]熊朝伟, 阮成江, 吴波, 等. 玉屏油茶叶枯病病原菌分子鉴定及防治药剂筛选[J]. 分子植物育种, 2019, 17(6): 1944-1950.
[15]陈全助, 金亚杰, 郭朦胧, 等. 闽楠叶斑病病原鉴定及其生物学特性测定[J]. 植物病理学报, 2018, 48(3): 313-323.
(责任编辑:田 喆)

