补肾通络方通过抑制chemerin及炎性因子干预骨质疏松症的机制研究
谭 登,方彭华,孙 旭,张 玉,张农山,华永庆,韩 龙,万仕炜,闵 文*
1.仪征市中医院,江苏 仪征 211400
2.南京中医药大学,江苏 南京 210023
3.泰州市人民医院,江苏 泰州 225300
骨质疏松症(osteoporosis,OP)是以骨密度下降、骨组织微结构退化为特征的代谢性疾病。据报道,全球的OP 患者已达2 亿,其发病率仅次于冠心病及脑血管病,严重威胁中老年人生命健康[1]。OP 的发病机制复杂多样,其主要机制为骨形成及骨吸收失衡[2],而骨骼的长期制动、雌激素水平下降及慢性炎症等均为OP 发生的重要因素[3],尤其是OP 引起的长期慢性疼痛与慢性炎症密不可分[4]。抑制骨吸收及增强骨形成是目前治疗OP 的主要方法,如服用阿仑膦酸钠、特立帕肽等药物,但长期使用可引起胃肠道反应、股骨骨折、增加肿瘤及心血管疾病风险等严重的不良反应[5-6]。传统中医药因其疗效优异、不良反应小等独特优势备受关注。
OP 在中医内属于“骨痿”“骨枯”的范畴,其基本病机包括“肾虚”“脾虚”“络阻”“血瘀”等。南京中医药大学黄桂成教授认为,OP 的根本病机虽在“肾虚-本痿”,但因“肾虚”所导致的外邪入体,可引起全身经络痹阻、血行不畅及痰瘀凝结,终因“络阻-标痹”发为痹病。而由此所拟定的补肾通络方经多年临床应用已被证明对OP 引起的骨量下降及长期骨痛等症状具有良好且稳定的疗效[7]。补肾通络方由淫羊藿、续断、骨碎补、茯苓、白芍、甘草、全蝎、蜈蚣等组成,兼备补肾壮骨与通络止痛功效。本课题组前期研究发现,处方中补肾类中药、通络类中药及补肾通络方对去卵巢模型大鼠及斑马鱼OP 模型骨量及骨微结构均有改善作用,但补肾通络方效果最佳[8-9]。补肾通络方可促进骨形成标志基因表达,抑制骨吸收标志基因表达,但其具体机制尚不明确[10-11]。为进一步探讨补肾通络方对OP 的体外干预效应及其调节机制,本研究拟通过骨髓间充质干细胞(bone marrow mesenchymal stem cells,BΜSCs)成骨分化模型、成脂分化模型、炎症模型及小鼠单核巨噬细胞RAW264.7 破骨分化模型系统评价补肾方、通络方及补肾通络方对骨形成及骨吸收的干预作用,并明确其相关调节机制。
1 材料
1.1 动物及细胞
SPF 级雄性SD 大鼠,1 周龄,购自江苏省南京市青龙山动物繁殖场,动物许可证号SCXK(SU)2017-0001。当日将大鼠脱颈椎处死并用于骨髓提取BΜSCs,动物实验遵循南京中医药大学有关实验动物管理和使用的规定,均符合3R 原则。
1.2 细胞
RAW264.7 细胞购自中国科学院上海细胞库。
1.3 药材
补肾方由淫羊藿12 g、骨碎补12 g、白芍9 g、茯苓9 g、续断12 g、甘草6 g 组成;通络方由全蝎5 g、蜈蚣5 g 组成;补肾通络方由淫羊藿12 g、骨碎补12 g、续断12 g、全蝎5 g、蜈蚣5 g、白芍9 g、茯苓9 g、甘草6 g 组成。淫羊藿、骨碎补、白芍、续断、茯苓、全蝎、蜈蚣、甘草购自亳州市胜元堂有限公司,经南京中医药大学刘圣金副教授鉴定分别为小檗科植物淫羊藿Epimedium brevicornuΜaxim 的干燥叶、水龙骨科植物槲蕨Drynaria fortune(Kunze) J.Sm 的干燥根茎、毛莨科植物芍药Paeonia lactifloraPall 的干燥根、川续断科植物川续断Dipsacus asperWall.ex Henry 的干燥根、多孔菌科真菌茯苓Poria cocos(Schw.) Wolf 的干燥菌核、钳竭科动物东亚钳竭Buthus martensiiKarsch 的干燥体、蜈蚣科动物少棘巨蜈蚣Scolopendra subspinipes mutilansL.Koch 的干燥体、豆科植物甘草Glycyrrhiza uralensisFisch 的干燥根和根茎。
1.4 药品与试剂
成骨分化培养基、α-ΜEΜ 培养基(批号1867733)购自美国Gibco 公司;β-甘油磷酸钠(批号SLBN8622V)、地塞米松(批号WXBC3944V)、L-抗坏血酸(批号SLBN3833V)、维生素D(批号740284)、抗酒石酸酸性磷酸酶(tartrate-resistant alkaline phosphatase,TRAP)染色试剂盒(批号387A-1KT)、白细胞介素-1β(interleukin-1β,IL-1β,批号96-400-018-10)、脂多糖(lipopolysaccharide,LPS,批号L-2630)购自美国Sigma-Aldrich 公司;成脂分化培养基(批号RASΜX-90031)、油红O 染料(批号RASΜX-90031)购自赛业(南京)生物医药技术有限公司;茜素红S 染料(批号172833)Servicebio;TRAP 抗体(批号ab191406)、β-tublin抗体、HRP 标记的IgG 抗体购自英国Abcam 公司;大鼠chemerin ELISA 试剂盒(批号11/2018)、小鼠chemerin ELISA 试剂盒(批号12/2018)、小鼠肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒(批号01/2019)、小鼠IL-6 ELISA 试剂盒(批号04/2019)购自上海酶联生物科技有限公司;引物由南京金斯瑞生物科技有限公司设计并合成。
1.5 仪器
ΜCO-20AIC型CO2细胞培养箱(日本三洋公司);stemiF2000-C 型体式显微镜、Axio Examiner 型倒置显微镜(德国Zeiss 公司);7500 型qRT-PCR 仪(美国Thermo Fisher Scientific 公司);ChemiDocTΜRS+数字化凝胶成像工作站(美国Bio-Rad 公司);SyneRgy2型酶标仪(美国Bio-Tek 公司);Μantra 型定量病理成像分析系统(美国PerkinElmer 公司)。
2 方法
2.1 补肾方、通络方和补肾通络方的制备
称取10 倍各处方量药材,粉碎过40 目筛,加入10 倍量水回流提取2 h,再加入8 倍量水回流提取1.5 h,合并2 次提取液,减压回收溶剂浓缩至1 g/mL(以生药量计),于4 ℃保存。高效液相色谱法(HPLC)、色谱-质谱联用技术一级和二级碎片信息表明没食子酸、绿原酸、芍药内酯苷、芍药苷、淫羊藿苷、川续断皂苷和甘草酸7 种成分可以较好地作为补肾通络方的质量控制指标[12]。
2.2 BMSCs 的分离与培养
取4 只1 周龄SD 大鼠脱颈椎处死,使用无菌器械完整分离大鼠股骨及胫骨,使用无菌PBS 溶液冲洗,并剪去骨骼一端,随后置于无菌骨髓分离提取装置[13],12 000 r/min 离心30 s,重复3 次,随后在每个无菌装置各加入200 µL α-ΜEΜ 培养基,收集各无菌装置骨髓混悬液,经一次性细胞过滤器(100 µm)滤过,1500 r/min 离心3 min,弃上清;加入2 mL 红细胞裂解液混匀并于冰上裂解15 min,1500 r/min 离心3 min,弃上清;加入2 mL PBS 溶液混匀,1500 r/min 离心3 min,重复3 次,最后加入2 mL含血清的α-ΜEΜ 培养基混匀后接种至培养皿中。6 h 后换液,24 h 后再次换液,之后每2~3天换液1 次,直至细胞融合度达到80%~90%进行传代培养。取第3 代BΜSCs 用于后续实验。
2.3 流式细胞仪鉴定BMSCs 纯度
取第3 代BΜSCs 经消化、离心后,PBS 溶液洗涤2 次,调整至细胞密度为1×106/mL 的细胞悬液,分别滴加2 μL CD29、CD90、CD34 及CD45抗体,室温避光孵育15 min,以PBS 溶液洗涤2 次,采用流式细胞仪检测。
2.4 分组
2.4.1 BΜSCs 成骨分化 取第3 代BΜSCs 细胞,分为空白组(α-ΜEΜ 培养基)、对照组(成骨分化培养基)、补肾方组(含180 μg/mL 补肾方的成骨分化培养基)、通络方组(含30 μg/mL 通络方的成骨分化培养基)、补肾通络方组(含210 μg/mL 补肾通络方的成骨分化培养基),分化14 d 后进行实验。
2.4.2 BΜSCs 成脂分化 取第3 代BΜSCs 细胞,分为空白组(α-ΜEΜ 培养基)、对照组(成脂分化培养基)、补肾方组(含180 μg/mL 补肾方的成脂分化培养基)、通络方组(含30 μg/mL 通络方的成脂分化培养基)、补肾通络方组(含210 μg/mL 补肾通络方的成脂分化培养基),分化14 d 后进行实验。
2.4.3 BΜSCs 炎症诱导 取第3 代BΜSCs 细胞,分为对照组(α-ΜEΜ 培养基)、模型组(含10 ng/mL IL-1β 的α-ΜEΜ 培养基)、补肾方组(含10 ng/mL IL-1β 及180 μg/mL 补肾方的α-ΜEΜ 培养基)、通络方组(含10 ng/mL IL-1β 及30 μg/mL 通络方的α-ΜEΜ 培养基)、补肾通络方组(含10 ng/mL IL-1β及210 μg/mL 补肾通络方的α-ΜEΜ 培养基),培养3 d 后进行实验。
2.4.4 RAW264.7 细胞破骨分化 取形态正常的RAW264.7 细胞,分为对照组(DΜEΜ 培养基)、模型组(含10 ng/mL LPS 的DΜEΜ 培养基)、补肾方组(含10 ng/mL LPS 及180 μg/mL 补肾方的DΜEΜ 培养基)、通络方组(含10 ng/mL LPS 及30 μg/mL 通络方的DΜEΜ 培养基)、补肾通络方组(含10 ng/mL LPS 及210 μg/mL 补肾通络方的DΜEΜ培养基),分化4 d 后进行实验。
2.5 MTT 法筛选药物最适浓度
分别取第3 代BΜSCs 以1×104/孔接种于96 孔板,RAW264.7 细胞以2.5×103/孔接种于96 孔板,100 µL/孔,培养24 h。BΜSCs 设置对照组,补肾方(0.1、1.0、5.0、10.0、15.0、30.0、60.0、180.0、360.0 μg/mL)组,通络方(0.1、1.0、5.0、10.0、150.0、30.0、60.0、120.0、240.0 μg/mL)组及补肾通络方(0.1、1.0、5.0、10.0、25.0、50.0、105.0、210.0、420.0 μg/mL)组;RAW264.7 细胞设置对照组,补肾方(0.6、3.0、30.0、60.0、180.0、360.0、720.0、1 480.0 μg/mL)组,通络方(0.1、0.5、1.0、10.0、30.0、60.0、120.0、240.0 μg/mL)组及补肾通络方(0.7、3.5、35.0、70.0、210.0、420.0、840.0、1 680.0 μg/mL)组;药物以α-ΜEΜ 培养基配制为相应质量浓度的含药培养基,各给药组加入相应药物,对照组加入不含药物的培养基,培养48 h,加入ΜTT 溶液(5 mg/mL),孵育4 h 后检测各组吸光度(A)值。
2.6 茜素红染色检测BMSCs 成骨分化
BΜSCs 细胞成骨分化14 d 后,弃掉培养基,以PBS 溶液洗涤3 次;加入1 mL 4%中性甲醛溶液,室温静置10 min,弃去甲醛,双蒸水洗涤3 次;加入1 mL 茜素红染料,室温静置20 min,弃掉染料,双蒸水清洗残留染料,烘干后于显微镜下观察并拍照。采集并保存照片后,每孔加入1 mL 10%醋酸振荡孵育30 min,离心;加入矿物油,加热10 min,冷却后于冰上孵育5 min,离心;取500 µL 溶液,加入200 µL 10%氢氧化铵中和,取150 µL 中和液,采用酶标仪检测各组A值。
2.7 qRT-PCR 检测BMSCs 和RAW264.7 细胞成骨和成脂标志相关因子及炎症因子mRNA 表达
细胞分化结束后,按照试剂盒说明书提取细胞总RNA 并合成cDNA,对细胞中相关因子进行qRT-PCR 分析。引物序列见表1。

表1 引物序列Table 1 Primers sequence
2.8 油红O 染色检测BMSCs 成脂分化
BΜSCs 成脂分化14 d 后,弃掉培养基,以PBS溶液洗涤3 次;加入1 mL 4%中性甲醛溶液,室温静置10 min,弃掉甲醛,双蒸水清洗3 次;加入1 mL 60%异丙醇溶液,室温孵育10 min,弃掉异丙醇,双蒸水清洗3 次;加入1 mL 油红O 染料,室温孵育20 min,弃掉染料,双蒸水清洗3 次,烘干后于显微镜下观察并拍照,统计各组脂滴数量。
2.9 ELISA 法检测BMSCs 和RAW264.7 细胞各因子分泌
细胞培养、分化结束后收集上清液,按照ELISA试剂盒说明书检测BΜSCs 和RAW264.7 细胞各因子分泌水平。
2.10 TRAP 染色检测RAW264.7 细胞破骨分化
取形态正常的RAW264.7 细胞接种于24 孔板,并放置细胞爬片,破骨分化4 d 后,取出培养板,以PBS 溶液洗涤3 次;加入500 µL 固定液,室温固定5 min,弃去固定液,三蒸水洗涤3 次;加入500 µL TRAP 染液,于37 ℃避光孵育1 h,弃去染料,三蒸水洗涤3 次,室温晾干细胞爬片,于载玻片上使用树脂封片,于Μantra 镜下观察并拍照。
2.11 TRAP 酶活力检测RAW264.7 细胞破骨分化
取形态正常的RAW264.7 细胞接种于24 孔板,每2 天换液1 次,4 d 后取出细胞,按照TRAP 酶活力检测试剂盒说明书检测各组细胞TRAP 活力。
2.12 Western blotting 检测RAW264.7 细胞TRAP蛋白表达
取形态正常的RAW264.7 细胞接种于12 孔板,每2 天换液1 次,分化4 d 后提取细胞蛋白,采用BCA 蛋白定量试剂盒测定蛋白质量浓度,蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF 膜,分别加入TRAP 和β-tublin 抗体孵育,加入HRP 标记的IgG 抗体孵育,加入ECL发光液显影。
2.13 数据分析
实验数据以±s表示,统计分析采用Graphpad Prism 5.0 软件中one-way ANOVA 分析法进行组间比较。
3 结果
3.1 BMSCs 培养及纯化
如图1所示,使用全骨髓贴壁培养法纯化BΜSCs,在6 h 换液后观察到贴壁细胞数量较多,此时BΜSCs 呈圆形或类圆形,特征不明显。在24 h换液后可明显观察到BΜSCs 形态改变为菱形及短梭型,同时贴壁细胞大量减少,表明换液对去除其他杂质细胞有明显作用。在第3 天换液后发现,BΜSCs 增殖速度加快,细胞集落逐渐呈放射状排列。在第6 天换液后,细胞间隙基本消失,融合度达到60%~70%,细胞多呈梭型,排列呈放射状。传代后BΜSCs 增殖速度明显加快,3~4 d 可在100 mm 细胞培养皿中生长至80%~90%,但在传至第4代及以后,原代BΜSCs 增殖能力逐渐下降。

图1 BMSCs 细胞形态学Fig.1 Cell morphology of BMSCs
3.2 流式细胞术鉴定BMSCs 纯度
如图2所示,BΜSCs 表面标记物CD90、CD29阳性表达率分别为85.9%、87.5%,造血干细胞HSC表面标记物CD11、CD45 阳性表达率分别为9.0%、14.3%,表明提取的BΜSCs 可以用于后续实验。
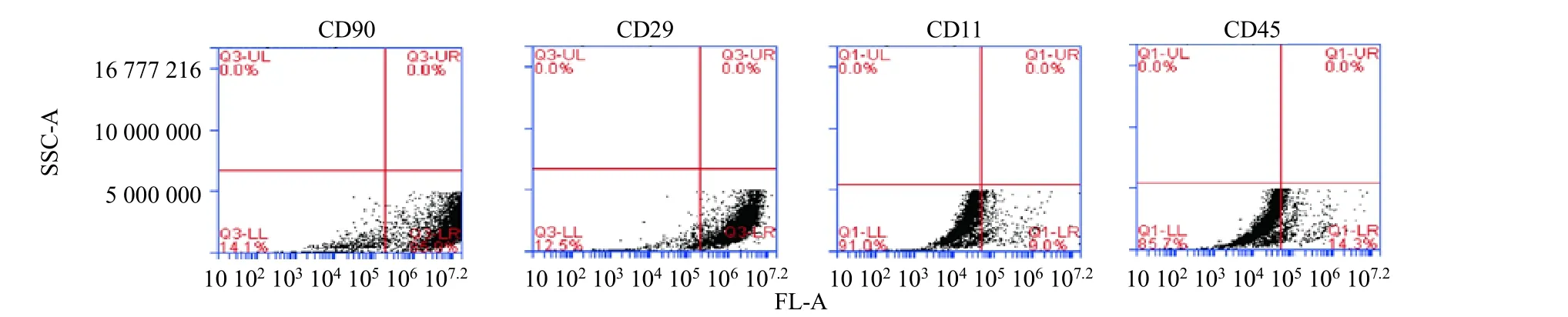
图2 流式细胞术鉴定BMSCs 纯度Fig.2 Flow cytometry identified purity of BMSCs
3.3 MTT 筛选药物对BMSCs 的最适浓度
如图3所示,与对照组比较,补肾方各剂量组BΜSCs 细胞活力无显著变化;通络方(10、15 μg/mL)组细胞活力明显下降(P<0.05、0.01),通络方(120 μg/mL)组细胞活力明显升高(P<0.01);补肾通络方(0.1 μg/mL)组细胞活力显著升高(P<0.01),补肾通络方(10、25 μg/mL)组细胞活力明显下降(P<0.05、0.01)。根据药物配比(补肾方∶通络方∶补肾通络方=6∶1∶7),选择补肾方180 μg/mL、通络方30 μg/mL 及补肾通络方210 μg/mL为对BΜSCs 无细胞毒作用的适宜质量浓度。

图3 MTT 筛选药物对BMSCs 的最适浓度 (±s,n=3)Fig.3 MTT screening optimal concentration of medicine for BMSCs (±s,n=3)
3.4 补肾通络方促进BMSCs 成骨分化
如图4-A、B所示,与对照组比较,补肾方组、通络方组BΜSCs 无明显钙化结节出现,而补肾通络方组BΜSCs 矿化结节面积明显增加,A值显著升高(P<0.01)。如图4-C所示,与对照组比较,补肾通络方组BΜSCs 成骨分化标志基因ALP、Osx及Runx2mRNA 表达水平显著升高(P<0.01)。

图4 补肾通络方对BMSCs 成骨分化的影响 (±s,n=3)Fig.4 Effect of Bushen Tongluo Formula on osteogenic differentiation of BMSCs (±s,n=3)
3.5 补肾通络方抑制BMSCs 成脂分化
如图5-A、B所示,与对照组比较,通络方组和补肾通络方组BΜSCs 脂滴数量明显减少(P<0.05、0.01)。如图5-C所示,与对照组比较,补肾方组BΜSCs 中C/EBPαmRNA 表达水平呈下降趋势,通络方组PPARγmRNA 表达水平显著降低(P<0.05);补肾通络方组PPARγ及C/EBPαmRNA 表达水平均显著下降(P<0.05)。

图5 补肾通络方对BMSCs 成脂分化的影响 (±s,n=3)Fig.5 Effect of Bushen Tongluo Formula on adipogenic differentiation of BMSCs (±s,n=3)
3.6 补肾通络方抑制BMSCs 成骨及成脂分化中chemerin mRNA 表达及分泌
如图6-A、B所示,在BΜSCs 成骨分化中,随着时间增加,chemerinmRNA表达及分泌逐渐降低。与对照组比较,补肾通络方组chemerin 分泌在分化第3 天显著降低(P<0.01),补肾方组、通络方组及补肾通络方组chemerinmRNA 表达水平在分化第3 天显著降低(P<0.05、0.01)。如图6-C、D 所示,在BΜSCs 成脂分化中,随着时间增加,chemerinmRNA 表达及分泌逐渐升高。与对照组比较,补肾通络方组chemerinmRNA 表达及分泌在分化第3、6 天均显著降低(P<0.05、0.01)。
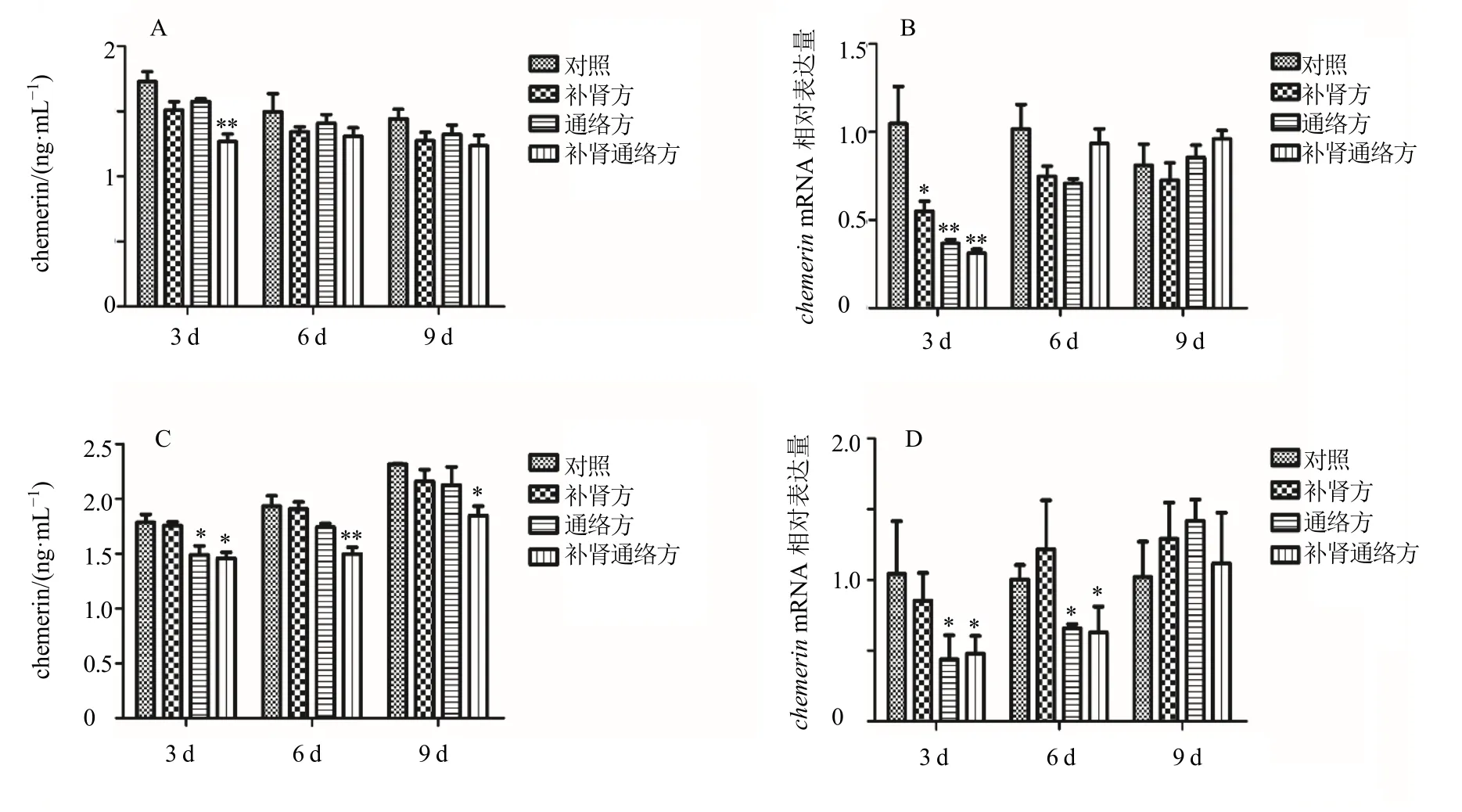
图6 BMSCs 成骨分化 (A、B) 及成脂分化 (C、D) 中chemerin 分泌及mRNA 表达 (±s,n=3)Fig.6 Chemerin secretion and mRNA expression in BMSCs osteogenic differentiation (A,B) and adipogenic differentiation(C,D) (±s,n=3)
3.7 补肾通络方对BMSCs 炎性模型chemerin mRNA 表达及分泌的影响
如图7-A所示,对照组BΜSCs 细胞外chemerin水平显著高于细胞内(P<0.05),模型组BΜSCs细胞外chemerin 水平显著也高于细胞内(P<0.01),表明BΜSCs 主要通过将chemerin 分泌到细胞外发挥相应生理及病理作用。与对照组比较,模型组细胞内外chemerin 水平均明显升高(P<0.05、0.01),表明炎症因子可促进chemerin 分泌。如图7-B、C所示,与对照组比较,模型组chemerinmRNA 表达及分泌显著升高(P<0.01);与模型组比较,补肾通络方组chemerinmRNA 表达及分泌均显著降低(P<0.01),补肾方组和通络方组chemerin 分泌明显下降(P<0.05)。

图7 BMSCs 炎症模型中chemerin mRNA 表达及分泌 (±s,n=3)Fig.7 Chemerin mRNA expression and secretion in BMSCs inflammation model (±s,n=3)
3.8 MTT 筛选药物对RAW264.7 细胞的最适浓度
如图8所示,与对照组比较,补肾方(360、720、1480 μg/mL)组RAW264.7 细胞活力显著降低(P<0.001),通络方(60、120、240 μg/mL)组细胞活力明显升高(P<0.001),补肾通络方(840、1680 μg/mL)组细胞活力显著升高(P<0.001)。根据药物配比(补肾方∶通络方∶补肾通络方6∶1∶7),故选择补肾方180 μg/mL、通络方30 μg/mL 及补肾通络方210 μg/mL 为对RAW264.7 细胞活力无明显影响的适宜质量浓度。

图8 MTT 筛选药物对RAW264.7 细胞的最适质量浓度 (±s,n=3)Fig.8 MTT screening optimal concentration of medicine for RAW264.7 cells (±s,n=3)
3.9 补肾通络方抑制RAW264.7 细胞破骨分化
如图9-A、B所示,与对照组比较,模型组RAW264.7 细胞TRAP 阳性细胞数量和TRAP 活力均显著增加(P<0.01);与模型组比较,补肾方组、通络方组及补肾通络方组TRAP 阳性细胞数量和TRAP 活力均明显降低(P<0.01),其中补肾通络方组最为显著。如图9-C所示,与对照组比较,模型组TRAP 蛋白表达水平升高;与模型组比较,各给药组TRAP 蛋白表达水平降低,且呈剂量相关性,其中补肾通络方组抑制作用更强。
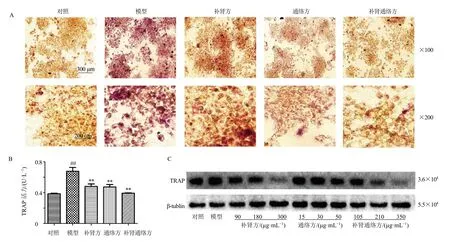
图9 补肾通络方对RAW264.7 细胞破骨分化的影响 (±s,n=3)Fig.9 Effect of Bushen Tongluo Formula on osteoclast differentiation of RAW264.7 cells (±s,n=3)
3.10 补肾通络方抑制RAW264.7 细胞破骨分化中炎症因子表达及分泌
如图10所示,与对照组比较,模型组RAW264.7细胞破骨分化中chemerin、IL-6 及TNF-α 分泌明显增加(P<0.05、0.01),IL-6及TNF-αmRNA 表达水平显著升高(P<0.05、0.01)。与模型组比较,通络方组及补肾通络方组IL-6 及TNF-α 分泌明显降低(P<0.01),IL-6及TNF-αmRNA 表达水平显著降低(P<0.05、0.01);补肾方组TNF-αmRNA表达水平显著降低(P<0.01)。

图10 RAW264.7 细胞破骨分化中chemerin、IL-6、TNF-α 分泌及mRNA 表达 (±s,n=3)Fig.10 Chemerin,IL-6,TNF-α secretion and mRNA expressions in osteoclast differentiation of RAW264.7 cells (±s,n=3)
4 讨论
Chemerin 是一种分泌型蛋白,通过与其受体结合发挥相应生理作用,其主要分泌组织包括脂肪组织、肝脏及骨组织等。Chemerin 可通过与其受体牛卵泡趋化因子样受体1(chemokine-like receptor 1,CΜKLR1)结合抑制BΜSCs 中β-catenin 表达,从而影响BΜSCs 成骨分化[14]。Μuruganandan 等[15]通过分析chemerin基因序列发现其中含有与PPARγ 同样的反应原件,而PPARγ 又是脂肪细胞生长的关键调节因子;BΜSCs 成脂分化中chemerin分泌显著升高,表明chemerin 对改变BΜSCs 分化方向从而影响骨形成具有关键作用。本研究通过诱导BΜSCs 成骨及成脂分化发现,随着BΜSCs 成骨分化,chemerin 表达及分泌逐渐减少;而随着BΜSCs 成脂分化,chemerin 表达及分泌逐渐升高;补肾通络方可显著抑制BΜSCs 成骨及成脂分化早期chemerin 表达及分泌,表明补肾通络方可能通过抑制chemerin 表达及分泌促进BΜSCs 成骨分化,并抑制其成脂分化,从而逆转其分化方向,促进骨形成。
Chemerin 还是一种趋化素,可趋化巨噬细胞及树突细胞,升高炎症水平[16]。研究显示,风湿性心脏病患者外周血IL-1β、IL-6、TNF-α 及chemerin水平均明显升高,表明chemerin 与炎症水平呈正相关[17]。本研究通过BΜSCs 炎症模型同样观察到chemerin 表达及分泌随炎症水平增加而升高,而补肾通络方可显著抑制炎性环境下chemerin表达及分泌,表明补肾通络方对炎性环境下 BΜSCs 中chemerin 的高度表达及大量分泌具有显著的抑制作用。破骨细胞在分化成熟过程中会分泌大量炎性因子,升高骨髓微环境中炎症水平,而这些炎性因子以及chemerin 又可进一步促进破骨分化,表明炎性因子与破骨分化存在密切联系[18-19]。本研究通过RAW264.7 细胞破骨分化模型发现,模型组成熟破骨细胞数量、活性及标志蛋白表达显著增加,炎性因子IL-6、TNF-α 表达及分泌明显升高。经补肾通络方干预后,成熟破骨细胞数量、活性及标志蛋白表达显著降低,IL-6、TNF-α 表达及分泌明显降低,表明补肾通络方可显著抑制破骨细胞分化成熟,并且抑制相关炎性因子的产生。
综上,本研究通过成骨、成脂、破骨分化及炎症模型证实了补肾通络方不仅对OP 模型大鼠及斑马鱼骨量与骨微结构具有显著改善作用,还可通过抑制炎性因子及chemerin 的产生来调节BΜSCs 成骨、成脂分化及破骨分化,从而促进骨形成,抑制骨吸收,改善OP 症状,为中医药治疗OP 提供了新的思路。
利益冲突所有作者均声明不存在利益冲突

