高粱叶夹角突变体LA1的表型鉴定与遗传分析
李金红,董 爽,2,李伟涵,张丽霞,陆晓春
(1.辽宁省农业科学院高粱研究所,沈阳 110161;2.沈阳大学生命科学与工程学院,沈阳 110003;3.沈阳师范大学 生命科学学院,沈阳 110034)
高粱(Sorghum bicolor)是我国主要的旱粮和谷类作物之一,其产量关系到食用[1-2]、酿酒[3]、畜牧饲料[4]和生物乙醇[5]等产业的发展。近年来,我国可利用的耕地面积逐年减少,但国家发展对高粱的需求却越来越高。因此在有限的耕地面积上,提高单位面积的产量进而增加总产量是一条可持续发展的路径。因此通过培育具有合理株型的新品种来增加种植密度、提高总产量,已经成为育种家越来越重要的育种目标。叶夹角是理想株型的重要直观形态指标之一,同时也是考虑优良作物品种能否密植的重要农艺性状之一,其是指叶片与主茎的夹角。合理的叶夹角能够在高密度种植条件下,把所接受的光能合理地分配到群体内各叶层,使群体内的透光率维持在较高的水平,从而满足叶片光合作用对光能的需求[6]。
前人开展对叶夹角的形成、发育及调控叶夹角发育的基因克隆的相关研究工作,WANG等[7]通过对水稻“中花11”倒2叶叶枕的不同发育时期进行组织切片分析,结果表明水稻叶夹角的大小是由于近轴端与远轴端细胞伸长生长的发育不平衡引起的;MORENO等[8-12]通过对玉米Liguleless 1(lg1)和Liguleless 2(lg2)突变体研究发现lg1和lg2基因缺失,均会造成叶耳、叶舌缺失,叶枕发育异常,lg1和lg2分别编码SPL(SQUAMOSA promoter-binding protein-like)蛋白和碱性亮氨酸拉链蛋白(bZIP),lg2表达早于lg1,二者共同调控幼叶原基叶舌的发育,进而影响叶夹角的大小。TIAN等[13]克隆玉米UPA1和UPA2基因,并且发现玉米野生种中的UPA2等位基因与叶片发育基因DRL1具有较强的结合能力,DRL1与lg1互作并抑制lg1对ZmRAVL1的激活作用,导致下游基因brd1的表达下调,进而影响细胞的增殖,最终导致叶夹角减小,株型趋紧凑。水稻dl突变体表现为植株矮小、叶夹角变小,经研究发现dl1编码细胞色素P450,通过催化6-脱氧香蒲甾醇(6-Deoxo TY)和香蒲甾醇(TY)合成影响叶片的开张角度,DIAO等[14]在谷子中发现DROOPY LEAF1(DPY1),一种LRR受体样激酶,对功能丧失突变DPY1研究发现,该突变体叶片中的木质素含量低,该基因特异性在叶片的维管束中表达。该基因通过BR信号的转导调控叶片下垂。
本试验利用EMS诱变高粱BTX623获得一个叶夹角变小的突变体(LA1),对该突变体从形态学、细胞学、遗传特性和基因定位等方面进行研究,最终将该基因定位在标记z1s11e1~z1s11e14,研究结果将为进一步克隆突变基因和解析高粱叶夹角形成的分子机制提供理论依据。
1 材料与方法
1.1 材料
LA1突变体是由高粱自交系BTX623经0.1%EMS诱变的后代,2015年种植于辽宁省农业科学院科学研究试验基地,M1单株单穗留种,2016年将M2株系种植后发现1株系表现为叶夹角变小和叶片变窄。该株系经2017~2019年连续自交,突变性状已稳定遗传,命名为LA1。利用突变体LA1分别与野生型BTX623和叶夹角较大的自交系TX430进行杂交,获得F1后自交得到2个F2分离群体,用于突变性状的遗传分析和基因定位。
1.2 方法
1.2.1 农艺学性状的调查抽穗开花期随机选取野生型植株和突变体植株各10株,调查倒1节至倒8节不同节位的叶片长、叶片宽、叶夹角、叶枕长、叶耳周长、株高、一级枝梗数、千粒重、每穗粒数、结实率、粒长、粒宽等农艺学性状。
1.2.2 细胞学观察随机选取孕穗期突变体植株和野生型植株各10株,分别取倒4叶的叶耳,于FAA固定液(50%乙醇∶0.9mol·L-1冰乙酸∶甲醛=90∶5∶5)固定,经乙醇脱水、浸蜡、二甲苯透明、石蜡包埋、切片、脱水和番红固绿染色后,置于NIKON E6000显微镜下观察拍照。
1.2.3 LA1突变基因定位利用重测序BSA(bulked segregate)方法对突变基因进行初定位。在(LA1×TX430)获得F2分离群体中分别选取50株野生表型和突变表型的叶片,提取基因组DNA,等量混合构建2个混池,对片段化的DNA进行片段纯化、末端修复、3'端加A、连接测序接头,再用琼脂糖凝胶电泳进行片段大小选择,进行PCR扩增形成测序文库,建好的文库先进行文库质检,质检合格的文库用Illumina平台进行测序,对突变基因进行初定位。根据初定位结果,以BTX623为参考基因组,找出差异序列后设计SSR和InDel标记引物,在目标区间继续筛选和加密分子标记,进行目标基因的精细定位。
1.2.4 数据处理试验数据用Excel 2010和SPSS 10.0软件进行数据分析。
2 结果与分析
2.1 突变体植株LA1和野生型植株的表型分析和细胞学观察
在幼苗期突变体植株与野生型植株均未出现明显差异,随着植株的生长,在拔节期突变体开始出现叶片变窄变短,叶耳变小(图1a和图1b),叶夹角变小,此时对叶耳进行细胞学观察发现:与野生型植株相比,突变体叶耳细胞明显增大,细胞层数明显减少(图1c),因此推测突变体LA1的叶夹角的变化是由于叶耳部位细胞层数和细胞大小的变化引起的。
在成熟期与野生型相比,LA1突变体各部位叶片呈现较小的叶夹角(图1d、图1e和图1f),叶耳周长和叶长均小于野生型叶耳周长和叶长(图1g和图1h),同时穗长也小于野生型穗长(图1i)。农艺学调查结果表明,突变体的株高、粒长、粒宽、千粒重、结实率与野生型均没有差异,但突变体的每穗粒数极显著低于野生型的每穗粒数,一级枝梗数显著低于野生型的一级枝梗数(表1)。
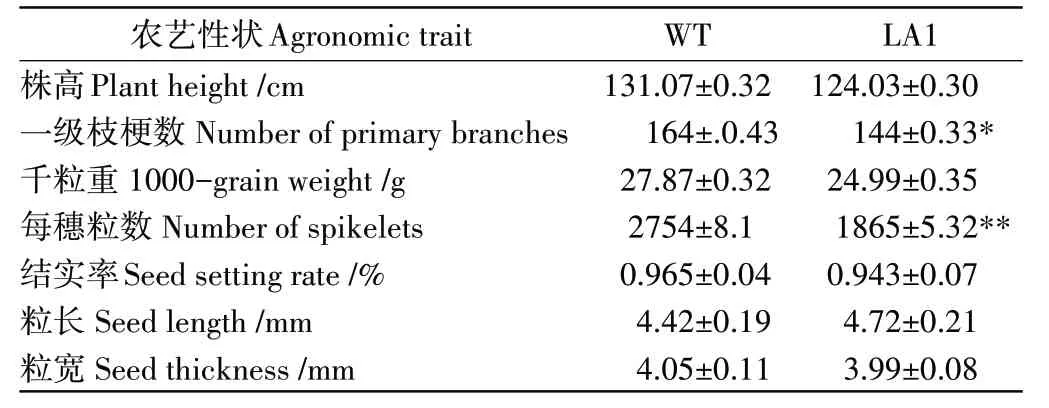
表1 野生型WT和叶夹角突变体LA1农艺学性状比较Table 1 Comparison of agronomic trait between wild type WT and mutant LA1
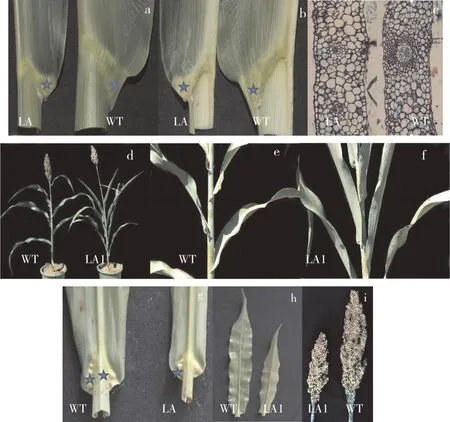
图1 野生型植株(WT)和突变体植株(LA1)的形态表现Figure 1 Morphological traits of the wild type(WT)and its mutant(LA1)
2.2 突变体LA1叶夹角及与叶夹角相关的性状分析
由图2可知,抽穗开花期,与野生型植株相比,突变体LA1植株的倒1叶至倒8叶的叶长和叶宽差异均极显著,且突变体的倒1叶叶长和叶宽分别下降35%和30%。野生型植株和突变体植株的叶夹角均呈现先降低后增加的趋势,突变体LA1植株各节位叶夹角均极显著低于野生型植株相应各叶片叶夹角,其中倒3叶下降的更明显,下降了49%。野生型植株和突变体植株各节位叶枕长(倒1叶除外)、叶耳周长的变化与叶夹角变化呈相反的趋势,即叶枕长和叶耳周长表现为先升高后降低。与野生型相比,LA1突变体植株倒4和倒5叶片叶枕长均显著低于野生型植株相应节位的叶枕长,其他节位叶枕长差异不显著;各节位叶耳周长均极显著低于野生型植株的各节位叶耳周长。这说明该突变体植株的叶夹角大小与叶枕、叶耳呈负相关,且叶夹角大小的性状主要与叶耳周长有关。
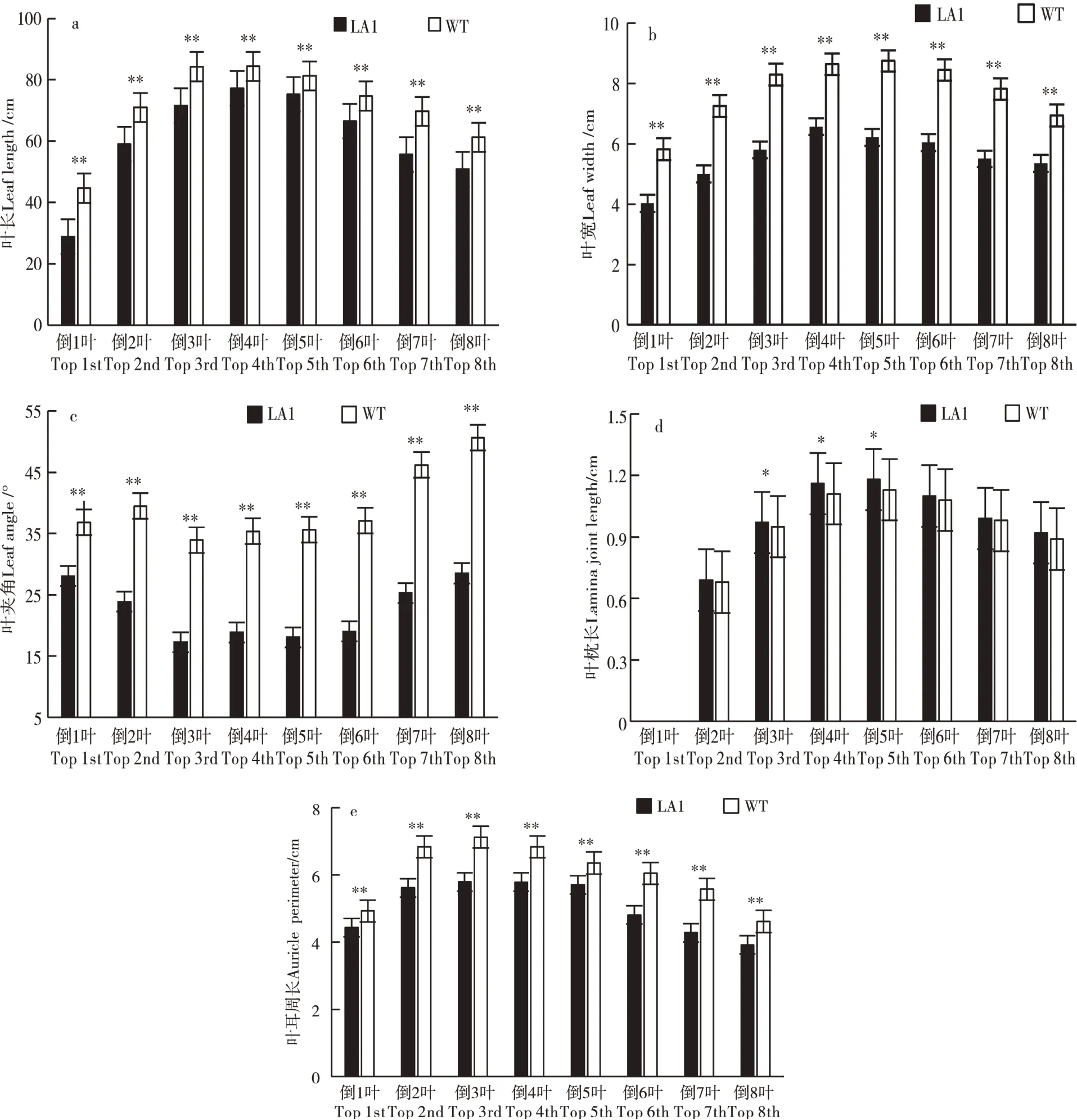
图2 抽穗开花期突变体植株和野生型植株田间表型调查Figure 2 Field phenotype of the mutant and wild type in heading and flower period
2.3 突变体LA1的遗传模式分析
依据叶夹角的大小作为突变表型的判断依据,将LA1突变体植株与野生型植株正反交得到F1(均为野生型表型),F1自交获得正反交2个F2分离群体(表2),其中LA1×WT的F2分离群体共1391株,野生表型1024株、突变表型为367株,分离比例经卡方检验符合3∶1分离;WT×LA1 F2分离群体共1519株,野生表型1127株、突变表型为392株,分离比例同样符合3∶1,推测该突变性状受1对隐性核基因控制。

表2 高粱叶夹角在2个F2群体中分离比例的卡方测验Table 2 Chi-sequare test of segregation ration of leaf angle in two F2 populations
2.4 基因定位
为了定位LA1突变基因,首先在LA1突变体与TX430的F2群体中分别选取突变型植株和野生型植株50株,提取基因组DNA,分别等量混合成正常基因池和突变基因池。结合亲本信息,计算△SNP-index,并对△SNP-index进行拟合,按照拟合后的△SNP-index计算机模拟实验,取置信度99%的阈值(图3),初步将LA1突变基因定位1号染色体的7.3Mb范围内(图4a)。
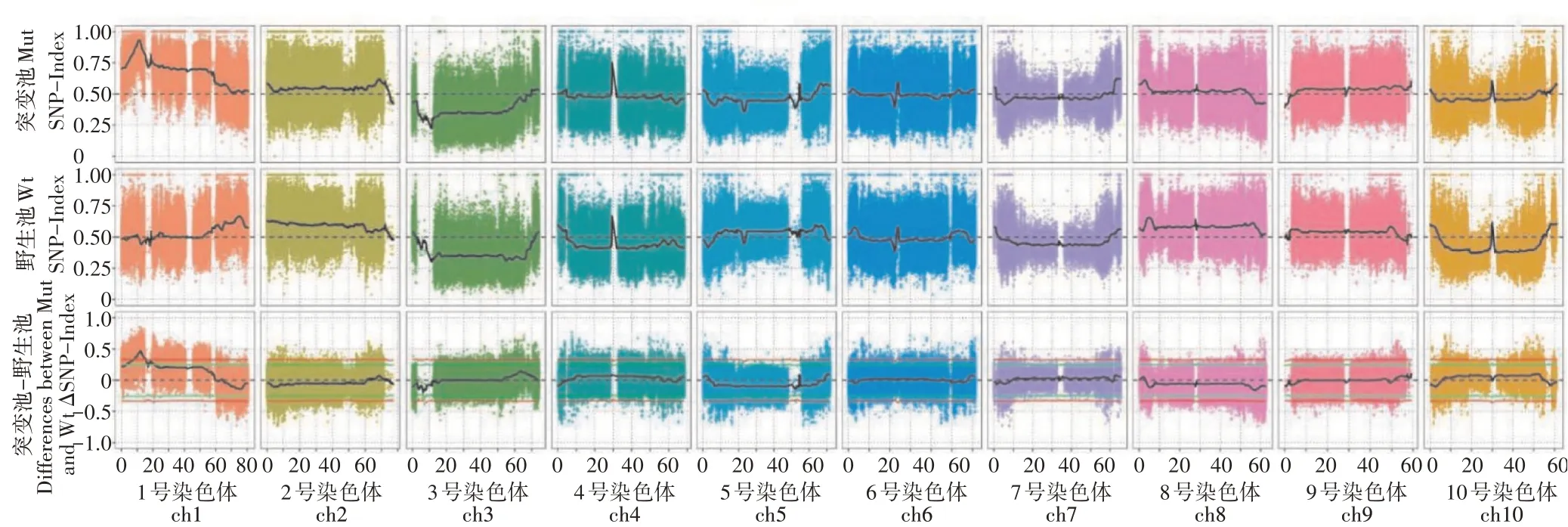
图3 SNP-index关联值在染色体上的分布Figure 3 Distribution of SNP-index correlation values on chromosomes
利用高粱基因注释网站(http://plants.ensembl.org/Sorghum_bicolor/Info/Index)的BTX623的基因组序列比对信息,在初定位区间新开发了S1-22、S1-32、S1-40、S1-54、S1-68、S1-97和S1-132标记,利用这7个标记对F2分离群体的759个突变单株进行基因型分析,结果发现这7个标记的交换单株分别为73,57,45,26,14,54和91株,初步将该基因定位在S1-54和S1-68之间,物理距离为960kb(图4b)。
为了进一步精细定位,在S1-54和S1-68之间设计了11对SSR和indel标记,其中有5对表现为多态性。利用5个多态性标记对40个隐性单株进行连锁分析,最终将LA1基因定位在z1s11e1~z1s11e14,根据已经公布的BTX623参考基因组序列,两者的物理距离为70kb(图4c),该定位区间内共有12个注释基因(图4d),目前正在对该区间内的候选基因进行筛选和克隆。
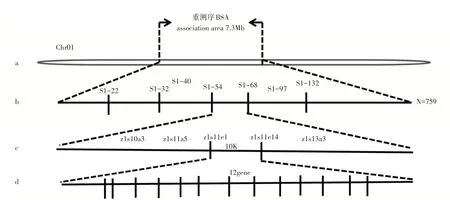
图4 高粱叶夹角突变基因LA1的精细定位Figure 4 Fine mapping of leaf angle mutation gene LA1 in sorghum
3 讨论与结论
培育合理株型的高粱品种是提高高粱产量的有效策略。高粱的叶不仅包括叶鞘和叶片,还包括叶枕、叶耳和叶舌等附属器官,叶夹角是高粱株型的主要性状之一,具有直立叶片、叶夹角小特点的株型不仅影响群体的受光面积,与产量也密切相关[15]。ZHANG等[16-17]对高产水稻株型的研究发现:剑叶叶夹角13~17°,倒2叶、倒3叶夹角依次增大,使植株呈塔状,更大限度地接受光能,提高光能利用率。叶夹角的大小与叶耳、叶枕和叶舌的大小密切相关。本试验对高粱叶夹角和叶耳周长研究发现,无论是野生型还是突变体,不同节位叶片的叶耳周长呈现先增加后减低的趋势,这与叶夹角大小的先减少后增加的趋势正相反,这说明叶夹角的大小与叶耳周长呈负相关。
叶夹角大小的基因与油菜素内酯、生长素和赤霉素等植物激素信号转导和生物合成密切相关。BRD2是拟南芥DIM/DWF1的同源基因,在BR生物合成途径中DIM/DWF1能够将24-亚甲基胆固醇催化成菜油甾醇。BRD2基因突变后拟南芥表现为植株矮小、叶片直立等性状[18]。在IAA信号转导途径中ARF、Aux/IAA和SCF参与水稻叶片夹角的调控,如OsIAA1、OsARF1和OsARF19等。F-box蛋白TIR1能够结合IAA和Aux/IAA,并且使Aux/IAA发生泛素化和降解,激活ARF,进而调控水稻叶片夹角。OsIAA1编码Aux/IAA蛋白,过表达植株出现株高降低,叶片夹角增大等特征[19]。
玉米、水稻、小麦和谷子已经克隆多个控制叶夹角的基因。玉米中lg1和lg2基因缺失,叶耳和叶舌缺失,叶枕发育异常,lg1和lg2在同一条信号通路上,且lg2表达早于lg1,二者共同调控叶舌、叶耳和叶枕的发育,进而调控叶夹角的大小[20-21]。对水稻直立型叶片和披散型叶片细胞学观察发现:披散型叶片叶枕的细胞长度变大,叶片弯曲下垂,形成较大的叶夹角,而直立型叶片叶枕处的细胞长度变小,产生较小的叶夹角[22]。本研究对突变体和野生型不同节位叶耳研究发现,突变体叶耳周长极显著低于野生型的叶耳周长;细胞学观察发现,与野生型植株叶耳相比,突变体的叶耳细胞变大,细胞层数变少。这说明突变体叶夹角变小是由于突变体的叶耳周长细胞变大、层数变少引起的。
遗传分析和基因定位表明:LA1基因受单隐性核基因控制,该基因定位于第1染色体的z1s11e1和z1s11e14两个标记之间,物理距离为70kb,该定位区间内共有12个注释基因。对叶夹角突变基因的后续深入研究,包括候选基因的筛选、突变基因功能验证、叶夹角形成分子机制的解析,有可能为培育适宜密植机械化的高粱品种提供新材料和新基因。

