“氧化还原”相关规律小结
董诗洋
氧化还原反应是高中化学解题的重要工具。除了常规题型的考查,该知识点常与化学滴定、除杂、离子共存、化学物质制备、电化学等知识点紧密联动,能够全面、灵活地考查学生对知识的掌握与应用。氧化还原是高考的热点,历年高考再现率几乎为100%。因此,有必要对常考题型所蕴含的相关规律作一个小结,以便提高解题效率。
一、价态规律
1.元素处于最高价时,由于不能再失去电子,因此仅具有氧化性;元素处于最低价时,由于不能再得到电子,因此仅具有还原性;处于中间价态的元素,既有氧化性,又有还原性。在某一反应中,可能呈现一种性质,也可能同时体现氧化性和还原性。如过氧化氢分解制氧气,过氧化氢既是氧化剂,又是还原剂。
例1:下列转化过程中必须加还原剂才能实现的是( )。A.SO32-→SO4
2-B.Cu→Cu2+C.HClO→HCl D.SiO2→Si
解析:还原剂有还原性,则与还原剂反应的物质被还原。因此,在转化过程中应有元素化合价降低。标出四个选项中,物质转化前后元素的化合价,只有C中Cl的化合价降低。答案为C。
例2:下列物质按一般只有氧化性、只有还原性、既有氧化性又有还原性的顺序排列的是( )。
A.F2、K、Cl2B.Cl2、Al、H2
C.NO2、SO2、H2O D.HNO3、HCl、Fe2+
解析:A选项符合题意;B选项,Cl2既有氧化性,又有还原性,而Al和H2一般情况下,仅有还原性,B不合题意;C选项中,NO2中的N,SO2中的S均为中间价态,H2O中H处于最高价,O处于最低价,因此三者均既有氧化性又有还原性;D选项中的HCl既有氧化性,又有还原性,不合题意。
本题答案为A。
2.不同价态的同一元素,若二者不存在中间价态,则二者不反应。如H2SO4与SO2中硫元素的化合价分别为+6价,+4价,无中间价态,因此可以用浓硫酸干燥SO2;Fe3+与Fe2+无中间价态,因此可以在同一溶液中大量共存。
3.在氧化还原反应前后,同一元素的价态只靠拢不交叉。
例3:用双线桥表示反应H2S+H2SO4=S+SO2+2H2O的电子转移。
解析:由题知,反应前后只有“S”的化合价发生变化。首先,标出“S”的化合价分别为:-2,+6,0,+4;其次,在数轴上标出这几个价态:

从-2→0,+6→+4的两条线,在数轴上没有交叉;而-2→+4,+6→0,两条线有交叉,这在氧化还原反应中是不合理的。因此H2S对应的氧化产物是S,H2SO4对应的还原产物为SO2。
二、强弱规律
1.氧化剂的氧化性强于氧化产物,还原剂的还原性强于还原产物。
2.物质的氧化性越强,对应的离子还原性越弱。
3.同一种氧化剂与多种还原剂反应时,若反应条件越简单,还原剂的还原性越强;同理,一种还原剂与多种氧化剂反应时,反应条件越简单,氧化剂的氧化性越强。
4.同一物质参与氧化还原反应,反应条件相同时,被不同氧化剂氧化的程度越大,氧化剂的氧化性越强。
例4:已知有下列三个氧化还原反应:
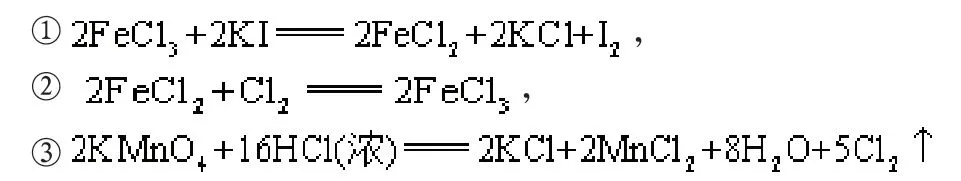
若某溶液中有Fe2+、I-、Cl-三种离子,要将I-氧化除去而又不氧化Fe2+和Cl-,可以加入的试剂是( )。
A.Cl2B.KMnO4C.FeCl3D.HCl
解析:解答这道习题的关键是掌握氧化性、还原性的强弱比较规律,且能够灵活地加以应用。首先找出每个反应的氧化剂及氧化产物;其次,根据强弱规律可知:①中氧化性:Fe3+>I2,②中氧化性:Cl2>Fe3+,③中氧化性:MnO4->Cl2。将不等式联立,得出氧化性强弱关系为:KMnO4>Cl2>FeCl3>I2,还原性强弱顺序为I->Fe2+>Cl->Mn2+。
根据题意,若通过氧化除去I-,但又保留Fe2+与Cl-,需要的试剂应满足:还原性弱于I-,强于Fe2+和Cl-。题中的Fe3+的还原产物为Fe2+,且满足上述条件,因此,本题答案为C。
例5:酸性溶液中离子还原性强弱顺序为SO2>l->Fe2+H2O2>Cl-,则下列反应不可能发生的是( )。
A.2Fe3++2H2O+SO2=2Fe2++SO42-+4H+
B.2Fe2++Cl2=2Fe3++2Cl-
C.l2+SO2+2H2O=H2SO4+2HI
D.H2O2+H2SO4=SO2↑+O2↑+2H2O
解析:假设各选项中的反应均能发生。根据氧化还原的强弱规律可得:A选项还原性:SO2>Fe2+;B选项还原性:Fe2+>Cl-;C选项还原性:SO2>I-,均与题中给出的条件一致。而D选项,还原性H2O2>SO2,与题目已知条件矛盾,因此D项反应不能发生。本题答案为D。

例6:已知下面三个方法都可以用来制取氯气:解析:在这3个反应中,MnO2、O2、KMnO4分别作氧化剂,还原剂均是HCl。反应②无需条件,即可进行;反应①需要加热;反应③不仅需要加热,还需要催化剂。
已知,同种还原剂与不同氧化剂反应时,反应条件越简单,氧化还原反应发生的越容易,氧化剂的氧化性越强。可知本题答案:三种物质氧化性由强到弱的顺序为:KMnO4、MnO2、O2。
三、难易规律
1.物质越易失电子,还原性越强,失电子后越难得到电子。
2.物质越易得电子,氧化性越强,得电子后越难失去电子。
3.同一种氧化剂同时接触到多种还原剂时,氧化剂优先与还原性强的还原剂反应;同理,一种还原剂优先与氧化性强的氧化剂反应。
例7:下列说法中正确的是( )。
A.失电子越多,还原性越强,得电子越多,氧化性越强
C.SO42-中的硫元素化合价是+6价,处于硫的最高价,因此SO42-的氧化性一定很强
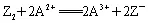
解析:A项,不能用得失电子的数目判断氧化性或还原性的强弱;B项,Cu和Fe2+分别为还原剂和还原产物,B项比较的是还原性强弱;C项,只有氧化性的物质,并不一定有强氧化性;D项正确。
本题答案为D。
例8:向200mLFeBr2溶液中逐渐通入Cl2,其中n(Fe3+)、n(Br2)随通入n(Cl2)的变化如图所示,下列说法不正确的是( )。
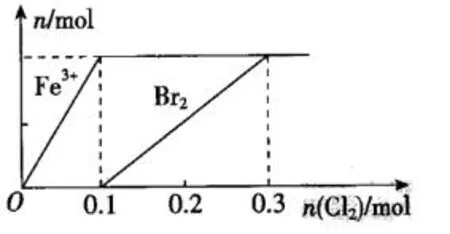
A.氧化性:Br2>Fe3+
B.由图可知,该FeBr2溶液的浓度为1mol/L
C.n(Cl2)=0.12mol时,溶液中的c(Fe3+):c(Br-)=1:8
D.n(FeBr2):n(Cl2)=1:1时,反应的离子方程式为:2Fe2++2Cl2+2Br-=2Fe3++4Cl-+Br2
解析:A项,由图可知,向200mLFeBr2溶液中逐渐通入Cl2时,Fe2+先被氧化,则还原性:Fe2+>Br-,可知氧化性Br2>Fe3+,A正确;
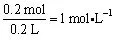
C项,当通入的n(Cl2)=0.12mol时,0.2molFe2+已经完全被氧化为0.2molFe3+,Cl2过量0.02mol,继续与Br-反应,消耗量为0.04mol,溶液中剩余的n(Br-)=0.4mol-0.04mol=0.36 mol。同一溶液中离子浓度比等于其物质的量之比,即:c(Fe3+):c(Br-)=n(Fe3+):n(Br-)=0.2mol:0.36mol=5:9,故C错误;
D项,n(FeBr2):n(Cl2)=1:1时,溶液中Fe2+已经完全被氧化为Fe3+,剩余的Cl2将一半的Br-被氧化为Br2,反应的离子方程式为2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,故D正确。
本题答案为C。
四、守恒规律
氧化剂得到的电子总数与还原剂失去的电子总数相等,即氧化剂中被还原的元素化合价降低的总数等于还原剂中被氧化的元素化合价升高的总数。
例9:配平下列氧化还原方程式
__Fe3++__ClO-+__OH-===__FeO42-+__Cl-+__H2O


