周丛生物对稻田氨挥发的影响*
赵婧宇,韩建刚,孙朋飞,吴永红
(1. 南京林业大学生物与环境学院,南京 210037;2. 中国科学院南京土壤研究所,南京 210008)
周丛生物是普遍生长的稻田水-土界面的一种由微藻、细菌、真核微生物、原生动物、后生动物以及其他自养和异养微生物组成的微生物聚集体[13]。现有研究发现,周丛生物对于调控氮、磷等养分在水土之间的迁移和转化方面发挥着重要作用[14]。微生物吸收氮和磷以使其生长,并保留营养物质作为其生物质的一部分[15-16],而微生物死亡后,氮将作为有机肥料释放回土壤中。研究表明,许多蓝细菌物种能够通过固氮提高农业领域的氮利用率[17],这种养分利用效率的提高,有效减少了因农田径流、挥发或者是下渗损失的养分。周丛生物中的藻类是其在氮素循环中起到关键作用的成分,藻类在一定程度上会增加水体中的pH,这可能会促进水体中的尿素水解,尤其是在添加高浓度氮素的情况下[18-19]。周丛生物可以在一定程度上减少水体和土壤中的氮素浓度,另一方面又会促进水体pH和尿素的水解,增加水体中的氮浓度,因此,周丛生物在对氨挥发上的作用是促进还是抑制尚不明确。基于以上研究背景,本研究拟通过大田微区实验揭示以下问题:(1)周丛生物能否影响稻田氨挥发;(2)周丛生物影响稻田氨挥发的驱动因素与潜在机制,以期寻找新的能够有效抑制稻田氨挥发的技术突破口,助力水稻生产的可持续发展。
1 材料与方法
1.1 研究区概况
试验点位于辽宁省沈阳市苏家屯区十里河镇沈阳生态实验站(北纬41°31′,东经123°24′),平均海拔41 m,属温带半湿润大陆性季风气候,四季分明,雨热同期。年均温7~8 ℃,大于10 ℃的年活动积温3 100~3 400 ℃,年总辐射量120~135 kcal·cm–2,无霜期147~164 d,年降水量650~700 mm。土壤基础理化性质为全氮(TN)1.6± 0.0 g·kg–1、全磷(TP)0.7±0.0 g·kg–1、全钾(TK)10.0±0.2 g·kg–1、总有机碳(TOC)17.2±0.4 g·kg–1。
1.2 试验设计
2019年于水稻试验田中设置面积为1 m×1 m的微区,各微区随机排列。试验共设置2个处理:(1)周丛生物正常生长(WB);(2)添加特丁净(C10H19N5S)改变周丛生物生长处理(IB)。以上两个处理各设置3个重复,共6个微区;此外,设置2个微区用于生物量的破坏性采集,整个实验共设置8个微区。水稻品种采用当地品种,6月6日施用基肥(N肥144.0 kg·hm–2,P肥66.5 kg·hm–2,K肥 94.2 kg·hm–2),7月 11日施用分蘖肥(N 72.0 kg·hm–2),8月25日施用穗肥(N 24.0 kg·hm–2)。特丁净(C10H19N5S)每次施肥后施加,施用量为10 mg·m–2。
1.3 样品采集与理化性质分析
每次施肥后的第2天开始测定氨挥发,测定方法采用连续气流密闭法[20],以每天7:00~9:00 和15:00~17:00 的平均通量值代表日氨挥发通量,持续测定至无明显氨挥发(7~10 d左右)。水稻生长全期(除施肥期)每10天采集一次周丛生物样品,以及对应时期周丛生物生物量样品。施肥期间每2天收集一次周丛生物样品。使用刮铲从稻田表面取出周丛生物,测定微生物组成。田面水采样时间和频率同周丛生物,采集完成后根据常规方法测定pH、TN、3NO-N-、4NH-N+ 含量[21]。pH 使用pH计(pHS-3C),TN 、3NO-N-、4NH-N+ 含量使用流动分析仪(Skalar San++System,荷兰skalar仪器公司)测定。根据标准方法分析土壤性质[22]。总有机碳(TOC)和全氮(TN)含量分别由TOC分析仪(Vario TOC,德国Elementar)和元素分析仪(Vario MAX CN,Elementar,德国)测定,土样经过酸消解后,根据Zhao的方法[23],使用电感耦合等离子体发射光谱仪(Avio 200 ICP-OES,PerkinElmer,美国)分析了全磷(TP)和全钾(TK)的含量。
试验期间气象信息列于表1。
1.4 微生物测序
取周丛生物样品5~10 g,保存于无菌离心管中,液氮运回实验室,置于–80℃保存。通过对(16S/18S)的PCR扩增产物进行高通量测序,分析周丛生物中微生物群落多样性和分布规律,扩增子实验分析如下:(1)DNA 提取:根据样本对应的 DNA 提取试剂盒(FastDNA® Spin Kit For Soil,USA)进行基因组 DNA 抽提后,使用 1%琼脂糖凝胶电泳检测 DNA 的完整性和纯度,NanoDrop One 检测 DNA的浓度和纯度;(2)PCR 扩增及产物电泳检测:以基因组DNA为模板,根据测序区域的选择,使用带barcode的引物及Premix Taq(TaKaRa)进行 PCR 扩增,16S V4 区引物(515F 和 806R)以鉴定细菌多样性,18S V4 区引物(528F 和 706R)以鉴定真核微生物多样性;(3)Pooling 及切胶纯化:使用 GeneTools Analysis Software(Version4.03.05.0,SynGene)对 PCR 产物进行浓度对比后,按照等质量原则计算各样品所需体积,将各 PCR 产物进行混合,使用 E.Z.N.A. ® Gel Extraction Kit 凝胶回收试剂盒回收 PCR 混合产物,TE 缓冲液洗脱回收目标 DNA 片段。
扩增子实验分析完成后,按照 NEBNext ® Ultra™ DNA Library Prep Kit for Illumina ® 标准流程进行建库操作,使用 Illumina Hiseq 2500 平台对构建的扩增子文库进行 PE250 测序。原始测序数据处理流程如下:(1)Paired-end raw reads 数 据 过 滤 :使用 Trimmomatic 软 件V0.33分别对双端的 Raw Reads 数据进行质量过滤,过滤含 N 的 reads、质量值低于 20 及过滤后序列长度低于 100bp的 reads。同时,根据序列首尾两端的 barcode 和引物信息等,利用 Mothur 软件V1.35.1将序列分配至相应的样品中去除barcode和引物,得到质控后的paired-endclean reads;(2)Paired-end clean reads 拼接:对于双端测序数据,根据 PE reads 之间的overlap 的关系,利用 FLASH V1.2.11软件对每对 PE reads 进行拼接,将成对的 reads 拼成一条序列,最小 overlap 长度设置为10bp,拼接序列的 overlap区允许的最大错配比率为 0.1,过滤不符合的 Tags,获得原始的拼接序列(raw tags);(3)Raw Tags 序列质量过滤:利用 Mothur 软件对拼接后的序列进行质量控制及过滤,得到有效的拼接片段(Clean Tags)。
枣棉间作条件下,不同灌水量对棉花产量存在显著影响(图3),适量供水和轻度水分胁迫下产量表现较好,充分供水次之,中度水分胁迫产量最低。M3W3处理产量较M3W1、M3W4分别高62. 5%和13. 9%,M3W2处理产量较M3W1、M3W4分别高55. 6%和9. 0%,M3W4处理产量较M3W1高42. 7%,M3W3处理产量与M3W2处理无显著差异。
1.5 数据分析
氨气挥发通量的计算:
式中,F为氨气的挥发通量(以N计kg·hm–2·d–1);C为氨吸收液回收液中 NH+4-N的浓度(mg·L–1);V为稀硫酸吸收溶液的体积(mL);r为密闭腔的半径(m);6 表示时间转换因子。
氨挥发累计量计算:
式中,sumF为水稻全期氨挥发累积量(kg·hm–2);nF为每天氨挥发量(kg·hm–2·d–1);n为测定天数。
氨挥发损失率计算:
式中,lossF为水稻全期氨挥发损失率(%);ureaM为水稻全期施加的尿素量(kg·hm–2)
使用Execl处理原始数据,SPSS 进行单因素方差分析(ANOVA)、多重比较和相关性分析,显著性水平为0.05,Origin 和Rstudio进行绘图。
2 结 果
2.1 周丛生物对氨挥发的影响
由图1所示,在水稻不同生育期,尿素施用1~2 d内氨挥发通量达到最大值,后期逐渐减少。其中,对照处理中的基肥、分蘖肥、穗肥最大挥发量为8.5、3.6、0.2 kg·hm–2·d–1;使用C10H19N5S改变稻田周丛生物后,基肥施加期间,减少周丛生物生物量,可将氨挥发通量峰值由8.5降至5.1 kg·hm–2·d–1,降低了39.9%;而分蘖肥施加C10H19N5S,可将最大的氨挥发通量由3.6降低至2.0 kg·hm–2·d–1,降低了46%;穗肥添加后的氨挥发通量由 2.0降低至1.2 kg·hm–2·d–1,实验组较对照组降低了40%。综上,添加C10H19N5S改变稻田周丛生物的生长可显著降低稻田氨挥发。
如表2所示,对照组基肥时期氨挥发总量为24.8 kg·hm–2,分蘖期为10.9 kg·hm–2,穗肥期为 0.2 kg·hm–2,整个水稻生长期的氨挥发总量为35.9 kg·hm–2,占总施氮肥量的14.9%;相比较而言,添加C10H19N5S调控周丛生物生长的处理组中不同时期的氨挥发量均受到明显抑制,基肥期和分蘖肥期分别降低 17.6和 10.9 kg·hm–2,穗期降低0.1 kg·hm–2,累计排放量减少至13.9 kg·hm–2,施肥后的氨挥发损失率减少至5.8%。添加C10H19N5S改变了周丛生物,进而减少了稻田氨挥发。
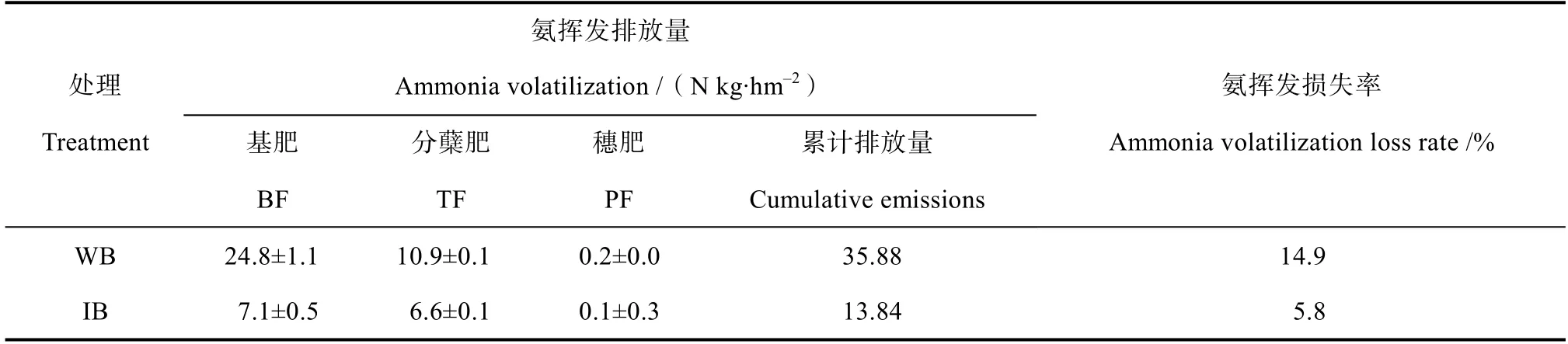
表2 改变周丛生物对氨挥发累积量及氨挥发损失率的影响 Table 2 Effect of addition of C10H19N5S on accumulated ammonia volatilization and ammonia loss rate via volatilization
2.2 周丛生物对田面水理化性质的影响
稻田周丛生物在不同时期对田间水中氮含量也有一定影响。不同处理下的总体表现为施肥后水中氮含量增加,分蘖肥期最明显,然后逐渐降低。从图2中可以看出,添加C10H19N5S改变生物被膜可以显着降低水中 NH+4-N, NO3--N和TN的含量,施肥后影响更大。施用基肥后,改变周丛生物的田间水中 NO3--N、 NH+4-N和TN的含量分别降低了30.7、9.9和104.4 mg·L–1,后期由于烤田的影响,田间水分减少,稻田周丛生物生物量减少,周丛生物对田间养分含量的影响降低。
从图2中可以看出,添加C10H19N5S对水体pH变化有一定影响,尤其以基肥期较为显著。基肥期间,添加C10H19N5S改变周丛生物处理下初期田面水pH较正常生长状态下降低了0.5,在基肥施加的中后期田面水pH逐渐增大,最高达到8.2,较周丛生物正常生长状态下田面水pH高出0.7。而在分蘖肥与穗肥期间,不同处理下的田面水pH差异不大。 从整体上来看,前期控制周丛生物生长一定程度上促进了pH,在添加C10H19N5S改变周丛生物后期的pH相对周丛生物正常生长有所降低。
2.3 C10H19N5S对周丛生物生物量的影响
周丛生物正常生长状态下,生物量峰值达79.9 g·m–2,施肥后明显增加,以基肥施加后最为显著,分蘖肥施加后一周生物量逐渐降低,最低16.9 g·m–2。C10H19N5S的添加对周丛生物生物量有明显的抑制作用(图3),从基肥施加后的第2天开始,周丛生物的生物量最低达到19.7 g·m–2。分蘖肥施加期间,周丛生物的生物量整体有所增高,但是添加C10H19N5S的实验组生物量仍较对照组(WB)低了1.7~5 g·m–2。穗肥添加期间,两组处理下生物量在水稻全期中均最低,这是由水稻生长旺盛,水层和土壤层中光照不充足,同时随着温度的降低,周丛生物的生长受到这两个关键因素的抑制从而减缓[20]。
2.4 C10H19N5S对稻田周丛生物微生物群落组成的影响
从图4a可以看出,真核微生物群落结构中以淡色藻门Ochrophyta(8.1%~67.6%)、隐真菌门Cryptomycota(3.9%~54.8%)、线虫动物Nematoda(0.6%~42.6%)为优势微生物。在这三种优势菌中,隐真菌门Cryptomycota在基肥施加后占比最高,而淡色藻门Ochrophyta在分蘖期和穗期有明显增高。 C10H19N5S的添加对隐真菌门Cryptomycota有明显的影响,在水稻生长全期降低了5.3%~30.3%,而淡色藻门Ochrophyta的丰度在不同时期均表现出先增高后降低的趋势。在水稻分蘖前(6月10日—7月11日),C10H19N5S的添加对线虫动物Nematoda促进作用显著,最高增加了12.5%。
添加C10H19N5S的添加后不同时期周丛生物中的细菌群落结构丰度(图4b)从整体上看以变形菌门 Proteobacteria(52.1%~23.7%)、拟杆菌门Bacteroidetes(58.1%~16.8%)、绿湾菌门Chloroflexi(14.6%~0.8%)、酸杆菌门Acidobacteria(11.0%~3.3%)为优势菌种。基肥施加后期(6月10日)和分蘖肥施加前期(7月 11日),厚壁菌门Firmicutes丰度明显增大至10.7%~14.4%。C10H19N5S添加后变形菌门 Proteobacteria丰度在分蘖期降低了0.7%~13.5%,拟杆菌门Bacteroidetes丰度在苗期降低了3.4%~6.2%。相反,绿湾菌门Chloroflexi和酸杆菌门Acidobacteria的丰度均明显增加,最高增加了4.5%和1.3%。
2.5 周丛生物介导的氨挥发影响因子
将不同时期田间氨挥发与周丛生物影响下的田面水理化性质、周丛生物中的群落结构进行相关性分析,并筛选相关性较好的因子(P<0.1)作为能够有效影响周丛生物介导的氨挥发过程的潜在因素。如图5所示,不同时期,周丛生物的生物量与氨挥发呈显著正相关(r=0.526,P=0.053),即氨挥发通量随着周丛生物生物量的增加而增大。然而,周丛生物细菌门上仅芽孢单菌门Gemmatimonadetes的相对丰度与氨挥发通量显著相关,占优势的几种细菌和真核微生物并无显著相关,推测周丛生物中是稀有物种主导氨挥发。对于田面水中的理化性质,NH+4-N、 NO3--N、TN含量均与氨挥发有一定的相关性,其中 3NO-N- 极相关(P<0.01),对于各种地面气象资料,风速是其中影响氨挥发的一个最重要因素。
将显著相关的微生物以及理化因子作为自变量,不同处理瞬时氨挥发量作为因变量,建立多元线性逐步回归分析,进行模型拟合,可以基于稻田周丛生物预测稻田氨挥发通量。根据表公式(4)可知:以 3NO-N-、平均风速(WIN)和周丛生物生物量(Biomass)作为输入量而构建的模型,预测效果和稳定性较好,调整后R2达到0.860。
3 讨 论
氨挥发是发生在稻田气层、水层以及土壤层上的相对复杂的物理化学反应过程,主要是由尿素施入土壤后水解,形成碳酸铵,然后分解产生铵离子、氨气、二氧化碳和氢氧根,一般在施肥后的7~10 d左右发生。本实验中氨挥发通量在施肥后的2~4 d为峰值[25],5 d后开始下降。已有研究表明施氮量的增加会提高田面水中pH以及 NH+4-N浓度,从而增加了稻田氨挥发损失以及水稻对氮素吸收[26-27]。施用氮肥后,田面水中的 NH+4-N以及pH均出现了短暂性升高,其后随时间的延长逐渐降低。本研究施肥处理下,稻田氨挥发损失率达到14.9%,高于Ju 等[28]对中国北部稻田土壤的氨挥发损失率(11.6%)的研究。传统的田间施肥方式会刺激稻田氨挥发的增长,同时由于稻田长期淹水状态,黏土沉积在耕作层的下层减少了施肥后通过地下水渗漏流失的氮素,增加了通过水解产生的氨挥发损失[29-30]。
在添加特丁净后,稻田不同时期的氨挥发量出现了明显的降低,氨挥发损失率降低了9.1%,表明使用特丁净调控周丛生物生长能够显著影响稻田氨挥发。C10H19N5S常作为田间除草剂,在除草的同时可以抑制藻类的光合作用,降低藻类浓度,短时间抑制田面水pH升高[31-32],已有研究表明C10H19N5S在伴随着脲酶抑制的使用效果显著[33]。基于C10H19N5S对田间藻类以及pH的作用,以及对稻田中较小的毒性,本实验选用低浓度的C10H19N5S改变周丛生物结构,降低周丛生物中的藻类活性,以减少藻类通过光合作用引法的氨挥发加速。从结果看,添加C10H19N5S后周丛生物中的生物量出现了降低,同时,在相关性分析中稻田周丛生物生物量与氨挥发也有显著的正相关。C10H19N5S可以通过抑制光系统II(PSII)来干扰藻类的光合作用[34],它与PSII的QB位点特异性结合,减少电子向质体醌库的转移[35],抑制光合作用氧气的释放[36]。Brust等[37]研究表明C10H19N5S对附生藻类的抑制作用是周丛生物生物量减少的直接原因。与对照组(周丛生物正常生长)相比,添加C10H19N5S后周丛生物量减少,并且田面水 NH+4-N、 NO-3-N浓度降低,因此,实验组和对照组氨挥发量的差异是由水体中氨挥发底物浓度的变化引起的。对周丛生物中的微生物群落结构进一步分析发现,添加C10H19N5S对拟杆菌门Bacteroidetes、变形菌门Proteobacteria等丰度有抑制作用,有研究表明这种嗜营养微生物在高氮环境下群落丰度更高,而低氮环境中绿湾菌门Chloroflexi和酸杆菌门Acidobacteria等贫营养微生物更易生存[38-39]。可见添加C10H19N5S降低周丛生物的整体生物量,使稻田水土界面保持在低氮水平,从而抑制氨挥发。
通过构建模型发现,相比于田面水 3NO-N- 含量和地面风速两个因素,周丛生物的生物量变化对氨挥发有更大的影响作用,日氨挥发通量在周丛生物生物量减少的情况下减少,而田面水 NH+4-N浓度的降低是周丛生物影响氨挥发的直接原因。
4 结 论
田面水氮素含量、地面风速、周丛生物生物量是影响氨挥发通量的三个关键因子。其中周丛生物对稻田氨挥发有一定促进作用,添加C10H19N5S抑制周丛生物生长后可以降低田间9.1%的氨挥发损失率,但是这种抑制作用并不是通过降低田面水pH实现的,而是通过改变周丛生物的生物量及其微生物组成以及降低田面水中氮素含量产生作用,添加C10H19N5S能够降低稻田周丛生物生物量,改变周丛生物微生物群落结构,抑制富营养化微生物(拟杆菌门Bacteroidetes、变形菌门Proteobacteria)的丰度,增加贫营养化微生物(酸杆菌门Acidobacteria)的丰度,进而以低成本、高效的技术降低氨挥发累积量,缓解稻田温室气体排放带来的环境压力。

