端侧吻合与端端吻合改善低位前切除术后排粪功能的安全性和有效性的Meta分析
侯森 赵世栋 刘凡 叶颖江
超过80%的直肠癌患者在低位前切除术后(low anterior resection,LAR)会出现不同程度的排粪功能障碍,主要表现为排粪失禁、排粪频繁、排粪紧急、排空困难、排粪疼痛、排粪不规律、排粪不连续、夜间遗粪等症状,这些症状对患者的日常生活、心理、社交产生负面影响,被统称为低位前切除综合征[1-2]。已有研究表明,术中肠道重建方式会影响患者术后的排粪功能[3]。端侧吻合(side to end anastomosis,SEA)又称Baker吻合,是指按TME原则将直肠完全游离,在肿瘤下方2 cm或更远处横断直肠,结肠远端封闭后,将其侧面与远端直肠或肛管进行吻合。SEA操作简单,且不受骨盆空间的限制,近年来SEA的临床应用和研究逐渐增多[4-5]。然而,SEA相较于传统的端端吻合(straight colorectal anastomosis,SCA),对于直肠癌低位前切除患者术后排粪功能是否具有明显优势,以及其手术的安全性如何,目前尚无定论。因此,本研究通过搜集国内外比较SEA和SCA进行重建的随机对照试验(randomized controlled trail,RCT)或临床对照研究(controlled clinical trail,CCT),对其临床应用的安全性和有效性进行Meta分析,为临床提供可靠的循证医学证据。
资料与方法
一、检索策略
计算机检索1997年10月至2021年1月中国知网、万方、维普、PubMed、EMbase、Cochrane Library数据库的国内外文献资料,文献语言仅限中英文。并追溯纳入文献以及相关综述或Meta分析的参考文献。英文检索词包括“rect*”“cancer/tumor/carcinoma/neoplasm”“side to end/end to side/Baker”“end to end/straight colorectal anastomosis”;中文检索词包括“直肠癌”“直肠肿瘤”“端侧吻合”“端端/直接吻合”,以万方数据库为例,检索式为:(题名或关键词=“直肠癌”or题名或关键词=“直肠肿瘤”)and(题名或关键词=“端侧吻合”or题名或关键词=“直接吻合”or题名或关键词=“端端吻合”)。
二、文献纳入与排除标准
纳入标准:(1)人群:明确诊断为直肠癌并接受低位前切除手术;(2)干预措施:使用SEA进行肠道重建;(3)对照措施:使用SCA进行肠道重建;(4)结局指标:包含手术并发症和/或术后排粪功能;(5)RCT或CCT,无论是否进行分配隐藏或采用盲法。
排除标准:(1)单个研究样本量<30例;(2)数据不完整或无法提取的研究;(3)会议摘要、综述、病例报告和其他非对照研究的文献资料;(4)文献重复发表。对符合要求的文献提取相关数据后采用Review Manager 5.4软件进行Meta分析。
三、文献质量评价
两名研究者对纳入文献的质量进行独立评价,并进行交叉核实。若有分歧,通过讨论或由第三名研究者参与评价。首先通过阅读标题及摘要删除个案及无关文献;再通过全文阅读,参照纳入标准和排除标准决定是否纳入。回顾性研究采用组卡斯尔-渥太华(Newcastle⁃Ottawa scale,NOS)文献质量评价量表[6]评估,前瞻性随机对照研究采用Jadad改良量表[7]评估。
四、数据提取
两名研究者对纳入文献进行全文阅读后,按照预先设计的数据资料提取表提取相关数据。(1)一般资料:第一作者姓名、发表年限、文献类型、样本量、性别、年龄、肿瘤位置、分期、是否进行新辅助治疗、吻合口位置等;(2)结局指标:手术时间、是否进行保护性造口、术后并发症发生率、术后排粪功能。
五、数据分析
采用Review Manager 5.4软件进行Meta分析。计数资料采用比值比(odds ratio,OR)作为合并统计量,计量资料:对于同一指标,如采用相同测量工具得到的结果,则采用加权均数差(weighted mean difference,WMD)作为合并统计量;如采用不同测量工具得到的结果,则采用标准均数差(standarded mean difference,SMD)作为合并统计量。所有统计量均计算95%可信区间(confidence interval,CI)。各研究间的异质性采用χ2检验,同质性研究(P>0.05,I2<50%)采用固定效应模型进行Meta分析,异质性研究(P<0.05,I2>50%)则采用随机效应模型进行Meta分析。通过倒漏斗图评估发表偏倚。P<0.05认为差异有统计学意义。
结 果
一、纳入文献及质量评价
按照检索策略共获得文献225篇,经严格筛选最终纳入 7 篇[8-14],见图 1。其中 5 篇[8-10,13-14]为RCT研究,2篇[11-12]为CCT研究。共计552例患者,其中SEA组268例,SCA组284例。NOS量表文献质量评估显示,2篇CCT评分均为7分,Jadad改良量表评估显示,5篇前瞻性RCT为4分以上,均为中高质量文献。纳入文献一般资料见表1。
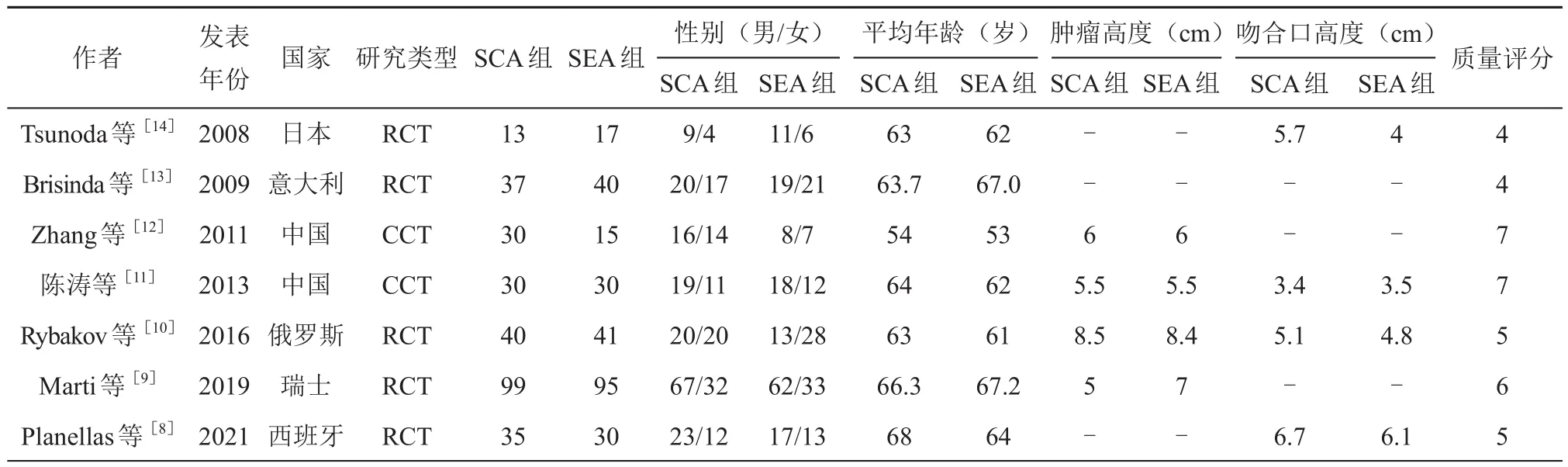
表1 纳入的7篇文献基本资料及质量评估
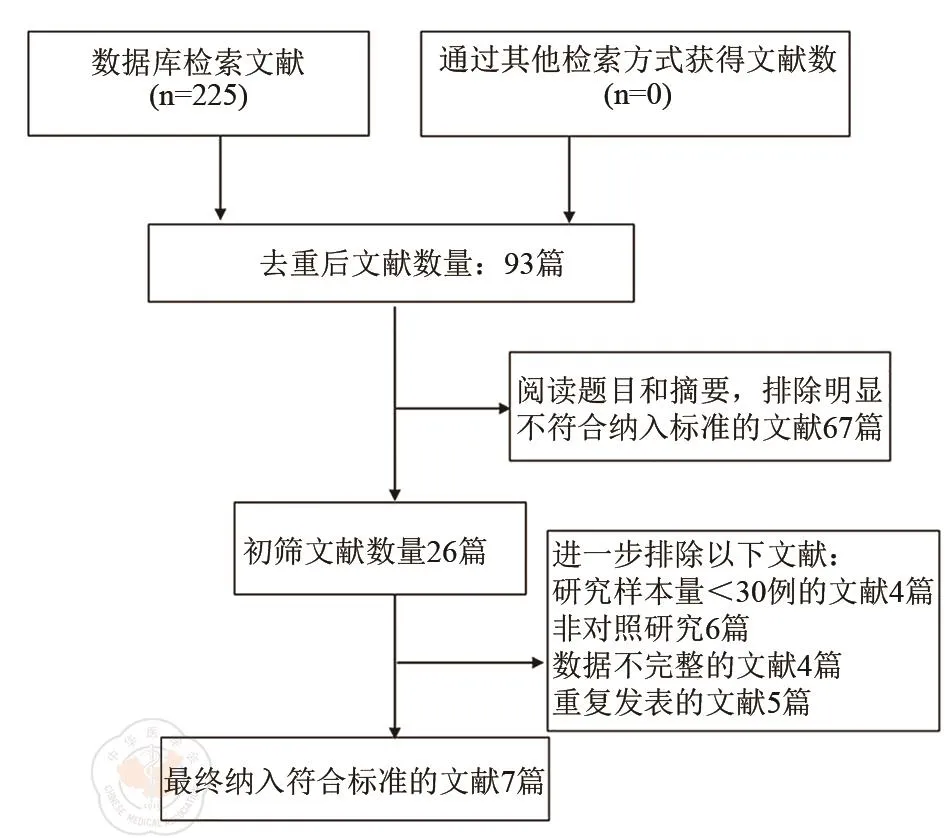
图1 文献筛选流程图
二、手术安全性分析
1.手术时间:共有3篇文献[8,12-13]报道了手术时间的情况,各研究间具有同质性(P=0.54,I2=0%),合并统计量,采用固定效应模型。结果显示SEA组和SCA组手术时间差异无统计学意义(OR=1.28,95%CI:-3.75~6.30;P=0.62),见图2。
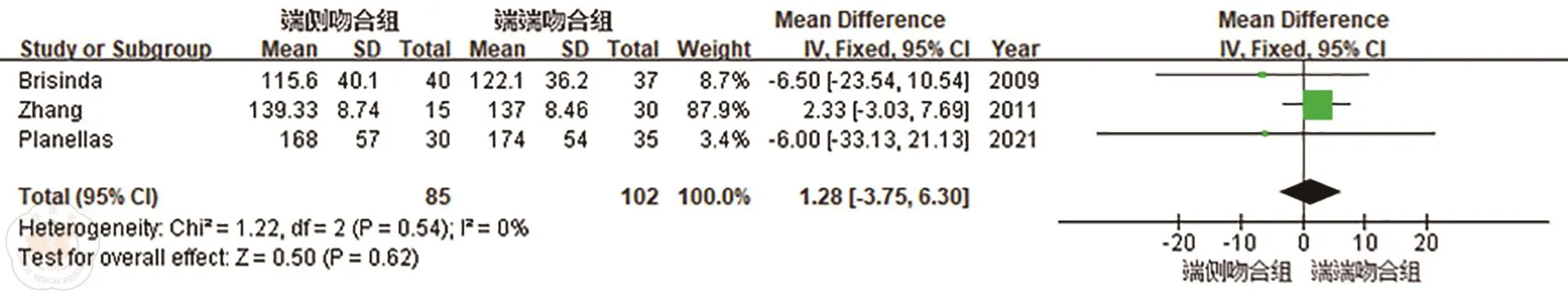
图2 端侧吻合(SEA)和端端吻合(SCA)手术时间的比较
2.保护性造口:共有 5篇文献[8-10,13-14]报道了吻合口漏的情况,各研究间具有异质性(P=0.008,I2=80%),合并统计量,采用随机效应模型。结果显示SEA组保护性造口发生率较SCA组低,但差异无统计学意义(OR=3.52,95%CI:0.55~22.66;P=0.19),见图3。逐一分析单个研究对合并效应量的影响,异质性主要来自Tsunoda等[14]的研究,去除该研究后,合并统计量后研究具有同质性(P=0.56,I2=0%),两组间保护性造口率差异仍无统计学意义(OR=1.34,95%CI:0.63~2.84;P=0.44)。
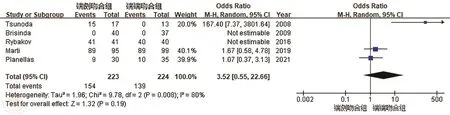
图3 端侧吻合(SEA)和端端吻合(SCA)保护性造口发生率的比较
3.术后吻合口漏:共有6篇文献[8-13]报道了吻合口漏的情况,各研究间具有同质性(P=0.18,I2=35%),合并统计量,采用固定效应模型。结果显示SEA组吻合口漏发生率较SCA组低,但差异无统计学意义。(OR=0.50,95%CI:0.23~1.08;P=0.08),见图4。
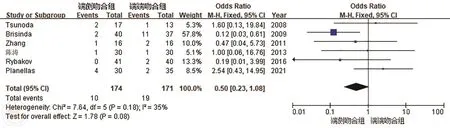
图4 端侧吻合(SEA)和端端吻合(SCA)吻合口漏发生率的比较
4.术后吻合口出血:共有4篇文献[8,10-12]报道了吻合口出血的情况,各研究间具有同质性(P=0.63,I2=0%),合并统计量,采用固定效应模型。结果显示SCA组和SEA组吻合口出血发生率差异无统计学意义。(OR=1.08,95%CI:0.26~4.44;P=0.92),见图5。
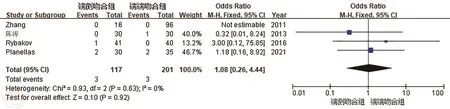
图5 端侧吻合(SEA)和端端吻合(SCA)吻合口出血发生率的比较
5.术后盆腔脓肿:共有2篇文献[11,13]报道了术后盆腔脓肿的情况,各研究间具有同质性(P=0.36,I2=0%),合并统计量,采用固定效应模型。结果显示SEA组盆腔脓肿的发生率较SCA组明显降低(OR=0.18,95%CI:0.05~0.66;P=0.01),见图6。
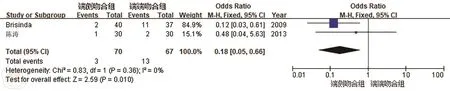
图6 端侧吻合(SEA)和端端吻合(SCA)术后盆腔脓肿发生率的比较
6.其他并发症:陈涛[11]和Brisinda等[13]的研究报道了切口感染、切口哆开和肺部感染的发生率;Brisinda等[13]和Rybakov等[10]的研究报道了尿潴留的发生率。合并统计量,均采用固定效应模型,上述并发症的发生率与肠道重建方式无关,结果见表2。

表2 端侧吻合(SEA)组与端端吻合(SCA)组手术相关并发症的比较
三、改善术后排粪功能的有效性分析
各研究对于术后排粪功能随访的时间节点并不完全一致,术后6个月为多数研究共同的随访节点,提取术后6个月的排粪功能指标,并进行Meta分析。
1.使用止泻药:共有4项[10-12,14]研究报道了术后6个月患者使用止泻药的情况,各研究间具有同质性(P=0.16,I2=45%),合并统计量,采用固定效应模型。结果显示SCA组和SEA组使用止泻药差异无统计学意义(OR=0.79,95%CI:0.34~1.82;P=0.58),见图7。
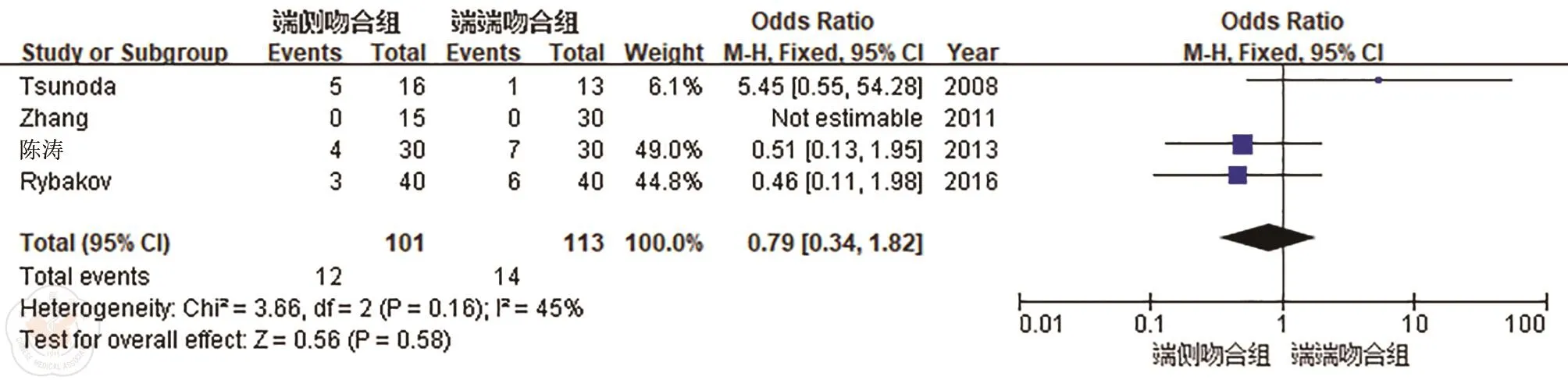
图7 端侧吻合(SEA)和端端吻合(SCA)术后6个月使用止泻药的比较
2.夜间遗粪:共有2项[10-11]研究报道了术后6个月患者夜间遗粪的情况,各研究间具有同质性(P=0.87,I2=0%),合并统计量,采用固定效应模型。结果显示SEA组夜间遗粪的发生率低于SCA组,差异具有统计学意义(OR=0.35,95%CI:0.14~0.85;P=0.02),见图8。
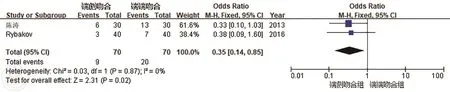
图8 端侧吻合(SEA)和端端吻合(SCA)术后6个月夜间遗粪的比较
3.排粪急迫:共有 2 项研究[10,14]报道了术后6个月患者排粪急迫的情况,各研究间具有同质性(P=0.44,I2=0%),合并统计量,采用固定效应模型。结果显示SCA组和SEA组排粪急迫的发生率差异无统计学意义(OR=0.41,95%CI:0.12~1.34;P=0.14),见表3。
4.使用会阴垫:共有 2 项[10,12]研究报道了术后6个月患者使用会阴垫的情况,各研究间具有同质性(P=0.51,I2=0%),合并统计量,采用固定效应模型。结果显示两组患者使用会阴垫的差异无统计 学 意 义 (OR=0.59, 95%CI: 0.24~1.48;P=0.26),见表3。
5.区分排气排粪:共有 2 项研究[12,15]报道了术后6个月患者区分排气排粪的情况,各研究间具有同质性(P=0.68,I2=0%),合并统计量,采用固定效应模型。结果显示两组患者区分排气排粪的比例差异无统计学意义(OR=0.75,95%CI:0.27~2.12;P=0.59),见表3。
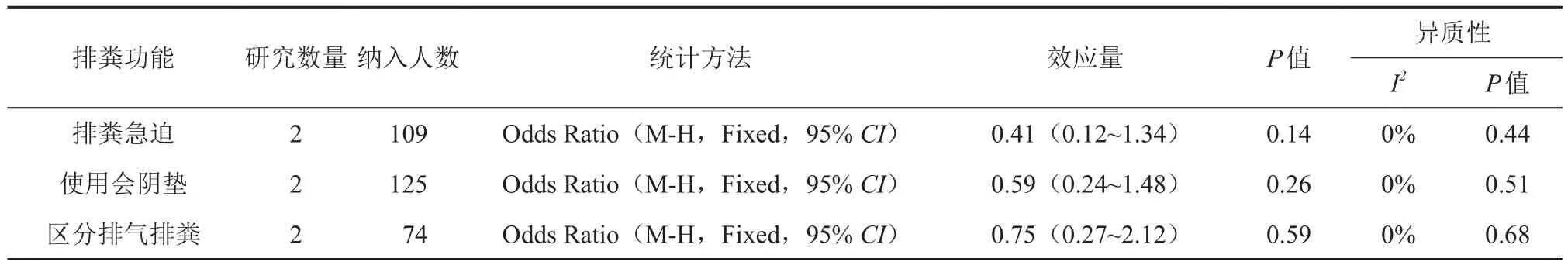
表3 端侧吻合(SEA)组与端端吻合(SCA)组术后6个月排粪功能的比较
四、发表偏倚
以术后吻合口漏发生率为指标进行漏斗图分析,漏斗图内6个点大致分布在倒置的漏斗内,提示发表偏倚对结果的影响较小,见图9。
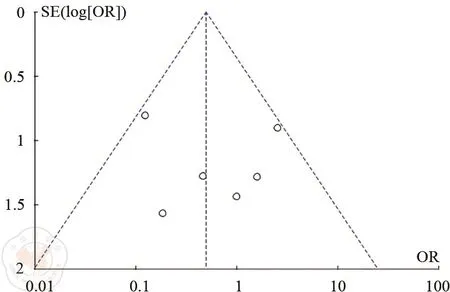
图9 端侧吻合(SEA)和端端吻合(SCA)术后吻合口漏发生率漏斗图
讨 论
直肠癌术中常用的重建方式包括SCA、J型贮袋吻合(colonic J-pouch anastomosis,CJP)和SEA等。既往研究认为CJP是贮袋重建的“金标准”,它可以有效改善患者术后的排粪功能。但是后续研究发现高达30%接受CJP重建的患者会出现粪便排空问题[15],同时CJP对操作空间的要求较高,难以应用于骨盆狭窄的患者[16],因此肠道重建技术亟需改进。SEA最早由Baker[17]在1950年提出,用来克服结肠和直肠的管径差异,它保留了CJP的贮袋结构,并且保证了吻合口部位充分的血运,理论上可以作为改善术后排粪功能的一个安全有效替代方法[18]。然而,Sailer等[19]通过动物实验发现,SEA与SCA相比,并未体现出改善排粪功能的优势。因此,SEA的临床应用需要更多的循证医学证据。
本文纳入的7项临床研究均来自于最近13年以内发表的中高质量文献,结果显示SEA术后盆腔脓肿的发生率以及术后6个月夜间遗粪的发生率均明显低于SCA。SEA组吻合口漏的发生率低于SCA组,但组间差异无统计学意义。两种重建方式的手术时间、保护性造口率、吻合口出血、切口感染、切口哆开、肺部感染的发生率差异均无统计学意义。患者术后6个月排粪急迫、使用会阴垫、使用止泻药的发生率以及区分排气排粪的能力差异均无统计学意义。
虽然SEA增加了构建贮袋的步骤,但是手术总耗时相较于SCA并没有增加。一方面是因为SEA的贮袋构建过程相对简单,操作易于掌握[5];另一方面是因为影响手术时间的因素较多,比如肠道粘连、是否游离脾曲、术中出血等,肠道重建方式可能并非手术时间的独立影响因素。
吻合口漏是直肠癌术后最常见的并发症之一,国外文献报道其发生率约为11%[20-21],国内报道其发生率为4.2%~7.1%[22]。本Meta分析显示SEA组吻合口漏的发生率为5.7%,SCA组吻合口漏的发生率为11.1%,然而二者差异无统计学意义。SEA重建方式和CJP类似,其吻合口的血运优于SCA,这是其降低吻合口漏发生率的理论基础[19]。有研究指出,出血量(>70 mL)以及未进行保护性造口是直肠癌低位前切除术后发生吻合口漏的独立危险因素。而在未进行保护性造口的患者中,吻合口漏的发生率与出血量(>70 mL)和吻合口高度(<5 cm)有关[22]。遗憾的是,由于纳入的6项研究缺少出血量和吻合口高度的原始数据,无法进行亚组分析来排除混杂因素对于吻合口漏发生率的影响。此外,纳入Meta分析的6项研究中,吻合口漏的发生率自2.5%~14.9%不等,可能是由于不同研究中心对于吻合口漏诊断标准不同。目前普遍使用的吻合口漏分级标准是Clavien-Dindo(CD)并发症分级标准[23]和国际直肠癌研究组(international study group of rectal cancer,SREC)严重程度分级标准[24]。如果对影像学怀疑吻合口漏但没有症状的亚临床吻合口漏不加以诊断,则会导致吻合口漏的报道发病率比实际发病率更低[25]。
盆腔脓肿是直肠癌术后另一常见的并发症,其发生率为12%[21]。直肠癌术后吻合口漏导致的盆腔炎或腹膜炎通常是一过性的,经引流等措施后大多可以很好控制。而盆腔脓肿不同于一般的吻合口漏,其不但表现顽固,迁延不愈,而且还可继续发展形成盆腔至肛周皮肤的窦道等[26]。研究表明术后出现盆腔脓肿的患者总体生存率明显低于其他患者[27]。因此降低盆腔脓肿的发生率不仅减轻了患者的痛苦,也有助于改善患者的远期预后。在本研究中,SEA组盆腔脓肿发生率为4.3%,SCA组为19.4%,组间差异具有统计学意义。两组并发症的发生率与既往文献报道差别较大,这可能是由于部分研究将盆腔脓肿归入吻合口漏并发症中,导致盆腔脓肿的报道较少。
直肠癌术后伤口感染的发生率为7%[21]。本Meta分析显示SEA组和SCA组伤口感染的发生率分别是17.1%和23.9%。一项多中心研究发现直肠癌术后伤口感染与肿瘤分期以及腔镜手术中转开腹有关[28]。Brisinda等[13]的研究纳入的患者均为T1~T2期,伤口感染率为26.0%,陈涛等[11]的研究纳入T1~T3期的患者,伤口感染率为13.3%,二者均未报道中转开腹率。样本量小以及不同研究对于切口感染的定义尚不统一也可能是不同研究之间伤口感染率差异的原因。
本研究结果显示,在术后6个月,SEA可降低患者夜间遗粪的发生率。排粪感知和排粪运动的机制非常复杂,目前尚未完全阐明。一项日本的前瞻性对照研究比较了分别行短贮袋(3 cm)和长贮袋(6 cm)SEA的患者的术后肛管直肠测压结果,发现长贮袋组患者重建后的“新直肠”最大耐受容积明显大于短贮袋组,但是两组患者的排粪功能、失禁评分差异无统计学意义,这说明SEA对肠道蠕动的改变作用可能比增加“新直肠”容量对排粪功能的影响更大[23]。SEA或许可以改变患者肠蠕动的节律,因而减低了患者夜间遗粪的发生率。
本研究存在一定的局限性:(1)纳入研究数量和患者总数较少;(2)纳入文献并非均为随机对照研究;(3)回顾性研究本身的设计缺陷;(4)只纳入了中英文文献,可能存在语言偏倚;(5)仅有两个结局指标纳入5项以上的研究,其余结局指标纳入文献数少、样本量小;(6)仅进行术后6个月排粪功能的比较,缺少术后早期以及远期排粪功能评价;(7)结局指标较少:安全性指标缺少出血量、术中游离脾曲发生率、二次手术、远期生存相关结局指标的比较;有效性指标缺少排气失禁、排粪失禁、排粪次数、排粪聚集、排粪疼痛、排空障碍等常见排粪功能障碍的比较。
综上所述,SEA是一种可以有效改善术后排粪功能的肠道重建方式,其手术安全性不劣于传统的SCA。但是由于纳入文献数量较少、文献质量不等、研究方法及评价方法等方面的差异,导致本研究结果可能存在一定的偏倚。因此,还需要更多前瞻性、大样本、多种心及随机对照研究来进一步验证。

