白酒酿造环境绿色木霉新菌株及其在低度潮饮酒方面的应用
廖勤俭,赵 东,安明哲,李杨华,乔宗伟,郭 艳,王小琴,周韩玲
(宜宾五粮液股份有限公司,四川宜宾 644007)
丟糟是传统固态酿造白酒酒醅蒸酒后丢弃的糟醅,是酿酒的副产物。20 年前,我国白酒年产量就已达600多万吨,丟糟年产量高达1800多万吨[1],近年来大多白酒企业都有扩产,丟糟产量也随之增加。虽然丟糟中尚残留有不少的营养物质,但由于发酵填充物稻壳质量分数占40%~50%,而稻壳主要成分为粗纤维,因此限制了丟糟的回收利用。此外,丟糟中水的质量分数在60%左右,贮存困难,易霉变,常常只能作为废弃物丢掉,既污染环境,又造成了极大的资源浪费。
绿色木霉(Trichoderma viride)通常能产生多种具有生物活性的酶系,是产纤维素酶活性最高的菌株之一,所产生的纤维素酶对作物有降解作用,国内外对绿色木霉在纤维素降解方面的研究很多[2-6],同时绿色木霉又是一种资源丰富的拮抗微生物,在植物病理生物防治中具有重要的作用[7-15]。多项研究结果表明,6-戊基-2H-吡喃-2-酮是木霉属代谢产生的一种抗生素,是起抑菌作用的主要物质[18-21]。该物质生物活性高,可作为生物抗菌剂应用于农业生产,同时又具有乳酪、椰香等风味,是安全的食品添加剂。
2021 年1 月,百润*天猫*青年志发布的中国年轻人低度潮饮酒Alco-pop 品类文化白皮书显示,低度潮饮酒Alco-pop 正在颠覆中国传统的白酒文化,成为年轻人可以自主掌控的新酒精生活方式。由此,本研究从白酒酿造生产环境中分离筛选耐乳酸的木霉属菌株,探讨以丢糟为原料发酵生产6-戊基-2H-吡喃-2-酮的可行性,以提高丟糟的循环利用价值,进一步探索发酵产物6-戊基-2H-吡喃-2-酮在低度潮饮酒Alco-pop 方面的应用前景,具有一定的环保效益和经济效益。
1 材料与方法
1.1 材料、试剂及仪器
原料及耗材:丟糟,宜宾五粮液股份有限公司;马铃薯葡萄糖琼脂(PDA)培养基,广东环凯微生物科技有限公司;采集培养基:乳酸浓度20 g/L 的霉菌液体培养基,广东环凯微生物科技有限公司;乳酸(88.9%),美国奥泊丽公司;甲醇(LC-MS 级),德国默克公司。
仪器设备:电热压力灭菌锅,上海申安医疗器械公司;生化培养箱,上海一恒科技仪器有限公司;电子天平,梅特勒-托利多仪器上海有限公司;美国Agilent 公司1290 高效液相色谱仪(HPLC)-6520B质谱检测器(Q-TOF);美国Agilent 公司7890 气相质谱仪(GC-MS);Agilent MassHunter 数据采集工作软件、定性分析软件;Milli-Q 超纯水机(美国Mimpore公司)。
1.2 实验方法
1.2.1 木霉菌株的分离鉴定
1.2.1.1 菌株分离纯化
利用重力沉降法,将制备好的采集培养基100 mL,于四川宜宾市五粮液酿酒生产区敞口放置6 h,无菌纱布封口后于28 ℃下恒温培养5 d,培养基中长出疑是木霉属丝状菌体,接种环挑取菌体于PDA 培养基中,编号并划线纯化,重复纯化2~3次,直至平板上的菌落都为同一形态。挑取单菌落制成水浸片,于显微镜下观察菌体细胞形态,环境木霉分离纯化完成,斜面试管保存于4 ℃冰箱。
1.2.1.2 菌株的鉴定和归类
菌株形态学鉴定:将经活化的木霉属新菌株用接种环划线接种于PDA 培养基上,28 ℃培养3 d,观察菌落形态特征;挑取菌丝,以乳酸石炭酸棉蓝染色液进行染色制片,于显微镜下观察菌株细胞特征。
菌株分子生物学鉴定:取纯菌的菌体富集液6000 r/min 离心10 min,弃上清液,采用SK8259 真菌试剂盒提取菌株基因组DNA;选用ITS 通用引物对正向引物ITS1(tccgtaggtgaacctgcgg)、反向引物ITS4(tcctccgcttattgatatgc),扩增基因组DNA,反应条件为:95 ℃预变性5 min后,进入以下循环:94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸90 s,30 个循环;72 ℃延伸10 min。将PCR 扩增产物寄送生工生物工程(上海)股份有限公司进行测序。
1.2.2 菌株乳酸耐受力及最适代谢条件测定
将适量的无菌水加入已活化的绿色木霉PDA试管斜面培养基中,用无菌接种环洗脱孢子,制备孢子悬液。PDA 培养基,分装15 份,各50 mL 于150 mL 三角瓶中,其中10 份加入不同量的乳酸调节pH 值,另5 份空白对照样加入等量的PDA 培养基补充,自然pH 值;121 ℃灭菌20 min,冷却,无菌条件下,各接入1 mL绿色木霉菌悬液,10份乳酸调节培养基和1份空白对照培养基于28 ℃恒温培养,另4 份空白对照培养基分别放置在24 ℃、26 ℃、30 ℃、32 ℃4 个不同温度下恒温培养,培养15 d后,LC-TOF测定6-戊基-2H-吡喃-2-酮的产率。
1.2.3 菌株抗菌性测定
将适量的无菌水加入已活化的黄曲霉(编号WLY-L-HQM-1,来自于酿酒大曲)试管斜面培养基中,用无菌接种环洗脱孢子,制备孢子悬液;再将孢子悬液稀释至适宜梯度,涂布于已灭菌PDA平板培养基上,另空白对照平板上不涂布黄曲霉菌悬液,在平板培养基中心,用打孔器各接入直径5 mm 的绿色木霉PDA 平板菌,在28 ℃下恒温培养3 d,观察绿色木霉对黄曲霉的抑制效果。
1.2.4 GC-MS分析条件
色谱条件:色谱柱为HP-5MS 毛细管柱(60 m×0.25 mm,0.25 µm);升温程序:柱初温40 ℃,保持2 min,以4 ℃/min 升温至220 ℃,保持15 min;载气(He)流速1.2 mL/min,2.4 kPa,进样量1µL;分流比:10∶1。
质谱条件:电子轰击(EI)离子源;电子能量70 eV;传输线温度275 ℃;离子源温度200 ℃;质量扫描范围m/z 35~500。
1.2.5 6-戊基-2H-吡喃-2-酮定量检测前处理方法
液体样品:取样品0.1 mL 于5 mL 离心管中,甲醇逐级稀释至原样的1/100,膜过滤后进样LCQTOF。
固体样品:称取样品10 g 于100 mL 烧杯中,加入30 mL 甲醇超声提取10 min,甲醇定容至100 mL为提取液,甲醇逐级稀释至提取液的1/100,膜过滤后进样LC-QTOF。
1.2.6 LC-QTOF定量分析条件
流动相:A 为超纯水溶液(含0.5 g/L 甲酸),B 为甲醇,梯度洗脱为:0~7 min:30%v/v~98%v/v B(仪器自动实现梯度变化);7.1~12 min:98%v/v B;12.1~14 min:30%v/v B;停止洗脱。色谱柱为ZORBAX Eclipse Plus C18柱,柱长100 mm,内径为2.1 mm,粒径为1.8 μm,柱温为30 ℃,流速为0.2 mL/min,进样量为2 μL。
质谱条件为:采用电喷雾离子源,负模式,干燥气温度325 ℃,干燥气流量10 L/min,雾化气压力40 psig,毛细管电压4000 V,毛细管出口电压110 V。
1.2.7 丟糟培养基制备
种子培养基:丟糟∶高粱∶水质量比为10∶10∶6,按比例混合均匀,120 ℃高压灭菌30 min,冷却后,用接种环挑取绿色木霉平板菌丝接种到种子培养基,接种量10%,28 ℃恒温培养5 d。
发酵培养基:(A)纯丟糟;(B)高粱粉∶水质量比为6∶4;(C)丟糟∶高粱粉∶水质量比为7∶2∶1;分别置于5 L 的不锈钢桶中,混匀,于120 ℃灭菌30 min。灭菌结束后,取出,倒入已灭菌浅盘中冷却至30 ℃以下,无菌条件下,各接入种子培养基并混匀,接种量10%,放置于28 ℃下恒温培养,间歇喷洒无菌水并搅拌。
2 结果与分析
2.1 菌株纯化鉴定结果
利用高乳酸浓度的PDA 培养基分离纯化出1株可培养木霉,在PDA 平板上培养3 d,菌落呈圆形、白色菌丝发散状,中心出现绿色孢子,如图1 所示。染色镜检,可见分生孢子梗,分生孢子梗有隔膜,垂直对称分枝,产生分生孢子,分生孢子单生或簇生,圆形或卵形,如图2 所示。根据菌株的形态特征,初步判定为木霉。提取菌株基因组DNA,通过真菌通用引物扩增ITS 序列,将得到的菌株核糖体DNA(rDNA)的ITS 序列在NCBI 数据库上进行BLAST 序列比对,确定为绿色木霉,并命名为WLY-L-M-1。该菌株已于2020 年9 月2 日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为CGMCC No.20254。
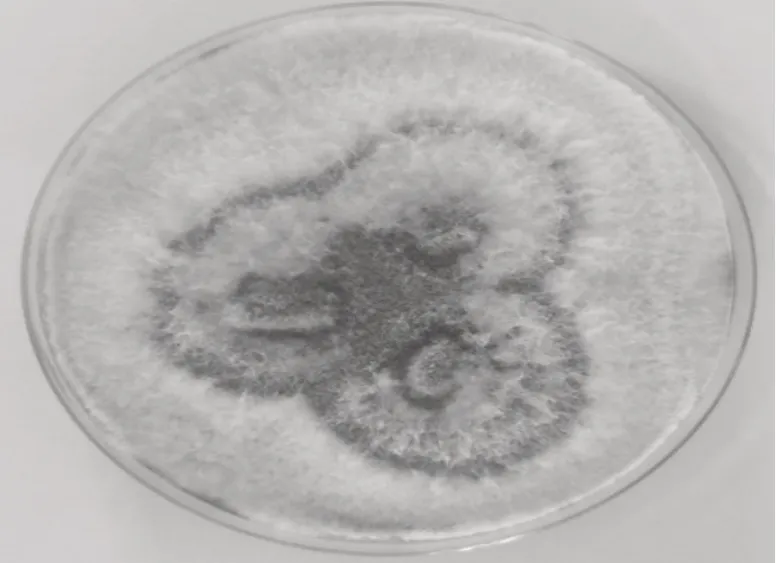
图1 菌落形态
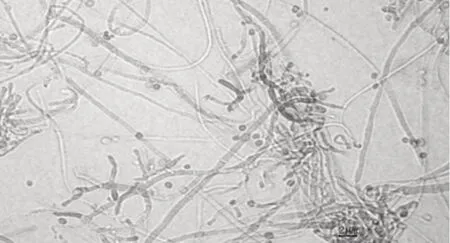
图2 镜检细胞形态
2.2 菌株产物分析结果
打孔器取直径5 mm 的平板菌5 份于顶空瓶中,采用顶空固相微萃取,结合气相质谱法鉴别分析菌株挥发性产物。该菌株在PDA 培养基上培养3 d 后,感官嗅觉具有明显的椰香风味,木霉具有产6-戊基-2H-吡喃-2-酮的能力[18-21],该物质是具有乳酪、蘑菇、椰香等风味的食品香料。由此利用GC-MS 进行菌株挥发性产物分析,结果表明,菌株主产物为6-戊基-2H-吡喃-2-酮;副产物主要有3-甲基丁醇、苯乙醇、己醇,都是白酒中存在的风味成分,GC-MS总离子流图如图3所示。
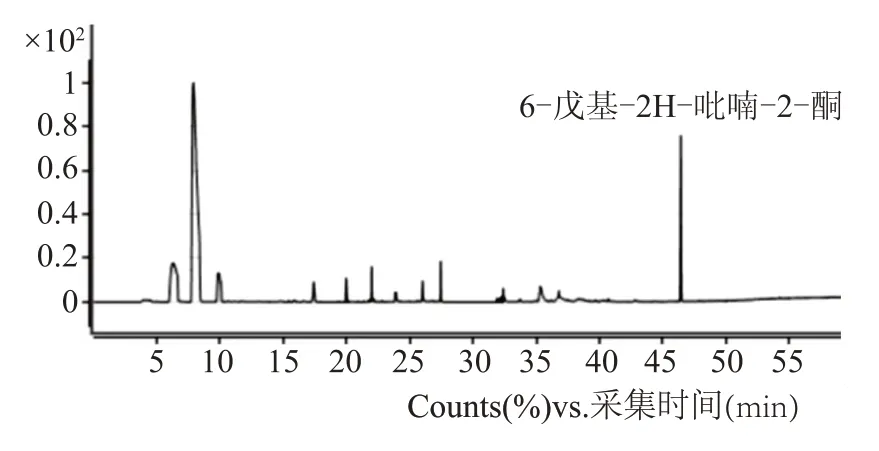
图3 GC-MS分析图
2.3 乳酸对菌株生长代谢的影响及最适代谢条件
各发酵培养基0.1 mL,甲醇稀释,0.2 μm 膜过滤后作为待测样品,进样液相色谱-四极杆飞行时间质谱(LC-QTOF),测定6-戊基-2H-吡喃-2-酮含量。各乳酸-PDA 发酵培养基,过滤得菌体,菌体烘干称重,与1 mL 绿色木霉菌悬液烘干重量(初始菌体重量)对比。表1 所示为乳酸耐受性情况表,大于初始菌体重量则说明菌体生长,以“√”表示,小于或等于初始菌体重量则说明菌体没有生长,以“×”表示。由表1 可看出,该绿色木霉菌株最高耐受乳酸浓度为52.62 g/L,最低耐受pH 值为1.97。但是,随着乳酸浓度的增高,6-戊基-2H-吡喃-2-酮的产率会受到影响。5 个空白PDA 培养液放置在不同温度下培养15 d,如图4 所示,当培养温度在26~30 ℃之间时,6-戊基-2H-吡喃-2--酮产率较高且基本一致,为该菌株的最适培养温度范围。
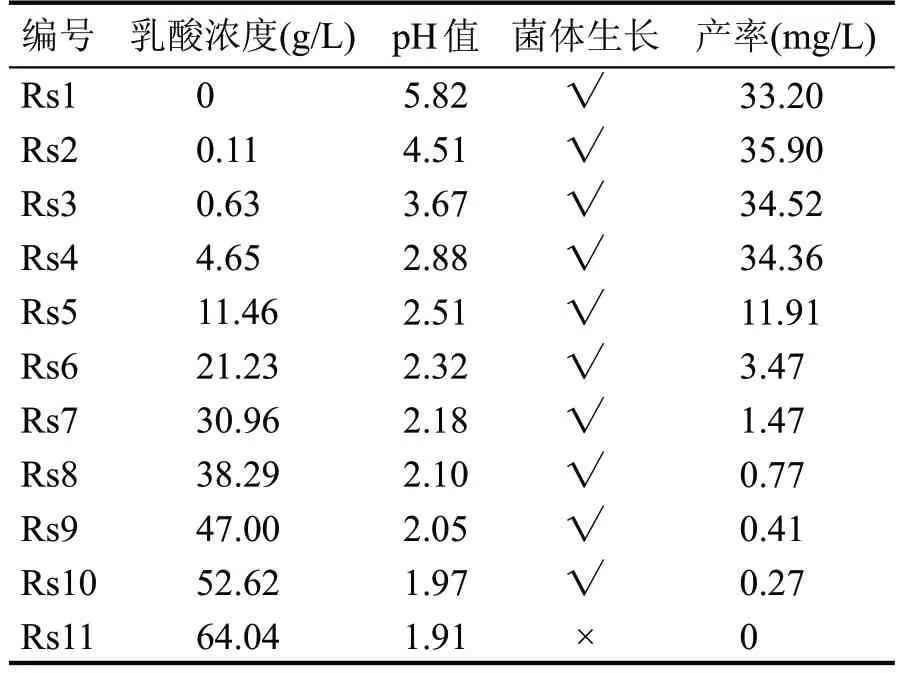
表1 乳酸耐受性
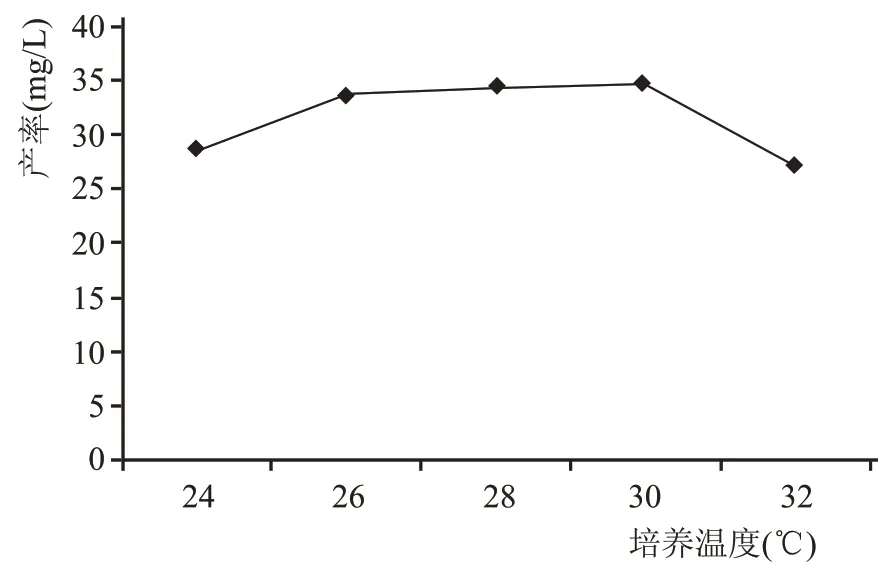
图4 培养温度与产率关系
2.4 绿色木霉菌株对大曲黄曲霉抑制能力
绿色木霉菌株代谢产物6-戊基-2H-吡喃-2-酮具有植物病毒抗菌性[18-21],由此针对酿酒生产用大曲或原辅料中可能污染的黄曲霉,进行该菌株的抗菌性实验,空白对照平板与黄曲霉涂布平板对比如图5 所示。PDA 平板中心绿色木霉圆形发射状生长区域未见黄曲霉生长,平板边缘,未生长绿色木霉的地方才可见黄曲霉菌落,由此说明,该绿色木霉对大曲黄曲霉生长具有一定的抑制能力。
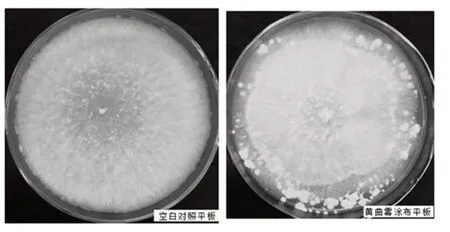
图5 黄曲霉抑制能力对照图
2.5 绿色木霉利用丟糟为原料发酵生产6-戊基-2H-吡喃-2-酮的应用
木霉属具有较强分解纤维素能力,绿色木霉通常能够产生高度活性的纤维素酶,对纤维素的分解能力很强;2.3 实验结果表明,该绿色木霉菌株具有高乳酸浓度耐受性,酿酒生产中产生的副产物丟糟中乳酸含量通常在2%左右,低于该菌株的乳酸最高耐受浓度;由此,以丟糟为原料,通过浅盘固态发酵法,对比不同培养基方案(1.2.7)6-戊基-2H-吡喃-2-酮的产率。试验结果如图6 所示,该木霉在三组培养基中都能代谢产6-戊基-2H-吡喃-2-酮,发酵培养15 d,纯丟糟培养基A中产率最低,也能达120 mg/L以上;纯高粱培养基B中产率次之;丟糟混合少量高粱的培养基C 产率最高,达1200 mg/L 以上。培养基C 因丟糟中添加了少量的高粱,补充了碳氮源,同时丟糟中存在的大量糠壳成分提高了原料的疏松度和透气性,便于木霉菌丝蔓延生长,产率更高。
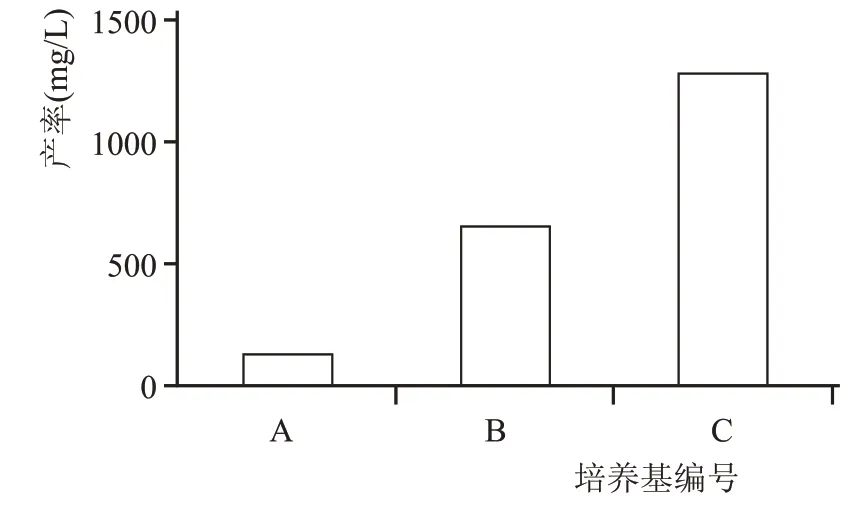
图6 不同培养基产率对比图
2.6 绿色木霉发酵产物6-戊基-2H-吡喃-2-酮在低度潮饮酒方面的应用
取2.5 中培养基C 组发酵醅与固态酿酒糟醅以1∶10 比例混合均匀为试验糟醅,上10 L 的不锈钢蒸馏装置中蒸馏,每100 mL 分段收集馏出液,同时以纯固态酿酒出窖糟醅作为空白对照糟醅进行蒸馏。利用LC-QTOF检测绿色木霉发酵主产目标物6-戊基-2H-吡喃-2-酮,确定目标物在蒸馏各段的馏出情况,检测结果表明,试验糟各段馏出液中均有一定量的目标物,说明目标物易于随着蒸馏过程馏出。图7 和图8 分别为试验样1#和对照样1#的LC-QTOF 检测总离子流图(TIC)和提取离子流图(EIC),表2 为专业品评组对试验样和对照样各段馏出液进行盲评后综合的尝品记录结果,可以看出,各试验样和对照样香气基本一致,但1#—4#试验样没有对照样中味不净的香味缺陷,也没有明显的异杂味,优于对照样;随着馏出液中乙醇浓度的降低,试验样中6-戊基-2H-吡喃-2-酮的香味凸显出来,5#—8#试验样中逐渐呈现出了乳酪香、椰香风味,为具有水果风味的低度潮饮酒的开发提供了可行性。
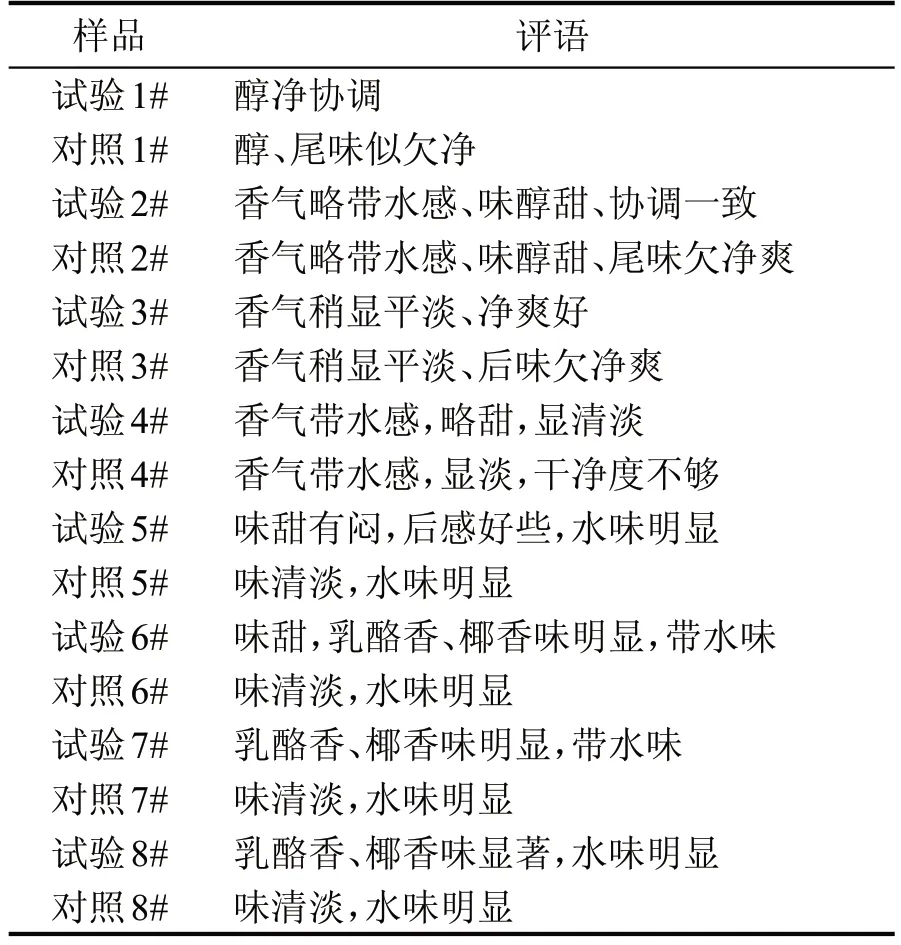
表2 尝品记录表
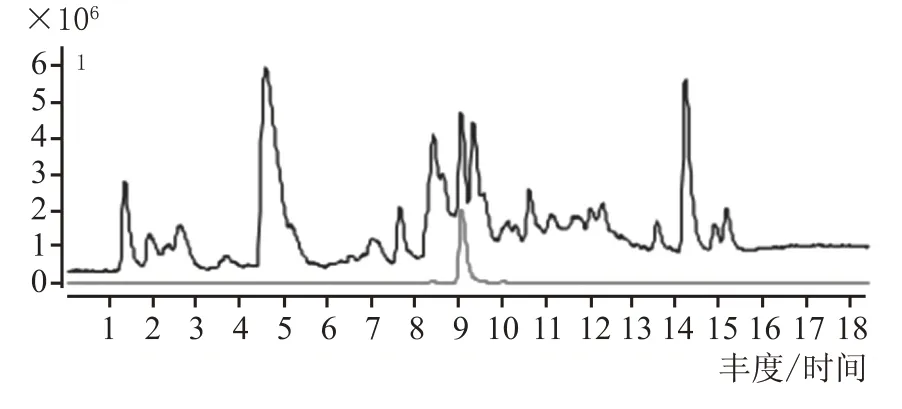
图7 试验糟醅TIC和EIC图
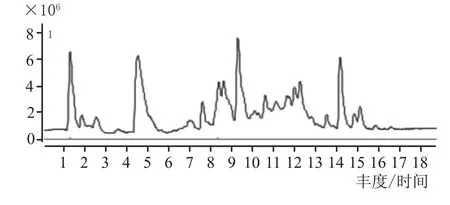
图8 对照糟醅TIC和EIC图
3 结论
本研究从酿酒生产环境中筛选到1 株耐乳酸的绿色木霉新菌株,该菌株最高耐受乳酸浓度为52.62 g/L;最低耐受pH 值为1.97;最适代谢温度为26~30 ℃。经GC-MS 对绿色木霉挥发性产物分析,该绿色木霉代谢主产物为6-戊基-2H-吡喃-2-酮,代谢副产物主要有3-甲基丁醇、苯乙醇、己醇等香气成分。针对酿酒生产环境存在的潜在生物污染进行菌株抗菌性实验结果表明,该菌株具有一定的大曲黄曲霉抑制能力。
分别以纯丢糟、纯高粱、丢糟和高粱混合物3种培养基进行浅盘发酵,实验结果表明,该绿色木霉在3 种原料中都能生长代谢产6-戊基-2H-吡喃-2-酮,且在丢糟和高粱混合培养基中代谢产率最高,达1200 mg/L 以上。该绿色木霉新菌株能有效的利用白酒副产物丟糟为原料代谢生产具有生物活性的风味物质6-戊基-2H-吡喃-2-酮,提供了一条丟糟循环利用新途径,具有很大的经济效益和环保效益。
该木霉丟糟发酵醅与固态酿酒发酵出窖糟醅混蒸试验结果表明,木霉丟糟发酵醅的加入,可以适当地改善蒸馏基酒风味。木霉发酵主产物6-戊基-2H-吡喃-2-酮是具有明显乳酪香、椰香风味的安全食品添加剂,该物质在高度乙醇体系中风味易被掩盖,在低度乙醇体系中风味突出。根据中国年轻人低度潮饮酒Alco-pop 品类文化白皮书,低度潮饮酒是酒精度15%vol以下、甜味突出的低度酒,是现今年轻人更青睐的具有明显舒适度的新品类,而新一代年轻人正在成为酒水消费的主力军,由此,将该绿色木霉发酵产物,通过适当的蒸馏方式进入基酒,并将此种基酒应用于勾调低度潮饮酒,具有广阔的探索空间和应用前景。

