卒中急性期NIHSS评分与卒中后抑郁相关性的meta分析
任大为,赵子珺,果海姣,杨保林,陈旭,付景娜,赵亚争,刘文丽,刘佩云,卫景沛
卒中后抑郁(post-stroke depression,PSD)是卒中最常见的并发症之一,可发生在卒中后的任意时间段,使患者自身的生活质量下降,由此导致的死亡也随之增加[1]。因此,在卒中急性期预测PSD的发生并给予针对性的预防具有重要临床意义。目前对PSD发生机制的认识并不完善,急性期内的神经功能缺损程度与PSD的发生是否相关尚不清楚。病理研究发现,卒中后相关神经传导通路受损,神经递质释放、传递异常是发生PSD的可能原因之一[2],而神经功能缺损程度越高,则越有可能损伤相关神经传导通路;神经功能缺损越严重,患者生活质量越受影响,这也可能与PSD有关。NIHSS是临床较常用的评价卒中患者神经功能缺损程度的量表,具有较高的信度和效度[3-4]。目前国内外针对急性期NIHSS评分与PSD相关性的研究多为样本量较小的单中心研究,且研究结果不一致。本研究采用循证医学方法,综合多项病例对照研究进行效应量合并分析,以评价卒中急性期的NIHSS评分与PSD的相关性,为PSD的早期预测及防治提供更可靠的证据。
1 资料与方法
1.1 文献检索 以“卒中”“脑出血”“脑缺血”“脑梗死”“抑郁”“卒中后抑郁”“神经功能评分”“NIHSS”为关键词在中国知网、万方数据知识服务平台、维普网检索;以“stroke”“apoplexy”“infarction”“hemorrhage”“cerebrovascular disorder”“depression”“depressive disorder”“mood disorder”“affective disorder”“NIHSS”为主题词在PubMed中进行检索。检索时间为建库至2019年10月。
以PubMed为例列举检索式:
#1 stroke OR apoplexy OR infarction OR hemorrhage OR cerebrovascular disorder
#2 depression OR depressive disorder OR mood disorder OR affective disorder
#3 NIHSS
#4 #1 AND #2 AND #3
1.2 纳入和排除标准 纳入标准:①研究类型为病例对照研究,以是否有PSD分为PSD组和非PSD组;②研究对象均符合卒中的诊断标准,且头颅CT或MRI检查有脑缺血或脑实质出血的证据;③研究方法中说明NIHSS评分的采集时间及PSD的诊断时间,且NIHSS评分采集时间在卒中后1个月内;④研究文献提供PSD组和非PSD组的样本量、NIHSS评分均数、标准差;⑤研究文献中PSD组与非PSD组总样本量>100;⑥中文或英文文献。
排除标准:①研究对象有精神疾病病史;②研究对象包含TIA或蛛网膜下腔出血;③研究文献不能提供有效数据;④病例报告、综述;⑤数据错漏或数据可疑;⑥重复发表的文献。
1.3 质量控制 由2名研究员利用纽卡斯尔-渥太华量表(Newcastle-Ottawa scale,NOS)独立对纳入文献进行方法学质量评价[5],不一致时由第3名研究员裁定。评价内容包括人群选择、可比性和暴露评价。NOS对文献质量的评价采用星级系统的半量化原则,满分为9分,本研究纳入NOS评分≥7分的文献。
1.4 统计学方法 应用Review Manager 5.3软件进行数据的综合、归纳和评估,对所收集的数据进行异质性检验及合并MD值和95%CI的计算。当纳入研究异质性检验结果I2<50%且P>0.05时,采用固定效应模型进行meta分析;当纳入研究异质性检验结果I2≥50%或P<0.05时,则采用随机效应模型进行meta分析。采用漏斗图分析潜在的发表偏倚。运用随机效应模型与固定效应模型结果比较的方法进行敏感性分析,评价meta分析结果的稳定性。
2 结果
2.1 文献检索结果 初检出5040篇文献,其中中文文献4916篇(97.54%),英文文献124篇(2.46%)。经查重、阅读题目及摘要、进一步阅读全文,根据纳排标准,最终纳入15篇研究文献[6-20],文献筛选流程详见图1。
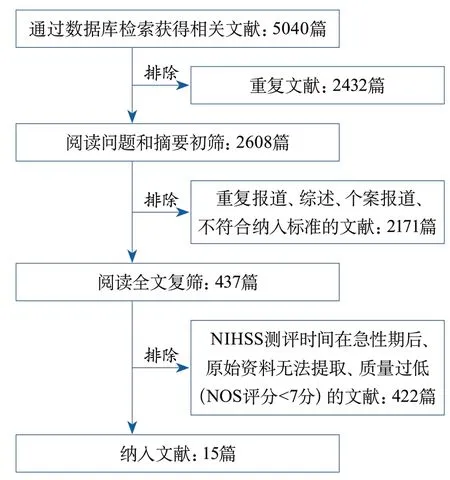
图1 文献筛选流程
2.2 文献基本特征及质量评价 纳入文献中包含中文文献12篇[9-20]、英文文献3篇[6-8],共3050例研究对象,其中PSD组共1157例,非PSD组共1893例。研究地域包含中国、韩国、波兰。经NOS质量评价,10篇文献的NOS评分为8分,5篇文献的NOS评分为7分。一篇文献包含首发卒中和再发卒中两部分研究[11],分别纳入本次meta分析中。文献基本特征和质量评价见表1。
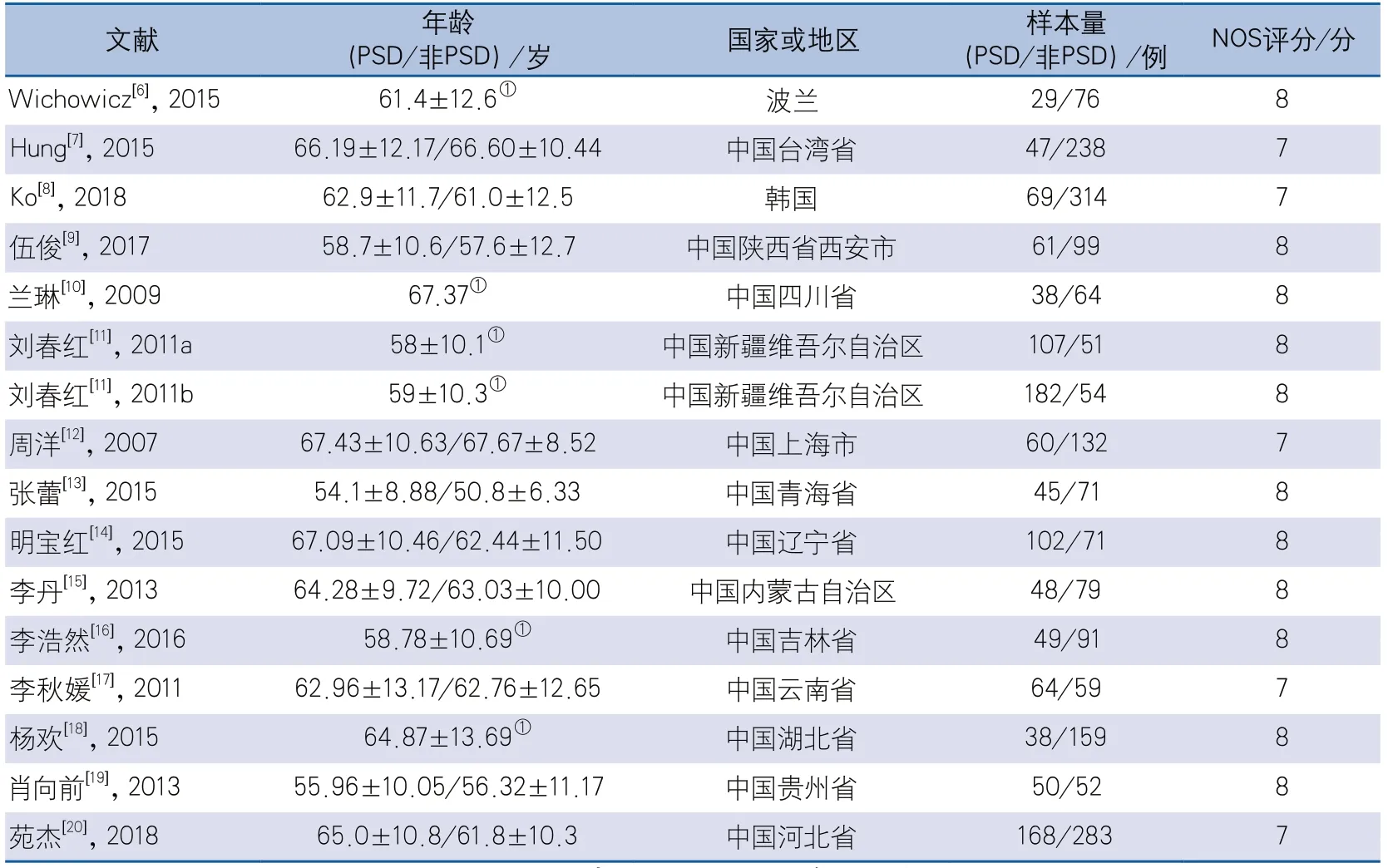
表1 纳入研究文献的基本特征和质量评价结果
2.3 整体meta分析结果 经异质性检验,纳入meta分析的16项研究的PSD与NIHSS评分的相关性存在异质性(I2=75%,P<0.01),采用随机效应模型进行meta分析。结果显示,PSD组NIHSS评分高于非PSD组,差异有统计学意义(MD0.92,95%CI0.48~1.37,P<0.01)(图2)。
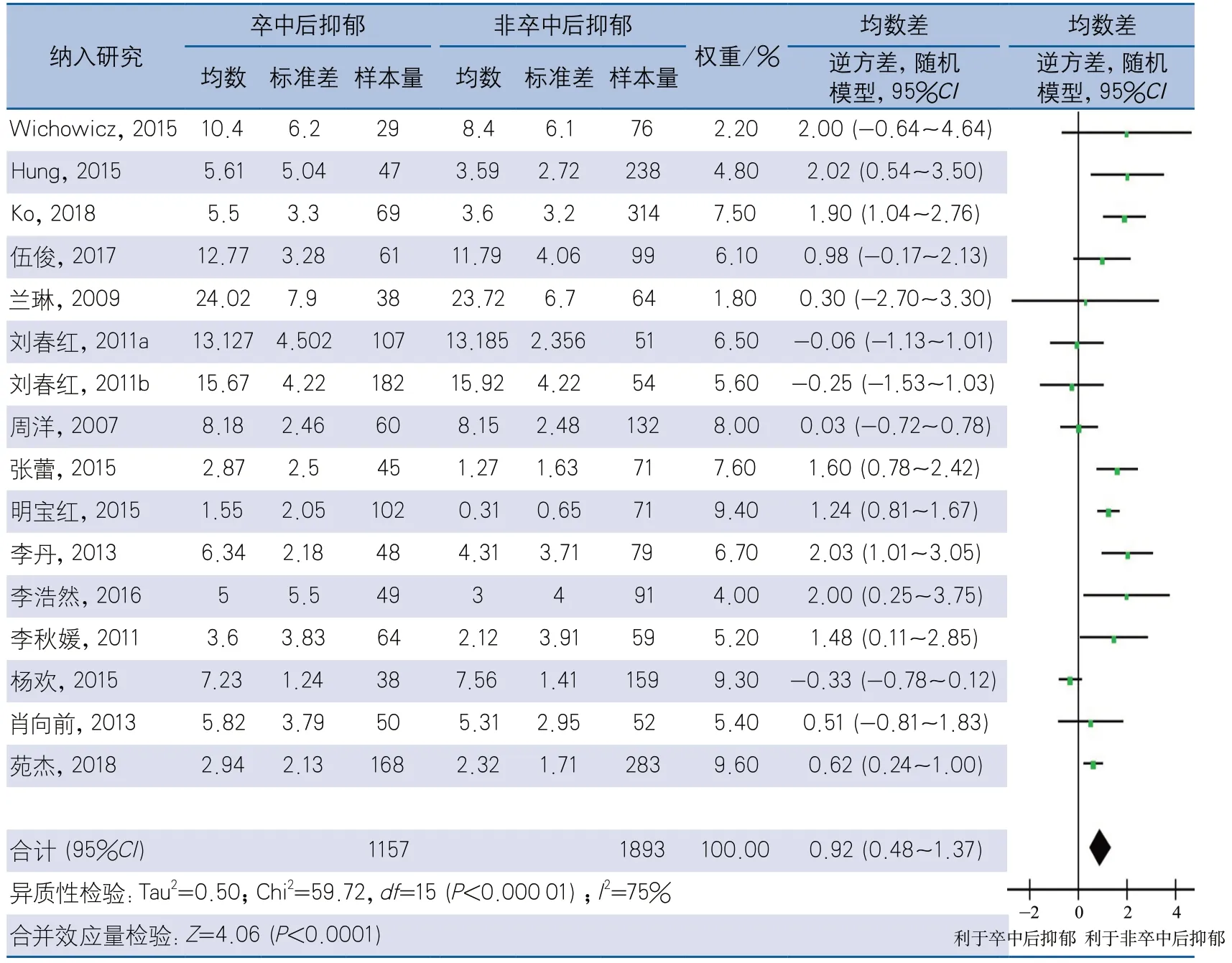
图2 卒中后抑郁与NIHSS评分的相关性整体分析森林图
2.4 亚组meta分析结果
来到宾馆,客房紧闭。敲门过后,等了好一会儿,门开了,夏梓桑睡眼惺忪,又显出几分惶惑。沙发上放着一款黑色公文包,真皮制作,上面还有L V标志,这是蒋海峰的研究所发的,当年给紫云拿去了,怎么会在这儿呢?
2.4.1 根据地域分组 在16项研究中,14项来自中国,其余2项分别来自韩国和波兰,考虑种族和地域的影响,将14项来自中国的研究结果合并进行亚组分析。异质性检验显示,14项研究间存在异质性(I2=75%,P<0.01),采用随机效应模型计算合并效应量,结果显示,PSD组NIHSS评分高于非PSD组,差异有统计学意义(MD0.81,95%CI0.36~1.27,P<0.01)(图3)。
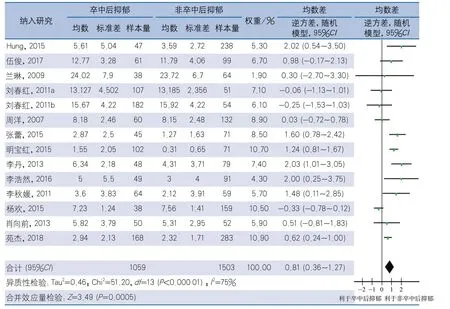
图3 卒中后抑郁与NIHSS评分的相关性中国研究亚组分析森林图
2.4.2 根据首发卒中与再发卒中分组 研究对象均为首发卒中的研究有8项,再发卒中的研究有1项,其余7项研究均为首发与再发卒中患者混合纳入。对纳入对象均为首发卒中的研究进行亚组分析,经异质性检验,8项研究间无明显异质性(I2=38%,P=0.13),采用固定效应模型计算合并效应量,结果显示,PSD组NIHSS评分高于非PSD组,差异有统计学意义(MD1.24,95%CI0.82~1.67,P<0.01)(图4)。仅有1项研究报道了再发卒中急性期NIHSS评分与PSD的关系,故作描述性分析。刘春红等[11]对236例再发缺血性卒中患者进行研究,结果显示,急性期内发生PSD的患者与未发生PSD的患者入院时NIHSS评分差异无统计学意义(MD-0.25,95%CI-1.53~1.03,P=0.70)。
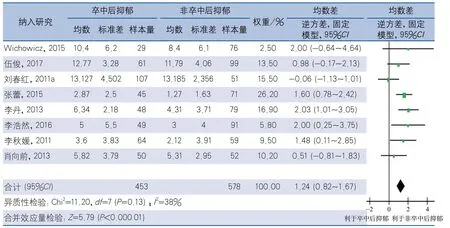
图4 卒中后抑郁与NIHSS评分的相关性首发卒中亚组分析森林图
2.4.3 根据卒中类型分组 在16项研究中,11项研究仅纳入缺血性卒中患者,其余5项研究均包含缺血性卒中、出血性卒中两类患者。将11项针对缺血性卒中的研究进行异质性检验,结果显示,各文献间存在统计学异质性(I2=60%,P=0.006),采用随机效应模型进行meta分析,结果显示,PSD组NIHSS评分高于非PSD组,差异有统计学意义(MD0.83,95%CI0.38~1.29,P<0.01)(图5)。
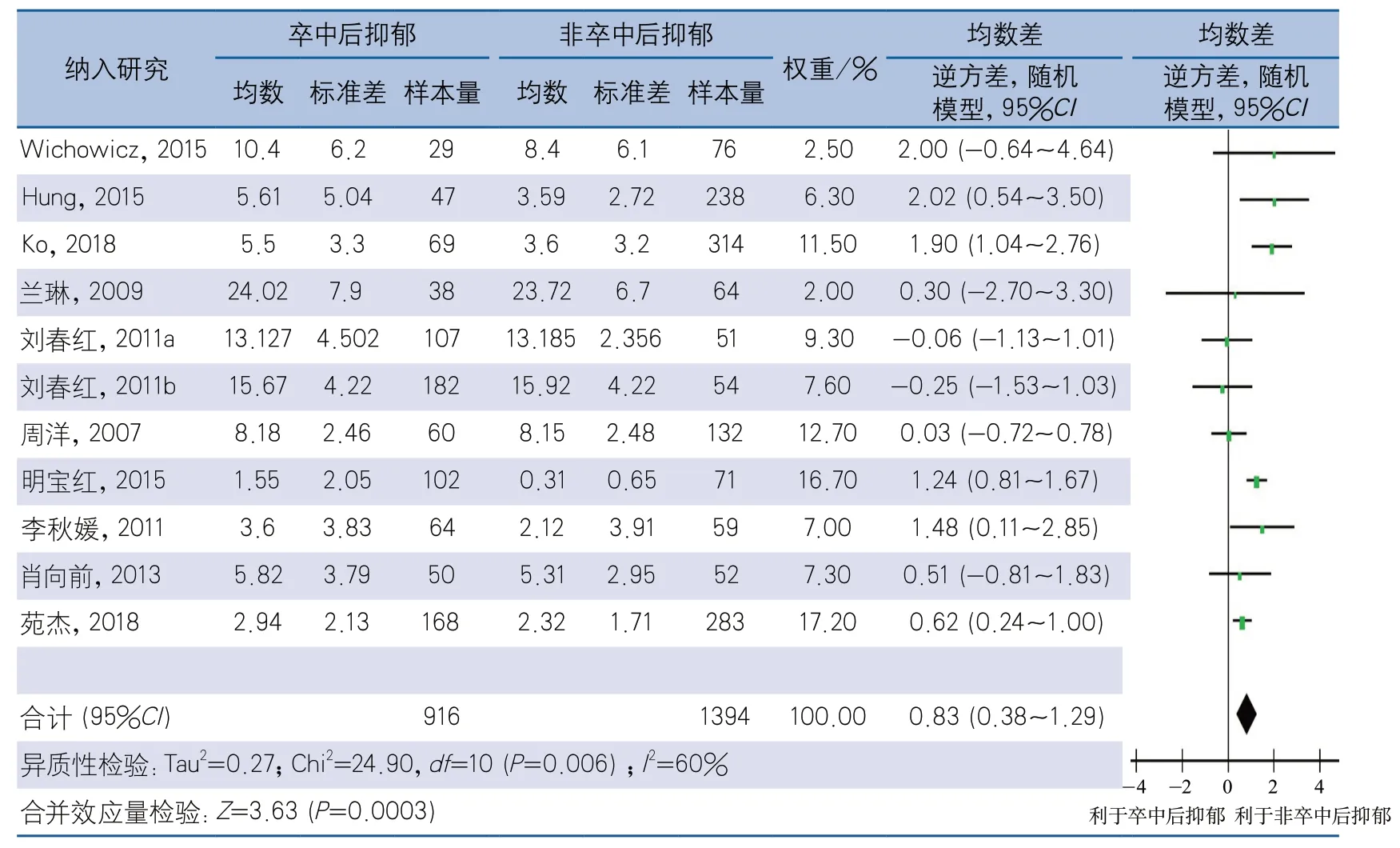
图5 卒中后抑郁与NIHSS评分的相关性缺血性卒中亚组分析森林图
2.4.4 根据PSD诊断时间分组 以卒中后1个月以内、卒中后1个月以上为PSD诊断时间节点,将16项研究分为卒中1个月内PSD及卒中1个月以上PSD。亚组分析结果显示,卒中1个月内诊断PSD的10项研究间存在异质性(I2=74%,P<0.01),采用随机效应模型计算合并效应量,结果显示,PSD组与非PSD组NIHSS评分差异无统计学意义(MD0.64,95%CI0.01~1.28,P=0.05)(图6)。卒中1个月以上发生PSD的6项研究间具有异质性(I2=58%,P=0.03),采用随机效应模型计算合并效应量,结果显示,PSD组NIHSS评分高于非PSD组,差异有统计学意义(MD1.29,95%CI0.78~1.81,P<0.01)(图7)。
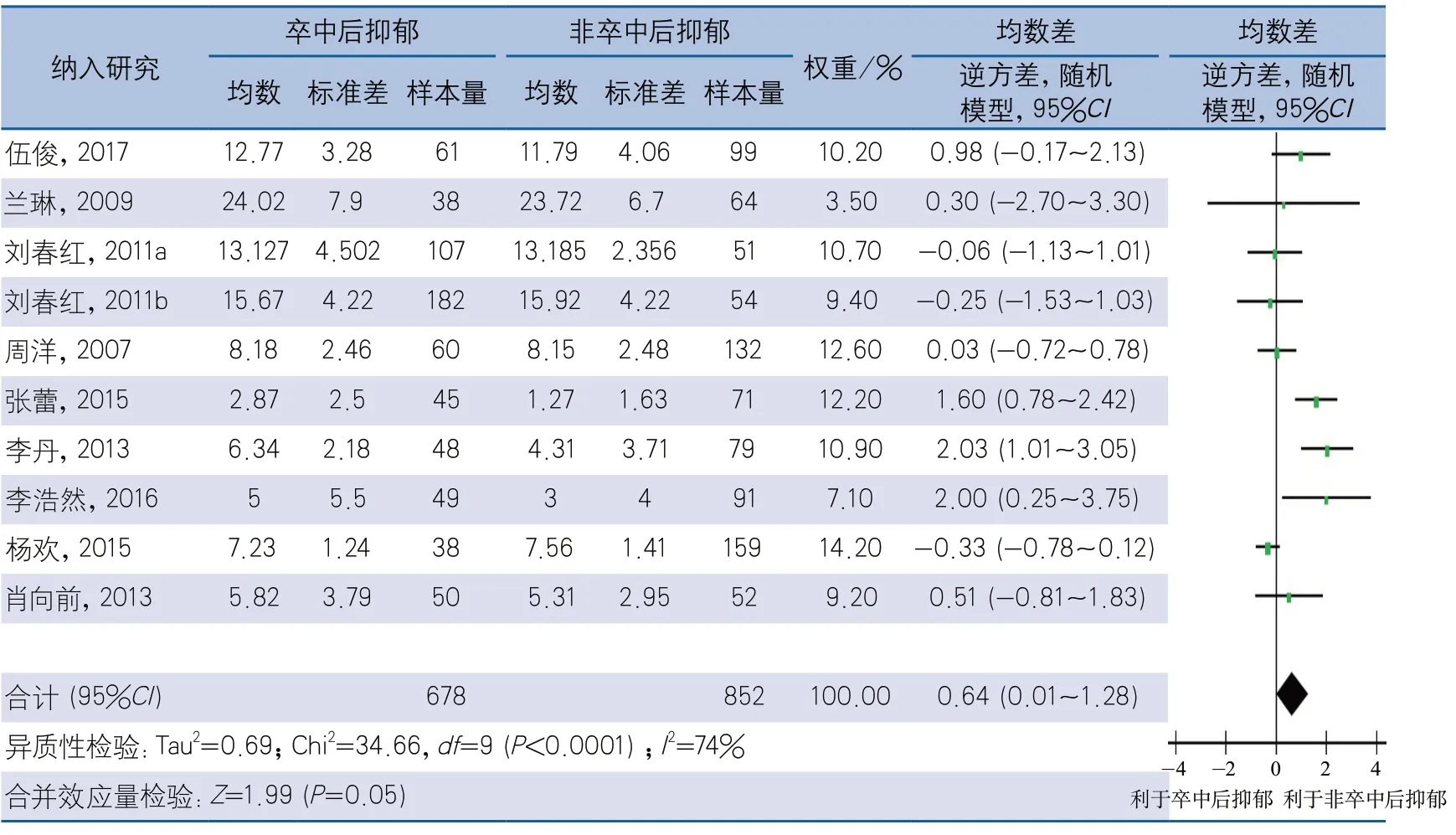
图6 卒中后抑郁与NIHSS评分的相关性卒中1个月内诊断卒中后抑郁亚组分析森林图
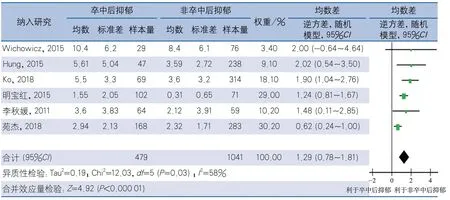
图7 卒中后抑郁与NIHSS评分的相关性卒中1个月以上诊断卒中后抑郁亚组分析森林图
2.4.5 根据NIHSS评估时间分组 有12项研究的NIHSS测评时间在卒中后2周以内;2项研究的NIHSS测评时间在卒中后3~4周;另有2项研究仅说明测评时间在急性期内,未说明具体测评时间,不予纳入亚组分析。经异质性检验,NIHSS测评时间在卒中后2周内的12项研究间存在异质性(I2=49%,P=0.03),采用随机效应模型计算合并效应量,结果显示,PSD组NIHSS评分高于非PSD组,差异有统计学意义(MD1.01,95%CI0.62~1.41,P<0.01)(图8)。NIHSS测评时间在卒中后3~4周的研究,经异质性检验,2项研究间存在异质性(I2=89%,P=0.002),采用随机效应模型进行meta分析,结果显示,PSD组与非PSD组NIHSS评分差异无统计学意义(MD1.00,95%CI-0.96~2.96,P=0.32)(图9)。
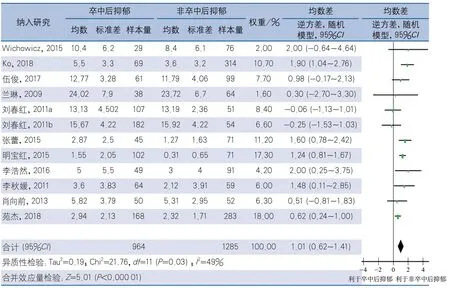
图8 卒中后抑郁与NIHSS评分的相关性卒中2周内测评NIHSS亚组分析森林图
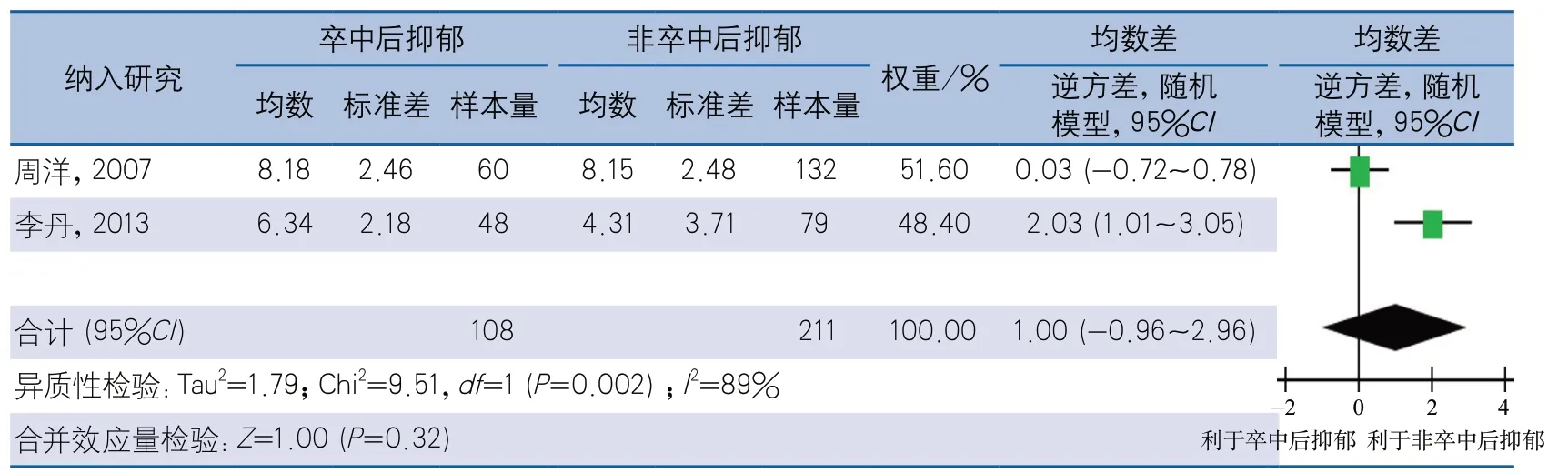
图9 卒中后抑郁与NIHSS评分的相关性卒中3~4周测评NIHSS亚组分析森林图
2.5 发表偏倚 对16项研究进行了漏斗图分析,散点分布基本呈对称性,提示纳入的研究无明显发表偏倚(图10)。
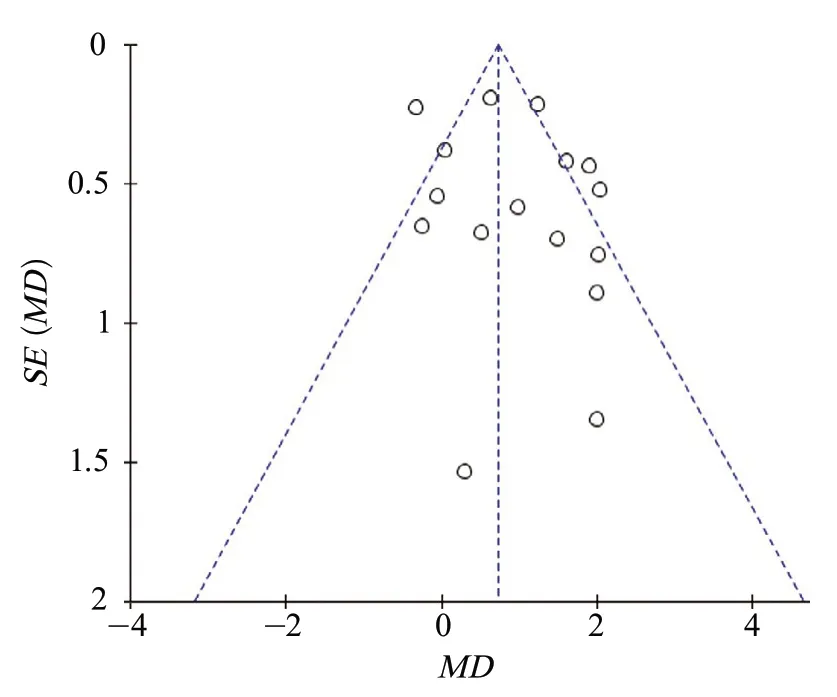
图10 卒中后抑郁与卒中急性期NIHSS评分相关性的漏斗图
2.6 敏感性分析 应用固定效应模型及随机效应模型分别计算各亚组的合并效应量,急性期亚组的固定效应模型结果显示两组差异有统计学意义(P=0.02),随机效应模型结果显示差异无统计学意义(P=0.05),提示卒中后1个月内发生PSD与NIHSS评分相关性结果欠稳定。NIHSS测评时间在卒中后3~4周亚组的固定效应模型结果显示差异有统计学意义(P=0.02),随机效应模型结果显示差异无统计学意义(P=0.32),卒中后3~4周的NIHSS评分与PSD相关性结果欠稳定。其余亚组采用两种模型评估结果基本相近,结果稳定(表2)。
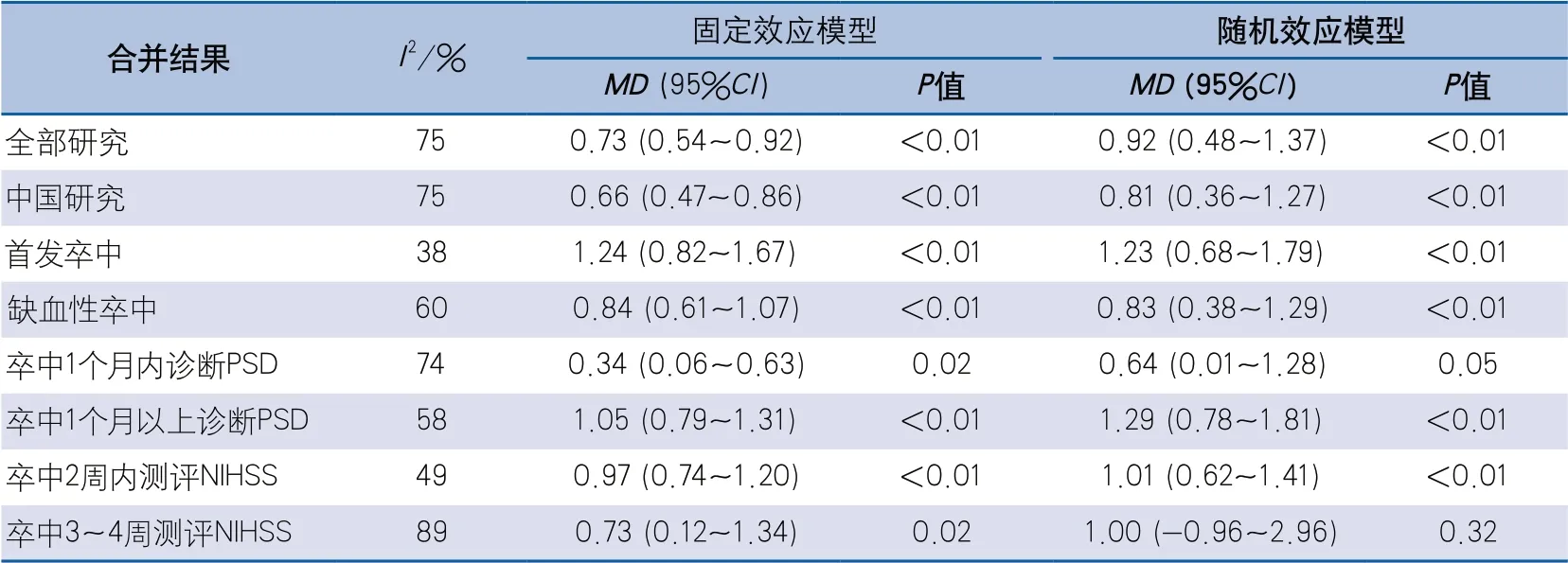
表2 卒中后抑郁与NIHSS评分相关性各亚组不同效应模型结果
3 讨论
meta分析是对具有相同研究目的的多个研究结果进行综合、定量分析的一种方法,通过扩大样本的数量,提高统计检验效能,提高研究结果的可信度,评价各研究结果的不一致或矛盾[21]。本次meta分析严格控制纳入文献的质量,以NOS对纳入研究进行质量评价,仅纳入评分≥7分的文献,并且排除样本量≤100的研究,原因在于当样本量过小时,NIHSS评分结果很难呈正态分布,为避免纳入以形式表达呈偏态分布的NIHSS评分结果的文献,研究将样本量控制在100以上。
国内外学者对PSD与NIHSS评分的相关性进行了较多的报道,多数研究在卒中恢复期或后遗症期测评NIHSS,以探讨PSD对神经功能恢复的影响,目前对于这一问题的研究结果较一致,普遍认为PSD不利于神经功能的恢复,但卒中急性期的神经功能缺损程度与PSD的发生是否相关,目前仍存在争议。本研究筛选10余年来相关文献,以卒中急性期NIHSS评分与卒中后任意时段发生PSD的相关性作为出发点,探索卒中急性期NIHSS评分是否为PSD的风险因素。meta分析结果显示,PSD与非PSD患者卒中急性期NIHSS评分有差异,提示卒中急性期神经功能缺损程度与PSD的发生具有相关性,神经功能缺损越严重,越容易出现PSD。分析其原因可能为NIHSS评分高,表明脑缺血、缺氧、水肿导致脑实质受损严重,脑组织代谢紊乱、功能失调,相关通路受损,5-羟色胺与去甲肾上腺素等神经递质失衡,从而易导致抑郁的发生[22-23]。另外,神经功能损伤严重,患者肢体运动障碍及语言障碍程度重等,生活能力下降明显,患者心理负担加重,可能更易出现PSD。
由于各研究间异质性较大,本研究从卒中的首发与再发、卒中急性期与非急性期等多个角度进行了亚组分析,仅有1项再发卒中的研究符合本次meta分析的纳入标准,其结果显示PSD组与非PSD组NIHSS评分无差异,该结果有待在以后的研究中扩大纳入文献数量进一步定量合成分析。随着卒中病程的延长,NIHSS评分变化较大,因此本次meta分析以卒中后2周以内及卒中后3~4周为NIHSS评估时间节点进行亚组分析,结果显示,卒中后2周内测评的NIHSS评分与PSD的发生相关,而卒中后3~4周测评的NIHSS评分与PSD的发生不相关,后者仅包含2项研究,异质性检验和敏感性分析显示其异质性显著、结果欠稳定,考虑其原因为纳入文献数量过少,该结果有待增加研究、加大样本量进一步分析。此外,研究结果显示卒中急性期内出现PSD与非PSD患者NIHSS评分无统计学差异,提示目前尚不能认为卒中急性期PSD与NIHSS评分具有相关性,考虑与以下原因相关:①纳入研究对象包含再发卒中;②纳入研究的PSD测评时间均在急性期内,但不能排除有研究在卒中病程不足2周时测评PSD,而卒中未达到2周时诊断为抑郁症,其病因可能与卒中前相关。
本研究仍存在一些局限性:①在某些亚组中存在较高的异质性,可能对分析结果产生影响;②本研究纳入的大部分原始文献均来自中国,因此不确定研究结论是否适用于其他人群;③本研究结果均来自回顾性研究,缺乏前瞻性研究的证据。
通过评估卒中患者急性期入院时的神经功能水平,可以预测其未来是否可能发生PSD,对于风险比较高的患者,在进行症状治疗的同时,可以进行防治其将来出现PSD的针对性的干预。PSD是神经生物因素和社会心理因素共同作用的结果,引起PSD的危险因素远不止神经功能损伤程度,未来应对PSD的其他危险因素进一步深入分析,为临床防治PSD提供循证依据。
【点睛】本研究对15篇病例对照研究进行了meta分析,明确卒中后抑郁的发生与卒中急性期NIHSS评分相关,可为卒中后抑郁的临床防治提供依据。

