小陷胸汤对高血脂小鼠血脂及免疫功能的影响
曾江琴,孙勤国,徐鸿婕,丁晓明,牟艳杰,蒋跃文
(1. 武汉市第三医院 中医科,武汉 430060;2. 湖北中医药大学 中医临床学院,武汉 430061)
高脂血症(hyperlipidemia,HLP)是指由于机体血脂水平过高导致的全身性脂质代谢紊乱性疾病,会诱发冠心病、脑栓塞、动脉粥样硬化等一系列心脑血管疾病[1-2]。随着生活水平的提高,高蛋白、高脂肪食物的摄取量日益增多,同时缺乏运动,导致体内脂质过度积累,形成HLP[3]。HLP是中老年人的常见病,近些年发现,患病人群仍在不断增加并呈逐渐年轻化发展[4]。因此,调控脂质代谢,降低血脂水平对于心脑血管疾病的防治具有重要意义[5]。他汀类药物是临床上治疗HLP的主要药物,但其治疗靶点单一,长期服用存在多种不良反应[6]。因此,探寻有效且安全的HLP治疗药物具有重要意义。
在中医学上,HLP被认为属于“痰浊”、“瘀血”等范畴[7]。小陷胸汤最早出自《伤寒论》,由黄连、瓜蒌、半夏三味药组成,具有清热化痰、宽胸散结的功效[8]。本研究以高脂饲料喂养小鼠建立HLP模型,探究小陷胸汤对模型小鼠血脂以及免疫功能的影响,旨在为HLP的防治提供新的方向和理论参考。
1 材料
1.1 实验动物36只5周龄SPF级雄性C57BL/6小鼠,体质量20~22 g,购自三峡大学实验动物中心。小鼠饲养于22~26 ℃,相对湿度50%~60%环境中,昼夜交替照明12 h/12 h。
1.2 实验药物小陷胸汤(黄连3 g、瓜蒌30 g、半夏12 g),由武汉市第三医院中药房提供,用传统方法浸泡、煎煮、过滤、浓缩,制成煎剂,调制至每毫升含生药0.12、0.06及0.03 g(根据人与小鼠体表面积换算得出的剂量),低温冷藏备用。
1.3 实验试剂洛伐他汀,购自上海阿拉丁生化科技股份有限公司;高脂饲料,购自北京华阜康生物科技股份有限公司;总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)及高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)检测试剂盒,购自深圳迈瑞生物医疗电子股份有限公司;小鼠血清CRP ELISA检测试剂盒,购自武汉贝茵莱生物科技有限公司;PBS、钙离子载体离子霉素、布雷非德菌素A(brefeldin A,BFA),购自北京索莱宝科技有限公司;佛波酯(phorbol myristate acetate,PMA)购自Sigma-Aldrich公司;小鼠抗CD40-FITC、抗CD40L-PE、抗IL-4-PE、抗IFN-γ-PE、抗CD4-FITC抗体,购自eBioscience公司;破膜剂,购自BD公司。
1.4 实验仪器全自动生化分析仪,购自深圳迈瑞生物医疗电子股份有限公司;酶标仪,购自Labsystems公司;CO2常温培养箱,购自赛默飞世尔科技有限公司;FACS,购自艾森生物(杭州)有限公司 。
2 方法
2.1 HLP小鼠模型的构建适应性饲养7 d后,对照组小鼠饲喂基础饲料,模型组饲喂高脂饲料。饲喂8周后,夜间饥饿处理对照组和模型组小鼠,尾静脉取血,检测血清中TC和TG水平,模型组与对照组相比差异有统计学意义即为HLP模型构建成功。
2.2 分组和给药将小鼠随机分为6组:阴性对照组、模型组、低剂量组、中剂量组、高剂量组和阳性对照组,每组6只。除阴性对照组外,其余各组小鼠均进行HLP模型的构建。建模成功后,低、中、高剂量组小鼠分别灌胃0.03、0.06和0.12 g/mL小陷胸汤,阳性对照组小鼠灌胃2.5 mg/kg洛伐他汀,阴性对照组和模型组小鼠灌胃等量生理盐水。给药频率为1次/d,连续8周。末次给药结束后,称取各小鼠体质量。1%戊巴比妥钠麻醉小鼠,处死后采集小鼠主动脉血液分离血清并收集小鼠脾脏、肝脏及主动脉血管组织,计算肝脏、脾脏指数。
肝脏指数=(肝质量/体质量)×100%;脾脏指数=(脾质量/体质量)×100%
2.3 小鼠血清TC、TG、LDL-C和HDL-C水平的检测采用全自动生化分析仪测定小鼠血清中TC、TG、LDL-C和HDL-C水平,操作严格按照生化试剂盒说明书进行。
2.4 FACS检测血管组织CD40+/CD40L+细胞百分比取各组主动脉血管组织样本,用含5%双抗的PBS漂洗后剪碎组织块,经0.25%胰酶及0.1% Ⅱ型胶原酶(体积比1∶1)37 ℃消化20 min。收集单细胞悬液,175×g离心10 min,弃上清液,PBS漂洗后备用。用100 μL 流式缓冲液重悬细胞,取1×106个细胞于1.5 mL离心管中,每管加入2 μL 抗CD40-FITC和抗CD40L-PE抗体,4 ℃避光孵育30 min;400×g离心5 min,弃上清液;400 μL PBS重悬细胞,使用FACS检测。
2.5 FACS检测脾脏组织Th1、Th2百分比取各组小鼠脾脏组织样本,剪碎,37 ℃消化30 min,收集细胞悬液。经200目不锈钢网过滤,175×g离心10 min,弃上清液,PBS漂洗1次。取1×106个细胞于1.5 mL离心管中,每管加入2 μL PMA(50 ng/mL)、离子霉素(2 μg/mL)和BFA(3 μg/mL)的混合物,培养6 h。PBS漂洗1次,4 ℃、400×g离心5 min,弃上清液;100 μL流式缓冲液重悬细胞,加入2 μL抗CD4-FITC抗体,4 ℃避光孵育30 min;加入1 mL固定剂,避光孵育20 min,4 ℃、400×g离心5 min,弃上清液;加入1 mL破膜剂,避光孵育40 min,4 ℃、400×g离心5 min,弃上清液;PBS重悬细胞,加入2 μL抗IFN-γ-PE、抗IL-4-PE抗体,4 ℃避光孵育45 min;400 μL PBS重悬细胞,使用FACS检测。
2.6 ELISA检测小鼠外周血CRP水平按照ELISA检测试剂盒说明书进行操作,稀释标准品,绘制标准曲线。将各组小鼠血清加入待测样本孔中,依次加入抗CRP-Biotin抗体、酶标试剂、显色剂和终止液,于酶标仪检测各孔光密度D(450 nm)值,通过标准曲线方程计算各组小鼠血清CRP水平。
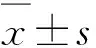
3 结果
3.1 小陷胸汤对HLP小鼠脏器指数的影响与对照组比较,模型组小鼠肝脏指数和脾脏指数显著升高(均P<0.05);与模型组比较,低、中、高剂量组和阳性对照组小鼠肝脏指数显著降低(均P<0.05),高剂量组和阳性对照组小鼠脾脏指数显著下降(P<0.05, 表1)。
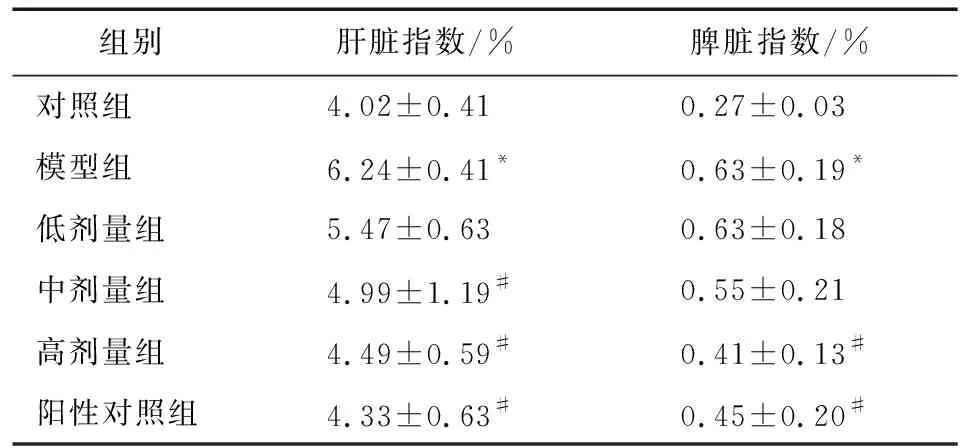
表1 各组小鼠脏器指数的变化
3.2 小陷胸汤对HLP小鼠血清TC、TG、LDL-C和HDL-C水平的影响与对照组比较,模型组小鼠血清中TC、TG和LDL-C水平显著升高(均P<0.05),HDL-C水平显著降低(P<0.05);与模型组比较,中、高剂量组和阳性对照组小鼠血清TC、TG、LDL-C水平显著降低(均P<0.05),HDL-C水平显著升高(均P<0.05, 表2)。
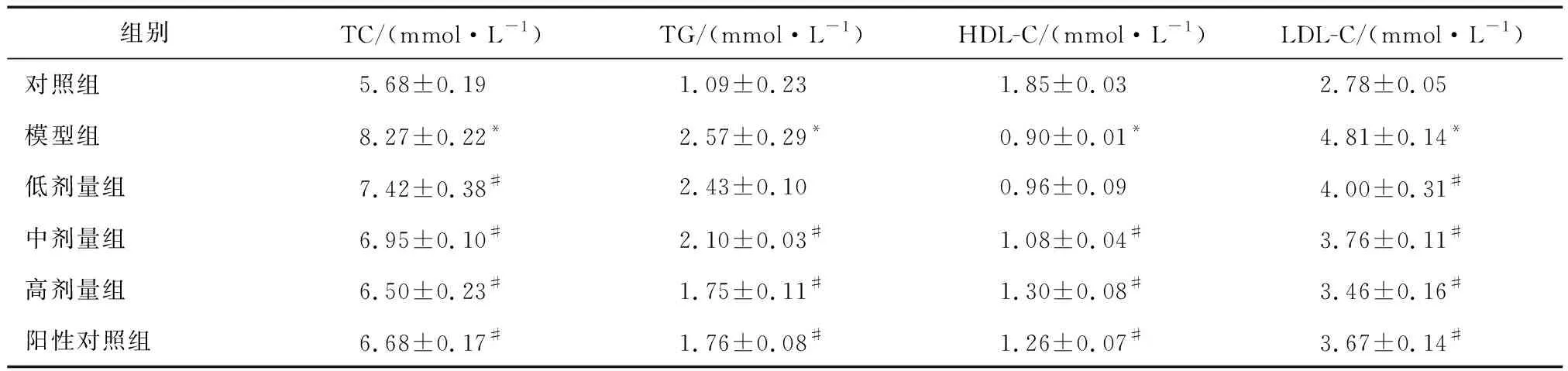
表2 各组小鼠血清TC、TG、LDL-C和HDL-C水平的变化
3.3 小陷胸汤对HLP小鼠血清CRP水平的影响与对照组比较,模型组小鼠血清CRP水平显著升高(P<0.05);与模型组比较,低、中、高剂量组和阳性对照组小鼠血清CRP水平显著降低(均P<0.05, 图1)。

注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。图1 各组小鼠血清CRP水平的变化
3.4 小陷胸汤对HLP小鼠血管组织中CD40+/CD40L+细胞百分比的影响与对照组比较,模型组小鼠血管组织中CD40+/CD40L+细胞百分比显著上调(P<0.05);与模型组比较,低、中、高剂量组和阳性对照组小鼠血管组织中CD40+/CD40L+细胞百分比显著下调(均P<0.05, 图2)。

注:A. FACS检测各组小鼠血管组织中CD40+/CD40L+细胞百分比;B. 各组小鼠血管组织中CD40+/CD40L+细胞百分比统计结果。与对照组比较,*P<0.05;与模型组比较,#P<0.05。图2 各组小鼠血管组织中CD40+/CD40L+细胞百分比的变化
3.5 小陷胸汤对HLP小鼠脾脏Th1、Th2百分比的影响与对照组比较,模型组小鼠脾脏细胞中Th1百分比显著增加(P<0.05),Th2百分比显著减少(P<0.05);与模型组比较,低剂量组小鼠脾脏细胞中Th1和Th2百分比差异无统计学意义(均P>0.05);中、高剂量组和阳性对照组小鼠脾脏细胞中Th1百分比显著减少(均P<0.05),Th2百分比显著增加(均P<0.05, 图3)。
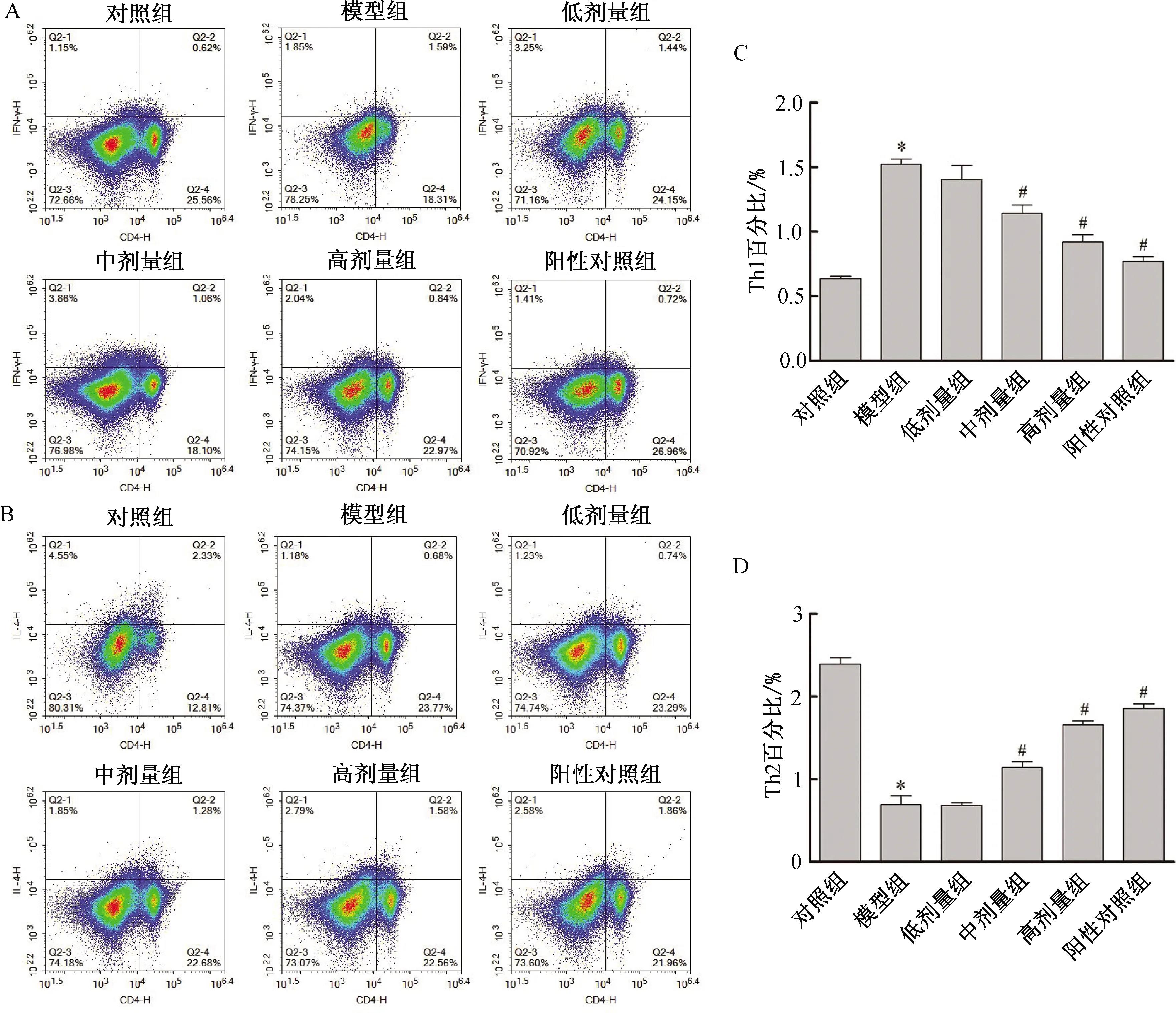
注:A~B. FACS检测各组小鼠脾脏细胞中Th1和Th2百分比;C~D. 各组小鼠脾脏中Th1和Th2百分比的统计结果。与对照组比较,*P<0.05;与模型组比较,#P<0.05。图3 各组小鼠脾脏细胞中Th1和Th2百分比的比较
4 讨论
血脂异常表现为外周血TC、TG、LDL-C等一种或多种指标水平升高,或者HDL-C水平降低[9-10]。LDL-C参与肝脏中TC向肝外转运的过程,其水平过高会导致TC、TG沉积,堵塞血管[11]。而HDL-C参与将外周组织中的TC转运至肝脏的分解代谢,能够减少TC在外周组织血管的沉积,有利于心血管系统健康[12]。CRP是一种典型的急性相血浆蛋白,常作为衡量临床炎症反应的非特异性标志物[13]。研究表明,CRP与高血糖、高血脂及多种心血管疾病的发生发展密切相关[14]。本研究采用高脂饲料饲喂小鼠以构建HLP模型,结果显示,模型组小鼠血清TC、TG和LDL-C水平显著升高(均P<0.05),HDL-C水平显著下降(P<0.05),符合HLP动物模型评价指标[15],说明本研究成功构建了HLP小鼠模型。经不同剂量小陷胸汤给药治疗后,HLP小鼠CRP、TC、TG、LDL-C和HDL-C水平得到不同程度改善,其中高剂量组的逆转效果最为明显。这提示小陷胸汤能抑制CRP水平,上调HDL-C,加速肝外TC和TG向肝内转运的代谢,即小陷胸汤具有降低HLP小鼠血脂的功效。
免疫损伤、炎症反应在HLP及其相关疾病的发病机制中发挥重要作用[16],因此,调节免疫功能是HLP相关疾病的主要治疗策略之一。免疫器官的质量和相关指标是评价机体免疫系统状态的重要指标。脾脏为体积最大的外周免疫器官,可对血源性抗原产生免疫反应[17]。研究显示,HLP小鼠脾脏指数降低,机体免疫功能下降[18-19]。肝脏在脂质代谢中发挥关键作用,研究发现,改善肝脏脂质代谢和减轻炎症反应可对高脂饮食诱导的HLP发挥较好的治疗效果[20]。CD40/CD40L通路在免疫应答的启动中发挥重要作用[21],抑制CD40/CD40L复合物水平可显著减轻炎症反应程度[22]。Th1/Th2平衡在免疫调节过程中具有关键性作用,根据相关研究结果显示,调节脾脏Th1/Th2平衡向Th2偏移可发挥炎症反应抑制作用,从而实现免疫调节[23]。
本研究中,造模后小鼠肝脏指数和脾脏指数均显著升高,CD40+/CD40L+细胞百分比显著增加,Th1百分比显著上升,Th2百分比显著下降,而中剂量和高剂量小陷胸汤治疗HLP小鼠后,脏器指数显著下降,CD40+/CD40L+细胞百分比显著减少,Th1百分比显著下降,Th2百分比显著上升,提示小陷胸汤能够改善HLP小鼠脏器,调节机体免疫反应。
综上所述,小陷胸汤可降低HLP小鼠TC、TG和LDL-C水平,提高HDL-C水平,改善小鼠免疫功能。但是,目前其作用靶点尚不明确,还需进一步利用网络药理手段分析其主要活性成分及可能靶点并进行验证,从而为小陷胸汤的应用推广提供更多实验依据。

