阿帕替尼联合替吉奥治疗进展期胃癌有效性和安全性的系统评价
王凯,张学琴,刘秀菊,王好雨,杨珍珍,王淑梅*(.河北医科大学第二医院药学部,石家庄050000;2.河北医科大学,石家庄 050000)
胃癌是消化系统最常见的恶性肿瘤之一,2018年全球胃癌新发病例数为103.4 万,占全部恶性肿瘤发病的5.7%,位于恶性肿瘤发病第六位,中国是全球胃癌的高发区,发病数占世界的44.1%[1]。有研究显示我国胃癌发病率呈下降趋势,且平均发病年龄出现后移趋势[2]。我国早期胃癌占比很低,仅约20%,大多数发现时已是进展期,总体5年生存率不足50%,针对晚期胃癌患者的临床治疗大多数是以放化疗方法为主。替吉奥广泛应用于各种癌症的治疗,包括晚期胃癌,且替吉奥单药或替吉奥联合化疗药在疾病控制率和临床缓解率方面显示出优越性[3]。阿帕替尼是一种新型的小分子抗血管生成剂,高度选择性地抑制血管内皮生长因子受体-2(VEGFR-2)酪氨酸激酶的活性,阻断VEGF 与其受体结合的信号传导,从而强效抑制肿瘤血管生成,发挥抗肿瘤作用[4]。阿帕替尼为我国Ⅰ类新药,于2014年上市并于2017年进入基本医疗保险目录,主要用于进展期胃癌或胃食管结合部腺癌的二线以上治疗[5]。为探究阿帕替尼联合替吉奥是否比单用替吉奥有更好的疗效和安全性,本研究采用系统评价的方法比较阿帕替尼联合替吉奥对比单用替吉奥针对晚期胃癌的疗效和安全性,以期为晚期胃癌的临床用药提供参考。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型 国内外公开发表的随机对照试验(randomized controlled trial,RCT);语种限定为中文或英文。
1.1.2 研究对象 ① 符合《胃癌诊疗规范(2011年版)》中关于晚期胃癌的诊断标准,并经病理组织学检查和影像学检查证实为晚期胃癌[6];②年龄18~80 岁,性别不限;③ 具有可以测量的肿瘤病灶;④ 预期生存时间≥3 个月;⑤ 所有患者均无化疗药物使用禁忌证;⑥ 所有患者均签署知情同意书,研究经过医院伦理委员会批准。
1.1.3 干预措施 对照组为替吉奥胶囊,剂量40~60 mg,每日2 次;试验组在对照组的基础上加用阿帕替尼,阿帕替尼的剂量为250~850 mg,每日1 次。
1.1.4 结局指标 疗效相关指标:A.总体缓解率(objective response rate,ORR)和B.疾病控制率(disease control rate,DCR)。安全性相关指标:C.手足综合征、D.高血压、E.蛋白尿、F.恶心呕吐、G.腹泻、H.乏力以及I.血小板减少。依据美国癌症研究所制定的肿瘤疗效评价标准进行评价,分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)、 疾病进展(progressive disease,PD)。ORR =(CR +PR)/样本总量,DCR =(CR +PR +SD)/样本总量。采用实体瘤近期疗效评定标准(REcIsT)进行评价:CR(病灶完全消失,持续4 周),PR(肿瘤最大径之和较之前最少降低30%,持续4 周),SD(肿瘤最大径之和较之前降低<30%,或升高20%),PD(肿瘤最大径之和较之前升高>20%或有新的病灶发现)。
1.1.5 排除标准 ① 排除试验设计有明显错误、缺陷或经相关查询提供资料不详的文献;② 排除未进行组间均衡性比较,基线资料不可比的文献;③ 排除总样本量低于20 的研究;④ 文中无明确排除标准或排除标准不全面的文献。
1.2 文献检索策略
计算机系统检索Cochrane Library、PubMed/Medline、Embase、中国知网(CNKI)、万方数据库、维普数据库,检索时间均为建库至2020年6月28日。英文检索关键词为“Apatinib”“Apatinib mesylate”“S-1”“Tegafur”“Gimeracil”“Oteracil Potassium Capsules”“Stomach Neoplasm”“Gastric Neoplasms”“Cancer of Stomach”“Stomach Cancers”“Gastric Cancer”;中文检索关键词为“阿帕替尼”“替吉奥”“甲磺酸阿帕替尼”“艾恒”“胃癌”和“胃肿瘤”。
1.3 文献资料的提取和质量评价
由两名研究人员相互独立地按照纳排标准,阅读导出的文献的篇名、摘要进行文献初筛,排除不符合标准的文献,并记录排除原因;通过阅读全文对初筛符合纳排标准的文献进行复筛,排除不符合标准的文献,并记录排除原因;最后对筛选出的文献进行交叉核对,意见不一致时通过讨论或征求第三位研究人员的意见协商解决。对符合纳排标准的文献,使用提前设计好的资料提取表提取文献中的关键信息,包括作者、发表时间、研究对象、干预措施、结局指标等内容。质量评价的标准根据Cochrane 系统评价员手册5.1.0 提供的评价标准[7],共包括5 个方面:随机序列生成、随机分配方案是否隐藏、患者及干预措施者盲法、不完整性结局报告、选择性报告[5]。质量评价“low risk”表示低偏倚;“unclear”表示偏倚不清楚;“high risk”表示高偏倚。采用Egger检验评估发表偏倚以评价结果的可靠性。
1.4 统计学分析
采用RevMan 5.3 软件对纳入研究效应量进行合并分析。使用点估计与区间估计为效应量指标,对于二分类变量采用比值比OR值(odds ratio)及95%CI(confidence interval)表示其效应量大小,以α=0.05 为检验水平。采用I2检验对纳入的研究进行异质性评价,各研究间无异质性(P>0.10,I2≤50%),采用固定效应模型分析;反之,采用随机效应模型分析。采用单因素和亚组分析进行敏感性分析以验证结果的稳健性。
2 结果
2.1 文献检索结果及纳入研究基本信息
检索各个数据库,共检索到342 篇文献,剔除个案报告、重复文献、综述、回顾性研究、非随机研究或不符合纳入标准的研究,最终纳入15项研究,合计1121 例患者,阿帕替尼联合替吉奥组561 例,替吉奥组560 例,文献筛选流程见图1,纳入研究基本信息见表1。

表1 纳入研究基本信息Tab 1 General information of included studies

图1 文献筛选流程Fig 1 Flow chart of literature screening
2.2 纳入文献质量评价结果
纳入的15 篇文献,均报告采用随机数字表法进行分组,研究中试验组与对照组基线可比。所有研究均未提及分配隐藏和盲法使用情况,试验期间均未报告脱落情况,没有选择性报告。根据文献的风险偏倚评价结果,文献的总体质量偏低,详见图2。
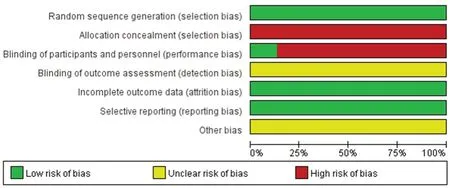
图2 偏倚风险图Fig 2 Graph of bias risk
2.3 Meta 分析结果
2.3.1 ORR 15 项研究[8-22]全部报道了ORR。各研究间无统计学异质性(P=0.97,I2=0),采用固定效应模型进行meta 分析,详见图3。Meta 分析结果显示,试验组的ORR 显著高于对照组,差异有统计学意义[OR=0.33,95%CI(0.25,0.44),P<0.000 01]。

图3 两组患者ORR 的meta 分析结果Fig 3 Meta analysis of ORR in the two groups of patients
2.3.2 DCR 15 项研究[8-22]全部报道了DCR。各研究间无统计学异质性(P=0.67,I2=0),采用固定效应模型进行meta 分析,详见图4。Meta 分析结果显示,试验组的DCR 显著高于对照组,差异有统计学意义[OR=0.37,95%CI(0.28,0.50),P<0.000 01]。
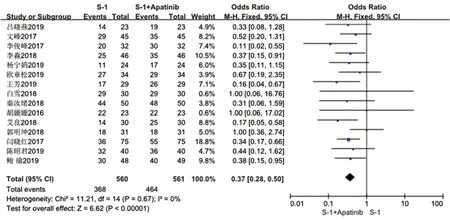
图4 两组患者DCR 的meta 分析森林图Fig 4 Meta analysis of DCR in the two groups of patients
2.3.3 手足综合征 6 项研究[8-9,13-14,17,21](n=445)报道了患者治疗后手足综合征的发生情况,各研究间无统计学异质性(P=0.23,I2=27%),采用固定效应模型进行meta 分析。Meta分析结果显示,试验组的手足综合征发生率显著高于对照组,差异有统计学意义[OR=2.11,95%CI(1.09,4.08),P=0.03],见表2。
2.3.4 高血压 6 项研究[9-10,15,17,19,21](n=474)报道了患者治疗后高血压的发生情况,各研究间无统计学异质性(P=0.23,I2=28%),采用固定效应模型进行meta 分析。Meta 分析结果显示,试验组的高血压发生率显著高于对照组,差异有统计学意义[OR=0.13,95%CI(0.06,0.28),P<0.01],见表2。
2.3.5 蛋白尿 7 项研究[9-11,15,17,19,21](n=554)报道了患者治疗后蛋白尿的发生情况,各研究间无统计学异质性(P=0.08,I2=46%),采用固定效应模型进行meta 分析。Meta 分析结果显示,试验组的蛋白尿发生率显著高于对照组,差异有统计学意义[OR=0.26,95%CI(0.13,0.51),P<0.01],见表2。
2.3.6 恶心呕吐 14 项研究[8-15,17-19,21-22](n=999)报道了患者治疗后恶心呕吐的发生情况,各研究间无统计学异质性(P=0.04,I2=45%),采用固定效应模型进行meta 分析。Meta 分析结果显示,试验组的恶心呕吐发生率与对照组相比,差异无统计学意义[OR=1.03,95%CI(0.76,1.40),P=0.86],见表2。
2.3.7 腹泻 12 项研究[8-15,16-19,21](n=774)报道了患者治疗后腹泻的发生情况,各研究间无统计学异质性(P=0.64,I2=0%),采用固定效应模型进行meta 分析。Meta 分析结果显示,试验组的腹泻发生率与对照组相比,差异无统计学意义[OR=0.90,95%CI(0.60,1.35),P=0.60],见表2。
2.3.8 乏力 4 项研究[9,11,22,19](n=218)报道了患者治疗后乏力的发生情况,各研究间无统计学异质性(P=0.16,I2=41%),采用固定效应模型进行meta 分析。Meta 分析结果显示,试验组的乏力发生率与对照组相比,差异无统计学意义[OR=0.67,95%CI(0.36,1.30),P=0.24],见表2。
2.3.9 血小板降低 6 项研究[9,12,14,16-18](n=464)报道了患者治疗后血小板减少的发生情况,各研究间无统计学异质性(P=0.80,I2=0%),采用固定效应模型进行meta 分析。Meta 分析结果显示,试验组的血小板减少发生率与对照组相比,差异无统计学意义[OR=1.24,95%CI(0.73,2.11),P=0.42],见表2。
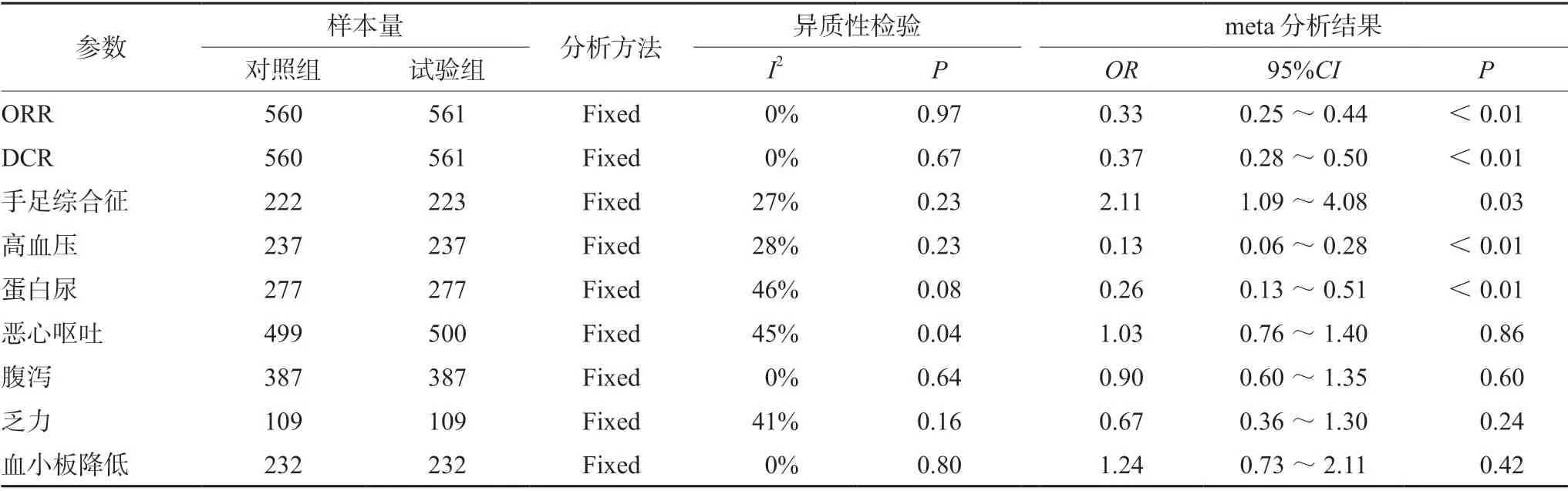
表2 试验组与对照组有效性和安全性的meta 分析结果Tab 2 Meta analysis of effectiveness and safety between the test group and the control group
2.4 敏感性分析
纳入的15 篇文献中,1 篇文献阿帕替尼的用量为250 mg[14];5 篇文献的用量为500 mg[8,10,11,13,19];2 篇文献的用量为500~850 mg[9,18];7 篇文献的用量为850 mg[12,14-17,20,22]。疗程:10 篇文献为8 周[8-11,13,15,18,20,22];1 篇文献为9 周[16];4 篇文献为12 周[14,17,19,21];1篇文献为18 周[21],分别对阿帕替尼的剂量和治疗周期做了亚组分析,亚组分析显示(见表3、4),研究结果的方向未发生改变,进一步验证了结果的稳健性。
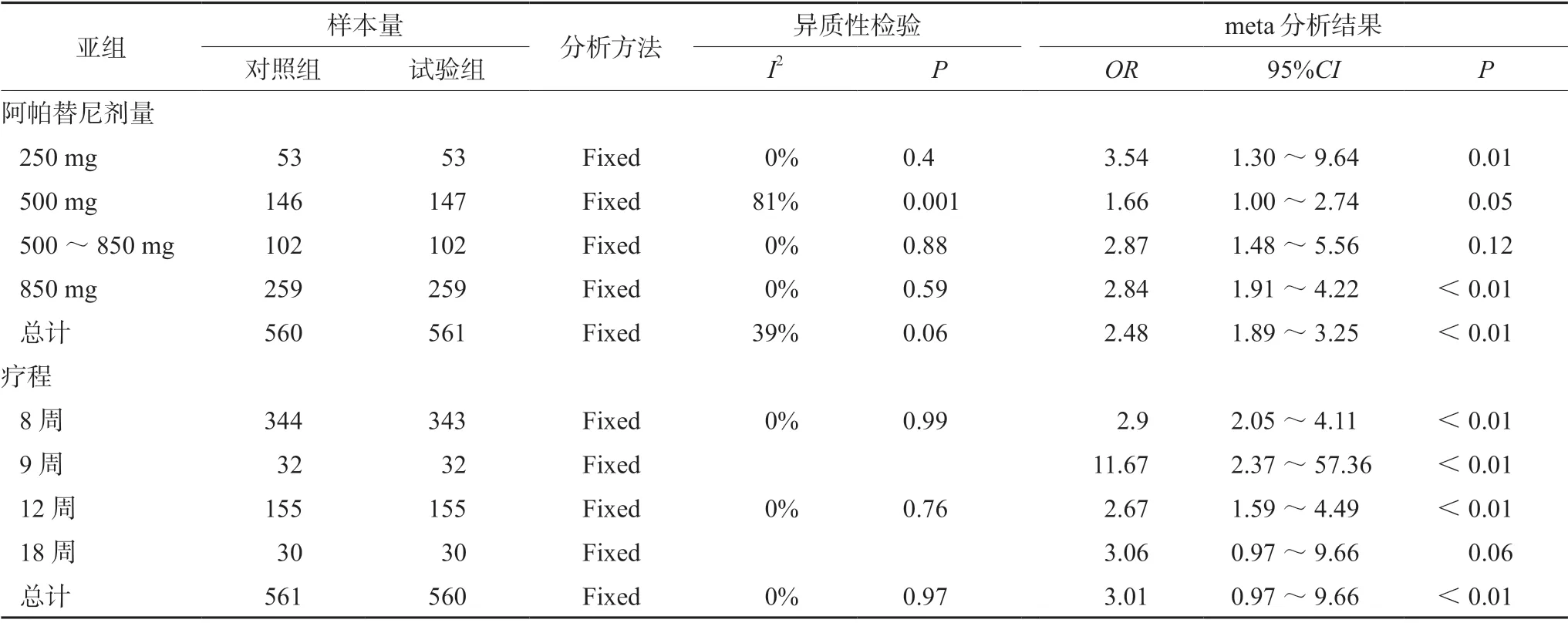
表3 ORR 阿帕替尼剂量与疗程的亚组meta 分析结果Tab 3 Subgroup meta analysis of ORR apatinib doses and courses of treatment
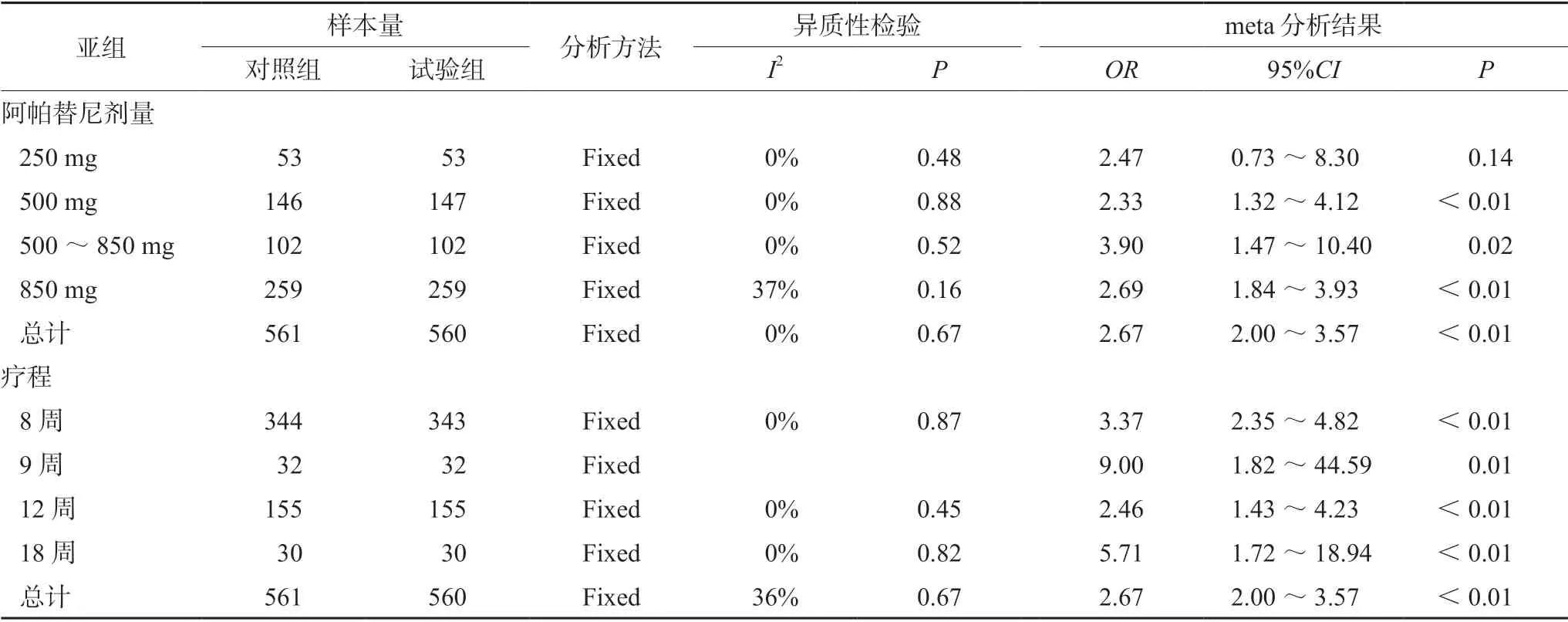
表4 DCR 阿帕替尼剂量与疗程的亚组meta 分析结果Tab 4 Subgroup meta analysis of DCR apatinib doses and courses of treatment
2.5 发表偏倚分析
由图5可知,ORR、DCR 和恶心呕吐等结果指标各研究散点都在倒漏斗图范围内,倒漏斗图分布的对称性良好,Egger 检验(ORR)P=0.18,(DCR)P=0.24,(恶心呕吐)P=0.26,无明显发表偏倚;以腹泻为结果指标的研究绘制各研究在到漏斗图分布不均匀,对称性较差,Egger 检验P=0.014,提示该结果指标可能存在发表偏倚。
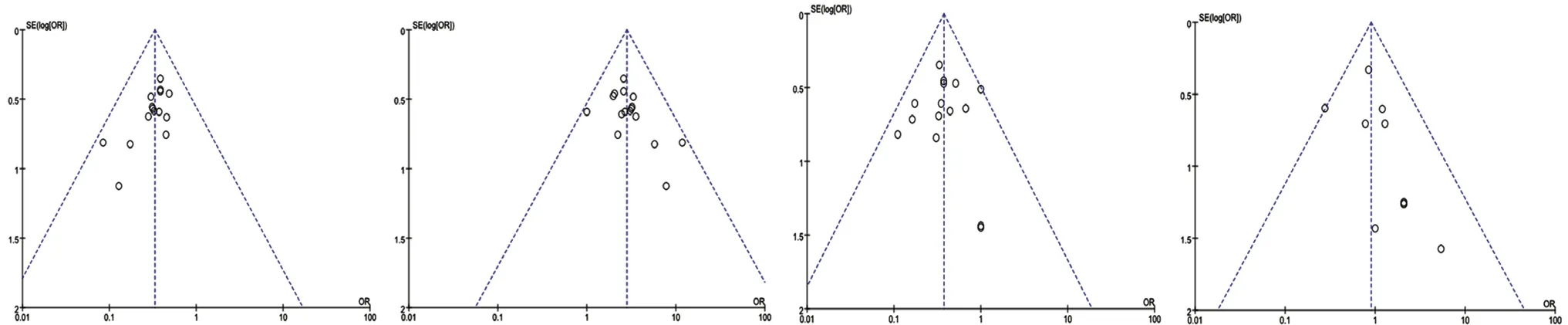
图5 Meta 分析发表偏倚漏斗图Fig 5 Meta analysis publication bias funnel diagram
3 讨论
尽管对胃癌进行了许多研究且取得了相应进展,但是总体上胃癌的治疗效果仍未取得实质性突破[23]。随着目前靶向治疗的兴起,联合靶向治疗药物不仅能够获得更好的近期治疗效果,且远期疗效也较好。作为一种新型靶向治疗药物,阿帕替尼能有效抑制小分子VEGF 的形成,抑制肿瘤的生长,具有靶向性、安全性较高、耐受性良好等特点,在治疗晚期胃癌的临床应用中有较好的效果[24]。同时阿帕替尼作为一种新药,仍缺乏其功效和不良反应的高质量证据,通常将其作为一线和二线化疗失败的三线药物用于胃癌患者,但是,根据临床经验,许多医师和学者还发现它具有作为二线或一线治疗药物的潜力[25-26]。
本研究结果显示,阿帕替尼联合替吉奥用于晚期胃癌的治疗,疗效较单用替吉奥组显著提高,ORR 和DCR 差异有统计学意义。安全性方面,联合治疗组手足综合征、高血压、蛋白尿的发生率较单用替吉奥高,恶心呕吐、腹泻、乏力和血小板降低发生率的差异无统计学意义。发生不良反应时,可对症治疗,调整剂量或停药。阿帕替尼常见高血压、蛋白尿、手足综合征等不良反应,可参考中国临床肿瘤学会抗肿瘤药物安全管理专家委员会的防治策略进行处理[27]。
在敏感性分析中,分别对主要结局指标ORR和DCR 结果的稳健性进行了验证,在亚组分析中分别探讨了阿帕替尼不同剂量和不同疗程对结果的影响,其中在阿帕替尼小剂量250 mg 时,结果方向发生改变,其他剂量及疗程均未对结果产生影响,进一步说明meta 分析结果较为稳健,同时提示在临床使用过程中,警惕小剂量阿帕替尼对晚期胃癌的治疗。
本研究严格按照Cochrane 评价体系对文献进行整合分析,但仍存在以下不足:纳入的部分文献在分配隐藏和病例退出/失访等方面未予描述,可能存在实施偏倚;漏斗图提示本研究结果可能存在发表偏倚;本研究未能比较两药生存获益方面的差异纳入的研究;部分文献纳入的样本量较少,可靠性较低。因此,本研究所得结论仍需高质量、大样本的双盲随机对照试验加以验证。
综上所述,与单用替吉奥相比,阿帕替尼联合替吉奥能显著提高晚期胃癌患者的ORR 和DCR,但要警惕手足综合征、高血压和蛋白尿等不良反应的发生,其他不良反应相当。因此,阿帕替尼联合替吉奥在治疗晚期胃癌方面有较好的疗效和安全性。

