凋落物添加和模拟氮磷沉降对红松凋落物木质素降解和碳释放的影响
郭绮雯,段文标,刘玉萍,陈立新,李常准,于颖颖,李少然,李亦菲
东北林业大学林学院, 哈尔滨 150040
碳(C)是构成植物体的核心元素,在生态系统物质循环和能量流动中占有重要地位。凋落物分解释放的碳是森林生态系统的重要碳源之一,也是土壤转化的物质基础。同时,关于全球碳库的研究表明,凋落物分解所释放的碳占每年全球碳流通的70%左右,分解所释放的CO2可高达68Gt[1]。C含量、N含量、木质素含量以及它们之间的比值是衡量凋落物的质量,判断凋落物是否易分解的主要指标[2]。
长期以来,木质素一直被认为是植物材料中的一种顽固性成分,其降解是凋落物分解和土壤有机质形成的关键[3- 5],但最近的几项研究结果与传统观念正相反。木质素可能在凋落物早期分解期间分解得最快,作为与不稳定的C底物共降解的结果——碳水化合物的供应推动着木质素分解[6]。然而鲜有研究关注红松凋落物分解过程中,木质素的降解对C释放的影响。
近年来,大量的矿物燃料燃烧和氮肥的施用使得大气氮沉降呈现增加的趋势[7],直接或间接地影响了森林凋落物的分解率和养分组成。氮、磷沉降是否会促进凋落物的产量及分解迄今还存在着争议,因为大量研究都是基于模型和样地的定量估计得出的结论,然而在更为广泛的空间水平上的讨论还有所欠缺。基于对森林空间水平上大量的研究发现,氮沉降促进了大多数植物及所有与丛枝菌根真菌相关的树种的生长,具有净负生长响应的树种多为常绿针叶林树种[8]。Simkin等[9]的研究证实了氮沉降对物种丰富度是有促进作用的,但仅仅是在低氮沉降下,并且酸性土壤对于氮沉降的反应更为强烈。关于磷沉降对凋落物分解的影响的研究甚少,但有关氮磷沉降的研究表明,氮磷沉降均促进凋落物分解过程[10],其释放规律表现为前期积累,后期释放[11]。
虽然有研究认为,对于全球尺度及地区尺度上的凋落物分解,气候和环境因素的影响更大,但其对于地带性森林类型,凋落物质量才是主要原因[12]。之前的研究表明,在不同的管理制度下,玉米和草的凋落物元素释放在分解过程中存在差异,他们将差异归因于初始凋落物质量(C/N,木质素/N等)和相关分解者群落的差异程度[13- 14]。添加凋落物不仅会显著改变土壤动物、微生物活性及多样性和酶活性,土壤有机质腐殖质化和矿化过程等土壤物理化学属性和过程均受到影响[15- 18]。尽管先前的研究已经加深了对模拟氮磷沉降、凋落物添加和凋落物分解的理解,但多数研究多局限于单一元素的添加或处理,或多用凋落物分解袋法模拟新鲜凋落物分解过程。虽然后者操作简单,可控性强,但严重影响试验结果,使凋落物从根本上离开了其原来所处的自然环境,阻止其直接接触土壤层,破坏了其原有的微环境及其表面的生物区系,在一定程度上直接或间接地干扰了土壤动物、微生物活动,导致微生物群落的潜在变化,降低样地土壤的酶活性等,从而影响了试验结果的准确性。
本文通过对小兴安岭阔叶红松林(以下简称天然林)和红松人工林(以下简称人工林)为期380 d的原位培养试验,分析凋落物质量与氮磷沉降对凋落物中TOC、木质素释放规律的影响及其在凋落物分解过程中模拟氮磷沉降与凋落物添加的作用时间及程度,旨在为深入理解凋落物分解过程及森林生态系统微环境变化进而强化对小兴安岭红松森林生态系统的有效保护提供科学认识。本研究的具体目标是:(1)分析凋落物添加对凋落物TOC、木质素浓度和释放的影响。(2)评估模拟氮磷沉降对凋落物TOC、木质素浓度和释放的影响。(3)在自然的凋落物分解环境下,阐明凋落物添加和模拟氮磷湿沉降耦合作用对凋落物碳释放与木质素降解的影响。
1 材料与方法
1.1 研究区概况
研究区位于黑龙江省伊春市带岭区凉水国家级自然保护区(47°6′49″—47°14′22″ N,128°47′08″—128°57′19″ E)。该区地处欧亚大陆东缘,具有明显的温带大陆性季风气候特征,年均气温-0.3℃,年均最高气温7.5℃,年均最低气温-6.6℃,年均降水量680 mm,年无霜期100—120 d,年均蒸发量800 mm,年均日照时数1850 h。地带性土壤为暗棕壤,非地带性土壤为草甸土、沼泽土和泥炭土。本区域的地带性植被是以红松(Pinuskoraiensis)为主的针阔混交林,属温带针阔叶混交林地带北部亚地带植被,森林覆盖率达98%。从整个阔叶红松混交林的分布来看,属典型阔叶红松混交林亚区,是典型的地带性顶极群落类型。
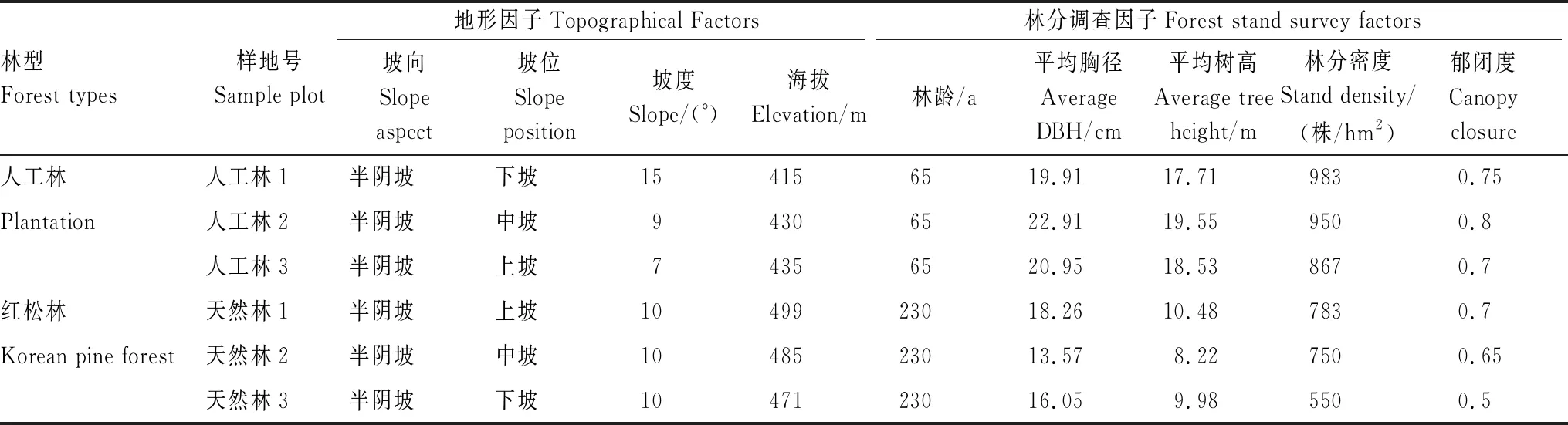
表1 阔叶红松林和红松人工林基本样地概况
1.2 试验设计
1.2.1样地选择与设置
2017年 9月,在凉水国家级自然保护区具有代表性并相邻的阔叶红松林和红松人工林中,分别按照坡位(上坡、中坡和下坡)建立3块(20m×30m)且间隔20m的固定试验样地(以下简称样地)。在每一块样地内,对所有胸径≥2cm的树种名称、胸径、树高、冠幅及枝下高进行记录和测定,并挂牌标记。同时测定和记录每块样地的海拔、坡向、坡度、坡位等地形因子和地理位置(经纬度)等。红松人工林为纯林,主要树种红松的蓄积量占比为92.4%,其他树种占比为7.6%。阔叶红松林是以红松为主的混交林,伴生有多种温性阔叶树种,如紫椴(Tiliaamurensis)、糠椴(Tiliamandshurica)、枫桦(Betulacostata)、蒙古栎(Quercusmongolica)、大青杨(Populusussuriensis)、裂叶榆(Ulmuslaclnlata)和五角槭(Acermono)等,其中主要树种红松的蓄积量占比为78.7%,其他树种占比为21.3%。
1.2.2样地内小样方设置和凋落物处理
在每个样地内,随机设置12个样方(2m×2m),其中,第1—4样方,设置为保持地表凋落物原状(以下简称为原样组);第5—8样方,去除地表凋落物,有序清除样方土壤表层上凋落物及可见腐殖质,每月定期清除新鲜凋落物;第9—12样方,将5—8样方去除的凋落物有序添加到9—12样方内(以下简称为双倍组),均匀平铺到各样方原有凋落物上,两种林型共设置72个样方(2(林型)×3(样地)×12(样方))。试验持续时间为380 d,在2017年10月、2018年6月、8月、10月共4次采集凋落物样品。每次采集时,首先在每个林型每个样地的每个样方(2m×2m)内随机选择一个小样方(20cm×20cm),分L(未分解层,由新鲜凋落物组成,保持原有形态,颜色变化不明显,质地坚硬,外表无分解的痕迹)、F(半分解层,叶无完整外观轮廓,多数凋落物已经粉碎,叶肉被分解成碎屑)、H(腐殖质层,已不能辩识原形)三个层次采集凋落物,每次采集144组凋落物(2(林型)×3(样地)×8(样方)×3(凋落物层数)),2017年10月—2018年10月共采集凋落物576组。各层凋落物分别装袋称重,运回实验室后,在65℃烘箱内烘干至恒重,以测定其质量含水量。将烘干的凋落物粉碎后,过0.25mm筛,放入密封袋中保存备用,主要用于测定总有机碳(TOC)、木质素含量等指标。红松人工林同理。
1.2.3模拟氮磷沉降试验
根据当地多年夏季降雨记录及本地区自然 N、P 湿沉降量的测定结果,依据自然氮磷沉降背景值并参考国际上同类研究的处理方法[19- 20],设置模拟氮磷沉降的强度和频度。本试验设置了4个浓度的模拟氮磷沉降:对照CK(0 g N m-2a-1、0 g P m-2a-1)、低浓度氮磷(5 g N m-2a-1、5 g P m-2a-1)、中浓度氮磷(15 g N m-2a-1、10 g P m-2a-1)和高浓度氮磷 (30 g N m-2a-1、20 g P m-2a-1)。每个水平设定3个重复。在2018年5—9月的每月月底非降雨时段,先将样方内的凋落物采集后再使用 2 L 喷壶,采用人工均匀喷洒的方式进行模拟氮磷沉降试验。
1.3 凋落物养分含量的测定及计算方法
1.3.1凋落物养分含量的测定
凋落物C含量用碳氮分析仪(Elementar, Vario EL cube, Germany)测定,凋落物木质素采用重铬酸钾-硫酸亚铁铵法[21]测定。
1.3.2凋落物C残留量、贮量、释放量计算
(1)水分换算系数(k2)计算:
k2=w2∕w1
(1)
式中,w1(g):小样方内凋落物湿重;w2(g):小样方内凋落物干重
(2)样方内凋落物干重(G, g/m2)计算:
G=ai×(1)
(2)
式中,i分别表示样方内L、F、H层凋落物湿重
(3)每hm2L、F、H层凋落物干重(DG,kg/hm2)的计算:
DG=(2)×10/0.04
(3)
(4)每hm2凋落物总干重(TG,kg/hm2)的计算:
TG=DG1+DG2+DG3
(4)
式中,TG为L、F、H层凋落物干重总和,DG1表示每hm2L层凋落物干重,DG2表示每hm2F层凋落物干重,DG3表示每hm2H层凋落物干重
(5)总凋落物C贮存量(ZX,kg/hm2)的计算:
ZX(kg/hm2)=(4)×C%
(5)
式中,C%:样方内C含量(mg/g)
(6)L、F、H层C释放量S(kg/hm2)的计算:
S=Bi(凋落物经过一段时间分解后的重量)-Bi′(初始重量)
(6)
式中,i分别表示L、F、H层C贮量(kg/hm2)。若S>0,元素积累;反之,元素释放。
(7)每hm2C释放量ZS(kg/hm2)的计算:
ZS=S1+S2+S3
(7)
1.4 数据处理
采用Microsoft Excel 2013软件和Origin 2017对数据进行处理和绘图,采用SPSS 19.0统计分析软件对不同林型凋落物TOC、木质素含量在分解过程中的影响因素进行单因素方差分析(one-way ANOVA)和差异显著性检验(LSD法,α=0.05)。凋落物处理和氮磷沉降在凋落物分解过程中对TOC和木质素的影响用双因素方差分析(two-way ANOVA)。
2 结果与分析
2.1 不同凋落物层在凋落物处理下的C释放量变化特征
由图1可以看出,人工林原样组L、F、H层凋落物在6月开始C积累。8月L层凋落物C积累量增大,F层积累量有所降低,H层大量释放。10月L、F层凋落物C释放,H层释放量降低。
在双倍处理下,人工林L、F、H层在6月均呈C积累状态。到了8月,L层积累量加大,F层积累量略增加,H层C释放。10月,L、F层凋落物C快速释放,H层再次积累。
天然林原样组L、F、H层凋落物在6月开始C积累,8月L、F、H层凋落物C积累量增加。10月,L、F、H层C释放,其中,F层释放最快。
在双倍处理下,天然林L、F、H层在6月均为C积累。8月,L、F层积累量逐渐减小,开始C释放,H层C持续积累。10月,F、H层C快速而大量释放,L层释放量有所降低。
2.2 不同凋落物层在凋落物处理下的木质素降解量变化特征
由图2可见,人工林原样组、双倍组木质素降解量的变化趋势相似,6—8月L、F、H层木质素残留量增加,表现为积累;8—10月,L、F层木质素残留量却开始减少,表现为释放;与原样组H层相反,8—10月,双倍组H层木质素降解量较小。
天然林原样组与双倍组残留量变化特征截然不同,6—8月原样组L、F、H层木质素残留量增加,表现为积累;而6—8月双倍组F层木质素表现为释放。8—10月,原样组L、F、H层木质素残留量均有不同程度的减少;而双倍组F、H层木质素残留量有所减少,表现为释放;L层木质素残留量增加,表现为积累。
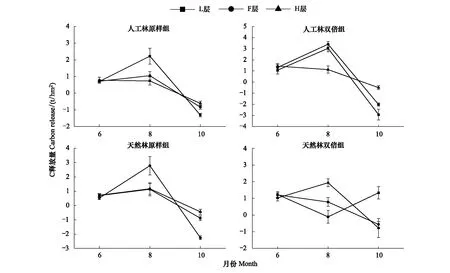
图1 6—10月在凋落物处理下的C释放量变化特征Fig.1 Change characteristics of C release under double treatment from June to October若图中的数值<0,则表示C释放,反之,则为C积累
2.3 模拟氮磷沉降下的C释放量
6月,人工林凋落物C在高浓度氮磷沉降下更偏向于积累过程,低、中浓度氮磷沉降抑制C积累(表2)。8月,低、高浓度的氮磷沉降均促进C释放:高浓度>低浓度,中浓度氮磷沉降下的凋落物表现为C积累。10月,低、中、高浓度的氮磷沉降抑制C释放。
试验初期,在不同氮磷沉降处理下C释放量大小依次为:中浓度>低浓度>CK,高浓度氮磷释放处理抑制C释放;试验中期表现为:高浓度>低浓度>中浓度>CK;后期低、高浓度氮磷沉降处理均抑制C释放。
6月,天然林凋落物C在高浓度氮磷沉降下表现为积累过程,低、中浓度氮磷沉降抑制C积累。8月低、高浓度氮磷沉降促进C释放,高浓度>低浓度,中浓度氮磷沉降抑制C释放。10月,低、中、高浓度的氮磷沉降抑制C释放。
试验初期,在不同氮磷沉降处理下C释放量大小依次为:低浓度>CK、中浓度>高浓度;试验中期表现为:高浓度>CK>低、中浓度;后期CK>中浓度>低浓度>高浓度。
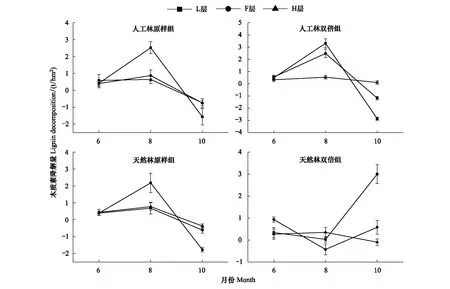
图2 6—10月在凋落物处理下的木质素降解变化特征Fig.2 Change characteristics of lignin degradation under double treatment from June to October若图中的数值<0,则表示木质素释放,反之,则为木质素积累
由此得出,初期,低、中浓度氮磷沉降促进人工林C释放,低浓度氮磷沉降促进天然林C释放;中期,高浓度氮磷沉降促进两个林型凋落物的C释放;后期三种浓度的氮磷沉降均抑制两个林型凋落物的C释放。在整个观测期间,天然林释放量均高于人工林。

表2 人工林和天然林在不同模拟氮磷沉降下的C释放量/(g/kg)
图3 6月人工林、天然林木质素含量在模拟氮磷沉降下的变化特征Fig.3 Change characteristics of lignin content of artificial forest and natural forest under simulated subsidence in June
2.4 模拟氮磷沉降对凋落物层木质素含量影响
如图3所示,6月,人工林原样组L、H层的木质素含量在低、中浓度氮磷沉降处理下显著高于CK和高浓度;F层,中浓度更促进木质素含量的增加,低、高浓度的无显著影响。人工林双倍组L层木质素含量在高浓度下最高,低、中浓度的无显著影响;F层木质素含量在低、中、高3种浓度氮磷沉降下均显著低于对照组。H层,中浓度更促进木质素含量的增加,低、高浓度的无显著影响。
天然林原样组L层的木质素含量在高浓度模拟氮磷沉降处理下最高,中浓度的无显著影响,低浓度使木质素含量降低;F层木质素含量在低、中、高3种浓度氮磷沉降下均显著低于对照组。H层木质素含量在低浓度模拟氮磷沉降处理下最高,高浓度使木质素含量降低。天然林双倍组L、F层木质素含量在低、中、高3种浓度氮磷沉降下均显著低于对照组。H层木质素含量在中、高浓度模拟氮磷沉降处理下较高,低浓度使木质素含量降低。
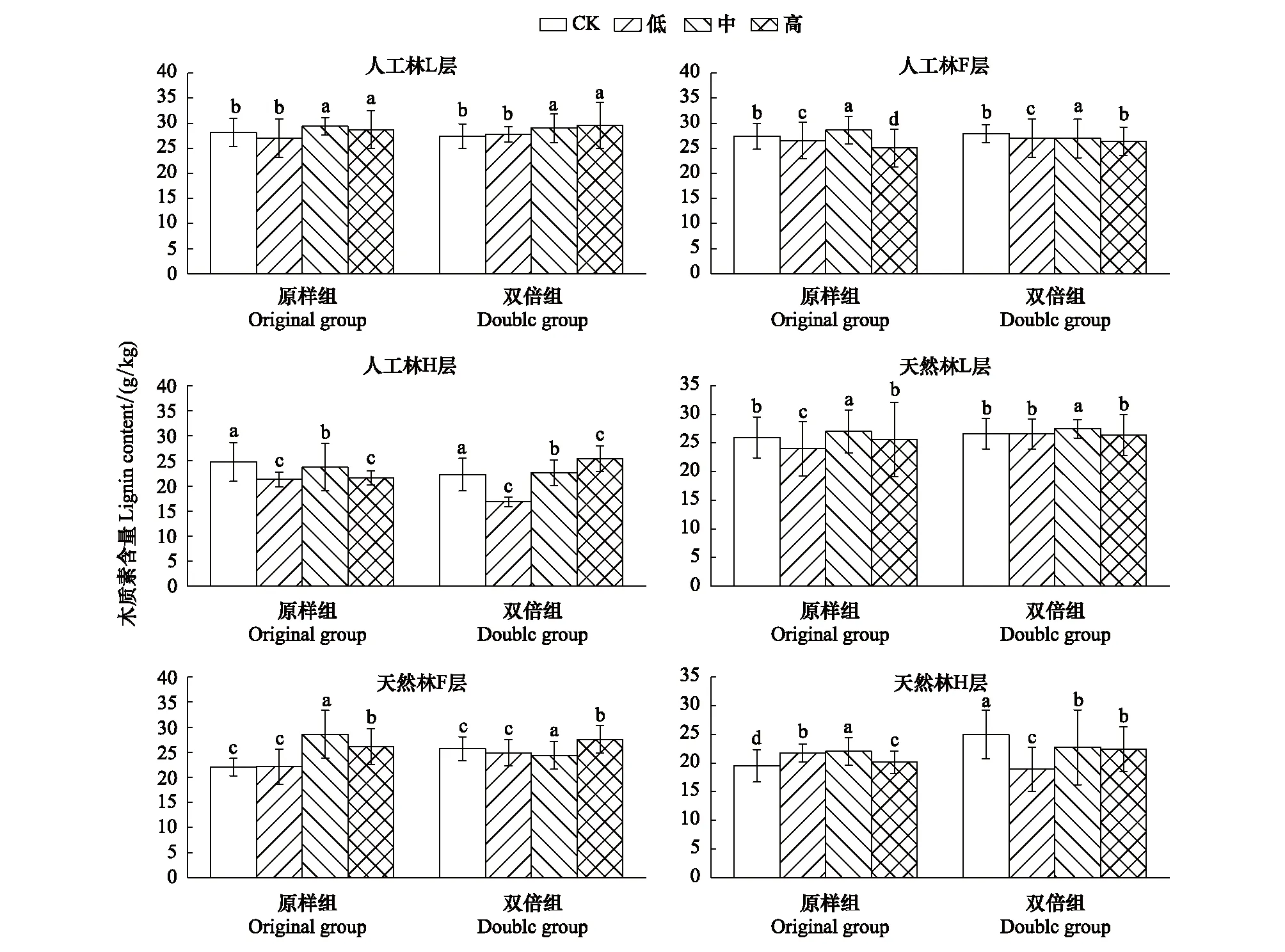
图4 8月人工林、天然林木质素含量在模拟氮磷沉降下的变化特征Fig.4 Change characteristics of lignin content of artificial forest and natural forest under simulated subsidence in August
由图4可见,8月,人工林原样组L、F层木质素含量在中浓度氮磷沉降下最高,其中低浓度使L、F层木质素含量降低,H层木质素含量在低、中、高3种浓度氮磷沉降下均显著低于对照组。人工林双倍组L、H层木质素含量在中、高浓度氮磷沉降下较高,F层木质素含量在低、中、高3种浓度氮磷沉降下均显著低于对照组。
天然林原样组L、F、H层木质素含量在中、高浓度氮磷沉降下较高。天然林双倍组L层木质素含量在中浓度氮磷沉降处理下最高,F层则为高浓度促进,中浓度抑制。H层木质素含量在低、中、高3种浓度氮磷沉降下均显著低于对照组。
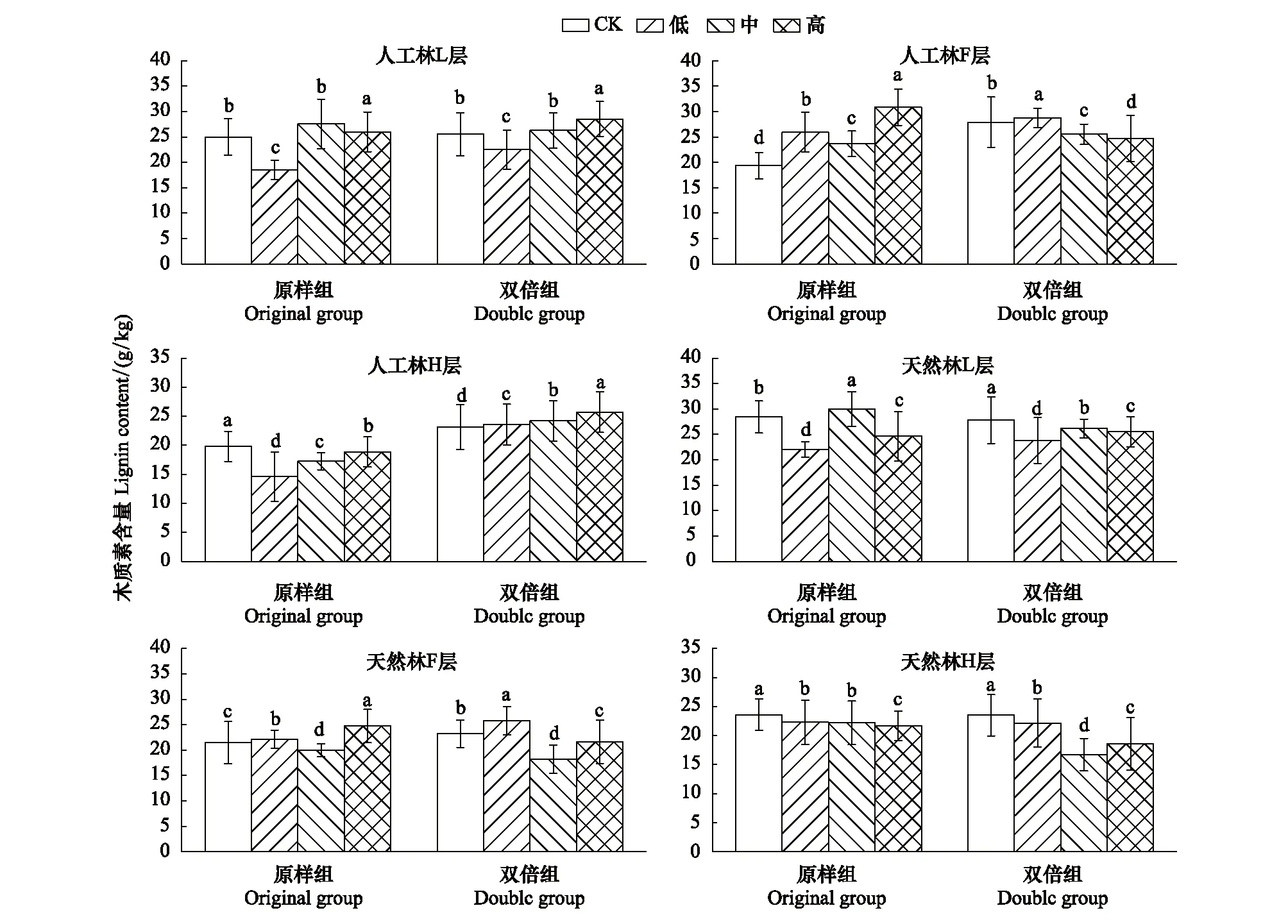
图5 10月人工林、天然林木质素含量在模拟氮磷沉降下的变化特征Fig.5 Change characteristics of lignin content of artificial forest and natural forest under simulated subsidence in October
由图5看出,10月,人工林原样组L层木质素含量在低、高浓度下有所降低,F层木质素含量在低、高浓度下增加,中浓度则使其降低。H层木质素含量在低、中、高3种浓度氮磷沉降下均显著低于对照组。人工林双倍组L层木质素含量在模拟氮磷沉降处理下大小依次为:低浓度>高浓度>中浓度>CK;F层为:低浓度>CK>中>高;H层为:高浓度>中浓度>低浓度>CK。
天然林原样组L、F、H层木质素含量在3种模拟氮磷沉降处理下均低于对照组。天然林双倍组L、H层木质素含量在3种模拟氮磷沉降处理下均低于对照组,F层木质素含量则表现为:低浓度>CK>高浓度>中浓度。
2.5 氮磷沉降与凋落物处理对碳、木质素含量的交互作用
双因素方差分析表明(表3),6月,模拟氮磷沉降处理对凋落物的C、木质素含量均有显著影响。10月,凋落物处理均显著影响C含量和木质素含量。但凋落物处理与模拟氮磷沉降处理间无相互作用。
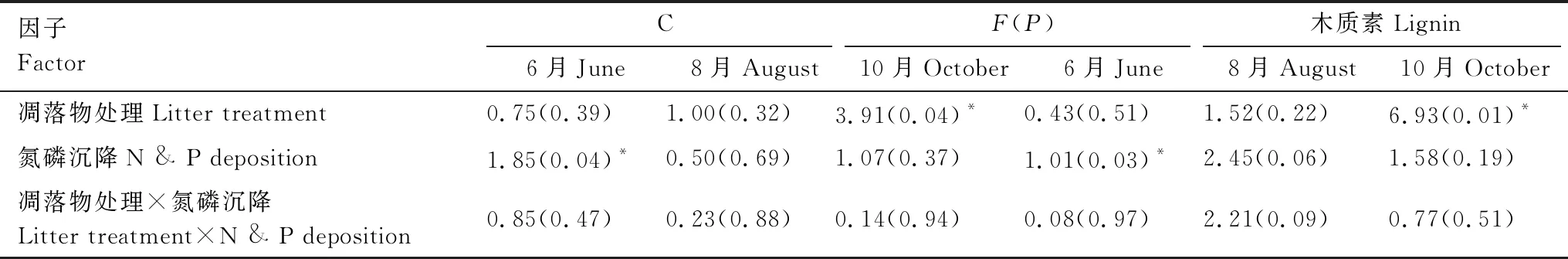
表3 凋落物不同月份碳、木质素含量双因素方差分析(P<0.05)
3 讨论
3.1 凋落物处理对凋落物TOC、木质素释放的影响
凋落物添加在前期(6月)抑制人工林L层的C释放,后期(10月)促进人工林L层的C释放;而人工林H层的C释放则在凋落物处理下前期(6月)和后期(10月)分别呈现促进和抑制作用。凋落物添加在前期是促进天然林L层C释放的,但在后期却产生抑制作用。与L层相反,凋落物添加持续促进天然林H层的C释放。但10月时,凋落物添加下的天然林L层开始C积累,而原样组C释放。F层的原样组和双倍组差异不大,可能是由于F层是转移层,C、木质素等营养物质不稳定,在此层停留时间不长就流向了下一层H层,而L层与H层在凋落物处理下差异显著一是由于L层凋落物是表面层,在土壤动物、小气候变化(其中包括沉降、降雪、温度变化等)[22- 24]下分解速率加快,二是由于H层紧贴土壤,上层的凋落物起到一定的遮阴作用[25],又在土壤动物和微生物群落、土壤含水量、养分含量等联动作用[26]下分解。
本试验发现,木质素和C在凋落物添加下有着相似的时间变化趋势。多数研究认为,添加凋落物会抑制或促进凋落物分解,但均未对凋落物层的释放量进行讨论[27-28]。Xing等[29]认为,上层凋落物(未分解层)和下层凋落物(腐殖质层)的化学组成不同,因此,可通过改变凋落物的输入对土壤微生物群落产生影响,在分解的早期阶段(前72天),对上层凋落物(未分解层)进行凋落物添加促进凋落物分解;但在分解的后期(72天后),凋落物添加没有显著影响。相比之下,对下层凋落物(腐殖质层)进行凋落物添加并未在早期或晚期显著影响凋落物分解。本试验关于天然林的实验结果在前期与Xing[29]的相同,但后期却不同。究其原因可能由于野外试验和室内培养之间的不同而造成的差异[30]。凋落物添加降低了试验后期人工林凋落物C释放量,减缓了后期天然林凋落物C积累。这可能是因为天然林为阔叶红松混交林,生物多样性高,添加凋落物这种“激发效应”刺激了微生物的活动[31],使得天然林的C释放量高于红松人工林(纯林)。也就是说,凋落物的增加会促进凋落物质量较好的林分释放养分,但凋落物质量较差的林分则相反。这与Shahzad等[32]、张素彦等[33]的研究结果一致。
3.2 模拟氮磷沉降对凋落物TOC、木质素浓度和释放的影响
在本试验初期(6月),低、中浓度氮磷沉降显著促进人工林凋落物的C释放,低浓度氮磷沉降显著促进天然林凋落物C释放;后期(10月)低、中、高3种浓度的氮磷沉降均抑制两个林型凋落物的C释放。王晓荣等[34]通过不同营林措施对马尾松细根分解与养分释放研究后发现,C元素在凋落物分解过程中表现为持续释放,且在分解初期3个月释放最快。C元素因其碳水化合物的易分解性,在凋落物分解过程中往往最先分解释放出来。这与我们前期试验结果一致。而后期氮磷沉降的抑制作用可能是由于非生长季,植物对养分需求量较低[35],且温湿度的变化导致微生物分解过程较缓慢[36],凋落物养分释放量低。
有很多研究表明,氮磷沉降显著增加了凋落物的释放分解过程[10,37],但是这只是在一定程度上的促进,一旦添加过高的氮磷沉降时,往往引起的是抑制作用[38]。本试验中,人工林和天然林在落叶季(10月),大量凋落物输入时,在高浓度氮磷沉降条件下,C释放量显著低于对照组和其他浓度的氮磷沉降处理,正好也验证了这一结论。
总体来看,本试验的氮磷沉降显著促进了人工林和天然林L、H层凋落物的分解。但低、中、高3种浓度的氮磷沉降均使人工林和天然林双倍组L、H层的木质素增加,表明高浓度的氮磷添加会抑制木质素的降解。陈伟等[39]研究了阔叶红松林土壤木质素稳定性对氮添加的响应后发现,施氮处理显著降低了土壤中木质素总量,即促进分解。这符合本试验中凋落物原样组的变化规律,即氮磷沉降促进凋落物分解。而铁烈华[40]等认为,低氮沉降对木质素分解无显著影响,高氮沉降显著抑制了木质素分解。这与本试验双倍处理下凋落物L、H层木质素含量变化一致,但其低氮沉降试验[39]与本试验结果存在差异的原因可能是因为凋落物化学组成[41]及试验环境[42]的差异导致的。
3.3 氮磷沉降与凋落物添加对碳、木质素含量的交互作用
试验结果证明,模拟氮磷沉降仅在试验前期(6月)对凋落物C含量和木质素含量有显著影响,凋落物添加仅在试验后期(10月)对以上两者有显著影响,两种处理之间无交互作用。这与一些研究结果[38-39]不同的原因可能是由于试验时间和试验环境的不同所导致[40]。木质素长期以来被认为是限制凋落物分解速率的重要因素,但最近的研究结果表明,木质素可能是凋落物分解过程中降解最快的[20]。因本次研究未对可提取的木质素酚类成分进行分析,所以在凋落物早期分解阶段释放的C是否能够作为推动木质素降解的基底尚未知晓。
4 结论
凋落物添加促进或抑制凋落物释放,取决于凋落物其本身的化学组成。对于人工林来说,凋落物的添加抑制其C、木质素释放,但如果对其实施模拟氮磷沉降则表现为促进作用。对于天然林,凋落物的添加促进其C、木质素释放,但如果对其实施高浓度氮磷沉降则表现为抑制作用,两者无交互作用。木质素长期以来被认为是限制凋落物分解速率的重要因素,因本次研究未对可提取的木质素酚类成分进行分析,所以在凋落物早期分解阶段释放的C是否能够作为推动木质素降解的“基底”还尚未得知,需通过其他试验进行进一步的研究。

