蔗糖添加对杉木低磷胁迫响应和蔗糖代谢的影响
陈冉红, 周梦岩, 李娇阳, 钟伟民, 吴鹏飞,2, 马祥庆, 李 明,2,*
1 福建农林大学林学院, 福州 350002 2 福建省杉木种质创新工程研究中心, 福州 350002
磷是植物生长发育所必需的大量营养元素之一[1]。由于我国南方森林土壤中铁、铝等金属离子的存在,以及土壤粘粒对磷的吸附作用,土壤中的无机磷大多以难溶性的磷酸铁、磷酸铝和被土壤粘粒包裹的闭蓄态磷的形式存在,很难到达林木根际被直接吸收利用,南方广大的人工林树种往往呈现长期缺磷状态[2]。杉木(Cunninghamialanceolata(Lamb.)Hook.)是我国人工林造林面积最大的树种,其生长之快、单产之高、材质之好均居我国主要造林树种的首位[3]。由于我国南方红壤区土壤有效磷不足且异质性分布,以及杉木多代连栽的经营方式对土壤有效磷磷的长期消耗,导致土壤有效磷养分不足成为限制杉木人工林产量和质量的重要因素之一[4- 5]。
蔗糖是植物光合作用终产物之一,不仅为植物形态建成提供了所需的碳源和生命活动的能量,还作为植物体内的重要信号分子调节植物的生长、发育以及植物的抗逆境反应,并与氮、磷等营养元素相互作用[6]。蔗糖被认为是植物响应低磷胁迫的重要信号物质,低磷胁迫下韧皮部的蔗糖转运可能参与了低磷信号转导和磷转运、根系生长和根毛的产生、酸性磷酸酶的分泌与生长素的合成等代谢途径[7- 8]。低磷胁迫诱导了植物对光合同化作用的高需求过程,从而产生更多的碳源来满足根系生长、有机酸分泌和磷转运增强等代谢过程[9- 10]。低磷胁迫下,植物也可以通过调整糖酵解途径来降低对磷的消耗,并通过蔗糖浓度的变化来传递低磷胁迫信号,从而提高植物对低磷逆境的适应能力[11]。低磷胁迫下环剥白羽扇豆韧皮部来阻断蔗糖运输后,其根系低磷诱导响应基因LaPT1、LaSAP1、LaMATE等的表达量显著下降,而添加蔗糖能够明显促进白羽扇豆排根增生[12]。拟南芥蔗糖转运蛋白AtSUC2突变体根、茎中蔗糖含量明显高于野生型,更有利于其在缺磷时作出适应变化;AtSUC2的缺失会降低植株低磷适应能力,而低磷胁迫下施加外源蔗糖时拟南芥体内大多数磷饥饿诱导基因上调表达,这一结果为蔗糖系统性调节植物适应低磷胁迫提供了证据[8]。Tian等研究认为,miRNA399可能是植物长日照条件下光响应、磷稳态和蔗糖信号传递的潜在整合者,高水平的蔗糖抑制了拟南芥在低磷胁迫下miRNA399的积累,而外源蔗糖的补充也降低了低磷胁迫下miRNA399的表达[13]。
因此,对拟南芥和水稻等模式植物的研究表明,外源蔗糖的添加会影响植物低磷胁迫信号的响应,并改变低磷胁迫下植物根系生长和磷饥饿诱导相关基因的表达[8,10,14]。此外,磷高效和磷低效植物基因型在低磷胁迫下的蔗糖代谢也存在差异[15-16]。低磷胁迫下磷高效型玉米品种 KH5 蔗糖含量高于磷低效型西502,而耐低磷水稻品种在低磷胁迫的早期糖酵解途径增强,从而为侧根和根毛生长提供更多的物质和能量,不耐低磷水稻品种在低磷胁迫早期糖酵解就开始减弱[11,17]。课题组对杉木响应低磷胁迫的研究也显示,随着磷胁迫程度的加深,杉木根系糖类等碳水化合物减少[18]。低磷胁迫下杉木地上部和地下部蔗糖浓度的改变与其根系伸长、细根增生、有机酸分泌等低磷适应机制密切相关[19]。杉木响应低磷胁迫下的根系转录组和蛋白质组分析也表明,淀粉和蔗糖代谢通路是杉木根系响应低磷胁迫的关键富集通路,蔗糖合成酶、葡萄糖苷酶等蛋白在杉木根系响应低磷胁迫中发挥着重要作用[20-21]。作为低磷胁迫响应的信号物质,杉木地上部与地下部的蔗糖平衡会对其低磷胁迫响应具有怎样的影响呢?外源蔗糖添加会怎样影响杉木根系形态、磷转运、酸性磷酸酶分泌等低磷胁迫响应呢?
在对不同杉木家系磷利用效率研究的基础上,课题组筛选出两种不同磷效率杉木家系M32和M28,不供磷处理下的磷利用效率分别为(1.09±0.02)kg/g和(0.73±0.06)kg/g[22]。其中,M32在低磷胁迫下根系增生不明显,主要通过加快体内磷素循环来抵抗磷胁迫逆境;M28在低磷胁迫下能够通过根系增生和酸性磷酸酶的分泌来活化土壤磷。这两种具有不同磷素利用效率和特性的杉木家系是进行蔗糖添加下杉木低磷胁迫响应的良好材料。因此,本研究选用M32和M28分别进行低磷胁迫下的蔗糖添加试验,研究蔗糖添加对低磷胁迫下两种杉木家系形态特征、生理特性和低磷诱导相关基因的表达,研究结果有助于认识信号物质蔗糖参与杉木低磷胁迫响应调控网络的关键作用,为磷高效杉木基因型的选育提供参考。
1 材料与方法
1.1 试验材料
本试验选用1年生M32和M28杉木家系容器苗进行沙培盆栽试验,采用1/3改良霍格兰营养液,浇水缓苗7d后进行低磷胁迫下的蔗糖添加试验[23]。试验设置正常供磷(1.0mmol/l KH2PO4)(+P)、低磷胁迫(0.1 mmol/L KH2PO4)(-P)、正常供磷+营养液添加3%浓度蔗糖(+P+S)、低磷供磷+营养液添加3%浓度蔗糖(-P+S)4种处理,每个处理48株幼苗,每隔两天每株浇15mL营养液,分别在培养15d和45d时进行收获。
1.2 形态测定
在处理0d和45d时测定每株参试杉木幼苗的苗高,计算苗高增量。使用Expression 11000XL数字化扫描仪对胁迫0d和45d的杉木根系进行扫描,并使用WinRHI20植物根系分析软件分析根系形态参数,每个处理设置3次生物学重复。
1.3 生理指标测定
在处理0d、15d和45d时分别测定杉木幼苗根叶组织磷含量、蔗糖含量、蔗糖合成酶活性、蔗糖磷酸合成酶活性和叶片花青素含量,每个处理设置3次生物学重复和3次试验重复。其中,磷含量采用硫酸-高氯酸消煮提取,并使用电感耦合等离子体发射光谱仪(ICP)测定;花青素含量采用有机溶剂浸提法提取和测定[24];蔗糖含量、蔗糖合成酶活性和蔗糖磷酸合成酶活性分别采用Solarbio检测试剂盒测定。
1.4 基因表达分析
根据杉木响应低磷胁迫的转录组和蛋白质组测序结果,筛选蔗糖合成酶ClSuSy、蔗糖转运蛋白SUT4、磷转运蛋白ClPht1;4、紫色酸性磷酶基因PAP1和PAP11进行基因表达分析,具体引物见表1。在处理0d、15d和45d时分别收获杉木幼苗根系,使用天根公司的RNAprep Pure Plant Kit 试剂盒提取根样品的总RNA,采用 Promega 公司的Go-ScriptTMReverse Transcription System 试剂盒进行反转录试验,合成杉木RNA 样品 cDNA 第 1条链,统一稀释至100ng/μL后用于荧光定量 PCR试验。采用10μL荧光定量PCR体系60℃退火30s,72℃延伸30s,共45 个循环;95℃ 30s,60℃ 30s,逐渐升温到95℃,速度0.11℃/s。采用2-△△CT法计算目的基因的相对表达量,设置3次生物学重复和3次试验重复。
1.5 数据统计
数据统计分析采用软件SPSS 12.0,图表绘制采用软件Origin 8.5。
2 结果与分析
2.1 低磷胁迫下蔗糖添加对杉木苗高的影响
M28和M32苗高增量在四种处理下均呈现出:正常供磷+蔗糖添加>低磷胁迫+蔗糖添加>正常供磷>低磷胁迫,低磷或正常供磷处理下添加蔗糖后M28和M32的苗高增量都有显著性提高,且正常供磷的苗高增量大于低磷处理的苗高增量,表明外源蔗糖添加和磷素营养均能够促进杉木苗高生长(图1)。

表1 引物序列

图1 磷胁迫下蔗糖添加对杉木M28和M32苗高增量的影响Fig.1 Effects of sucrose addition on the increment of height of M28 and M32 under phosphorus stress不同大写字母表示同一处理不同家系间差异显著(P<0.05);不同小写字母表示同一家系不同处理间差异显著(P<0.05);+P:正常供磷(1.0 mmol/l KH2PO4)、-P:低磷胁迫(0.1 mmol/L KH2PO4)、+P+S:正常供磷+营养液添加3%浓度蔗糖、-P+S:低磷供磷+营养液添加3%浓度蔗糖;+P: Normal supply of phosphorus, -P: Low phosphorus supply, +P+S: Normal phosphorus supply + addition of 3% sucrose to nutrient solution, -P+S: Low phosphorus supply + addition of 3% sucrose to nutrient solution
2.2 低磷胁迫下蔗糖对杉木幼苗根系形态的影响
M28与M32根系总长度增量都表现为:正常供磷+蔗糖添加>低磷胁迫+蔗糖添加>正常供磷>低磷胁迫,其中蔗糖添加处理的根系总长度显著大于无蔗糖添加处理,根平均直径增量、根体积增量和根表面积增量也呈现类似规律,表明蔗糖添加对低磷胁迫下的根系伸长和根直径增加有促进作用(图2)。M28与M32根长增量、根体积增量、根平均直径增量和根表面积增量存在显著差异性;M28在添加蔗糖时根系增量显著高于无糖处理,而M32不显著,表明M28的根系形态更容易受外界蔗糖环境的影响。
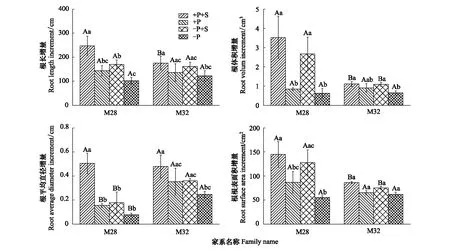
图2 磷胁迫下蔗糖添加对杉木M28和M32根系生长的影响Fig.2 Effects of sucrose addition on the root growth of M28 and M32 under phosphorus stress
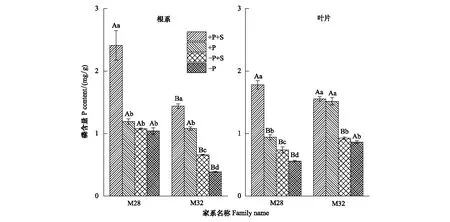
图3 磷胁迫下蔗糖添加对杉木M28和M32根系和叶片磷含量的影响Fig.3 Effects of sucrose addition on phosphorus contents in roots and leaves of M28 and M32 under phosphorus stress
2.3 低磷胁迫下蔗糖添加对杉木根叶组织磷含量的影响
M28与M32根、叶组织磷含量存在显著差异,M28根中磷的含量显著高于M32,而叶中磷的含量低于M32(图3)。M28与M32根、叶组织中磷含量都呈现为:正常供磷+蔗糖添加>正常供磷>低磷胁迫+蔗糖添加>低磷胁迫,供磷处理下的杉木根、叶组织磷含量都显著高于低磷胁迫处理。在供磷或低磷处理下,外源蔗糖添加都会增加杉木地上部与地下部的磷含量,这可能与杉木根部充足的蔗糖供给影响了杉木低磷信号传递有关,也可能是外源蔗糖添加能促进杉木韧皮部磷酸蔗糖的循环来提高植株的磷利用率。
2.4 低磷胁迫下蔗糖添加对杉木叶片花青素含量的影响
M28与M32叶片花青素相对含量表现为:低磷胁迫+蔗糖添加>正常供磷+蔗糖添加>低磷胁迫>正常供磷,两个家系在处理15d和45d后的花青素相对含量存在显著差异(图4)。与正常供磷相比,低磷胁迫15d和45d诱导了M28叶片花青素相对含量显著性升高,而M32的叶片花青素含量与正常供磷处理差异不显著,显示M32叶片糖代谢过程对低磷胁迫较强的耐受性而不积累较多的糖苷。蔗糖添加处理下,M28在低磷胁迫和正常供磷处理15d和45d时叶片花青素含量都差异显著,且低磷胁迫下叶片花青素含量显著高于供磷处理;M32在低磷处理15d和45d时叶片花青素含量都显著高于正常供磷处理。总体上,蔗糖添加显著促进了杉木叶片花青素的积累。

图4 磷胁迫下蔗糖添加对杉木M28和M32叶片花青素相对含量的影响Fig.4 Effectsof sucrose addition on relative anthocyanin contents of of M28 and M32 under Phosphorus Stress
2.5 低磷胁迫下蔗糖添加对杉木根叶组织蔗糖含量的影响
总体上,与正常供磷或低磷胁迫处理相比,分别添加蔗糖15d和45d处理显著提高了M28和M32根、叶组织蔗糖含量;相同供养条件下45d时M28和M32根、叶组织蔗糖含量远高于15d处理,且M32家系变化更显著,表明胁迫时间的长短对于杉木体内蔗糖的储存有重要影响。M28与M32根、叶组织蔗糖含量在相同处理条件下存在一定的差异,特别是处理45d时M28与M32根系蔗糖含量差异显著。随着胁迫时间的加长,在供磷以及供糖时两家系根叶比的蔗糖浓度在上升,且跟的蔗糖含量低于叶含量;缺磷时M32家系也是如此,而M28家系随着胁迫时间的加长根叶比的蔗糖浓度降低。

图5 磷胁迫下蔗糖添加对杉木M28和M32根系和叶片蔗糖含量的影响Fig.5 Effects of sucrose addition on the sucrose content of the roots and leaves of M28 and M32 under phosphorus stress
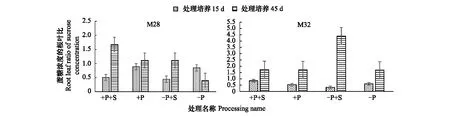
图6 磷胁迫下蔗糖添加下杉木M28和M32蔗糖浓度的根叶比Fig.6 Root leaf ratio of sucrose concentration in M28 and M32 of Cunninghamia lanceolata under phosphorus stress
2.6 低磷胁迫下蔗糖添加对杉木M28和M32蔗糖合成酶活性的影响
试验处理15d和45d后,M28和M32根、叶组织蔗糖合成酶活性在4种处理条件下大都存在显著性差异,且均为低磷胁迫处理下最高;添加或不添加蔗糖处理下,低磷胁迫下的杉木根、叶蔗糖合成酶活性显著高于正常供磷处理;M28根、叶组织中蔗糖合成酶活性都显著高于M32。M28叶组织蔗糖合成酶活性在45d时明显降低,而M32随胁迫时间的变化很小。
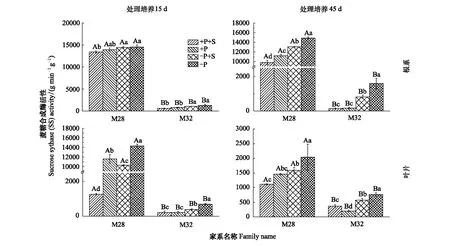
图7 磷胁迫下蔗糖添加对杉木M28和M32根系和叶片蔗糖合成酶活性的影响Fig.7 Effects of sucrose addition on the sucrose synthase activity of the roots and leaves of M28 and M32 under phosphorus stress
2.7 低磷胁迫下蔗糖添加对杉木M28和M32蔗糖磷酸合成酶活性的影响
供磷或低磷处理15d和45d时, M28在不添加蔗糖处理下的叶片蔗糖磷酸合成酶活性基本上都显著高于添加蔗糖处理;M32也呈现出类似的规律(差异不显著),表明根部蔗糖的添加信号反馈减少了杉木叶片的蔗糖合成。在根系组织中,M28在4种试验处理下的蔗糖磷酸合成酶活性都显著高于M32;无论是否添加蔗糖,M28在低磷时的活性显著高于供磷处理,而M32则差异不显著。
2.8 低磷胁迫下蔗糖对杉木M28和M32相关基因的qPCR的分析
蔗糖合成酶基因ClSuSy在杉木根系中受低磷胁迫诱导下调表达,受蔗糖添加诱导上调表达,在正常供磷+蔗糖添加处理时表达量最高,且在M28中表达量远高于M32。蔗糖转运蛋白SUT4除了在低磷处理15d的M32根系中的表达量低于低磷+蔗糖添加处理外,总体上在M28和M32根系中的表达量受低磷胁迫诱导上调表达,受蔗糖添加诱导下调表达。磷转运蛋白ClPht1;4在M32根系中受低磷胁迫诱导上调,受蔗糖添加诱导下调表达,但在M28根系中的表达量变化规律不明显。紫色酸性磷酸酶基因PAP1在M28和M32根系中总体上受低磷胁迫诱导上调表达,在在低磷和低磷+蔗糖添加处理15d时表达量显著增加,但在胁迫45d时表达量又显著降低。PAP1在M28和M32根系中受蔗糖添加诱导上调表达的规律不明显。紫色酸性磷酸酶基因PAP11在M28和M32根系中受低磷胁迫诱导上调表达。PAP11在M32根系中和处理45d的M28根系中的表达量受蔗糖添加诱导下调表达,但在处理15d的M28根系中变化不规律。

图9 基因ClSuSy, SUT4, ClPht1;4, PAP1和PAP11的相对表达量Fig.9 The relative expression of ClSuSy, SUT4, ClPht1;4, PAP1 and PAP11
3 讨论
蔗糖作为低磷胁迫响应信号是通过植物地上部和地下部在低磷胁迫下蔗糖浓度的变化来传递的,而外源蔗糖的添加改变了植物地上部和地下部的蔗糖浓度,也对植物低磷胁迫响应信号的传递产生了重要影响[25]。植物在低磷环境中主要通过根系增生来增强对土壤磷的吸收能力,而外源蔗糖添加也直接影响了植物根系增生时的碳源供给,从而影响着植物地上部和地下部根系生长、养分吸收、物质累积和相关基因的表达变化[7- 8]。孔令剑等研究表明,添加蔗糖处理促进了低磷胁迫下大豆根尖数量、根系生物量、根系蔗糖和磷含量的显著上升[14]。苏军等研究发现低磷胁迫下添加蔗糖处理能够诱导水稻根系生长并改变根系形态结构,而在缺乏蔗糖添加下水稻根的生长受抑制,并认为磷和蔗糖协同调控着水稻根系形态和数量[10]。本试验对低磷胁迫和蔗糖添加耦合处理45d的杉木M28和M32进行苗高和根系形态分析,结果显示外源蔗糖添加促进了低磷胁迫下杉木苗高生长、根系伸长和根直径的增加。这一结果与在大豆、水稻上进行的试验结果较为相似,均显示出低磷胁迫下外源蔗糖添加能够促进根系生长。在外源蔗糖添加作用下,即使处于低磷状态下杉木根系的生长依然超过正常供磷处理,表明杉木根系生长受外界磷和蔗糖的协同作用。
在供磷或低磷情况下,外源蔗糖添加都会增加两种杉木家系地上部与地下部的磷含量和蔗糖含量。低磷胁迫下,从叶到根的蔗糖转运增加是根系生长的必要条件,但是蔗糖向根系的转运和代谢是以磷酸蔗糖的形式通过韧皮部运输来实现的,因此蔗糖向根部的转运也会相应增加根细胞中的磷浓度[26]。苏军等对水稻的研究也表明,在正常供磷下添加蔗糖能够显著降低植株地上部和地下部的无机磷含量,而在低磷时添加蔗糖处理并不能影响植株磷水平,表明增加蔗糖供给能使磷在水稻体内的循环利用率增加,降低植株对磷的依赖[10]。赵建琦等研究表明水稻在低磷环境下添加蔗糖可以增加其体内的磷含量与生物量,而这一现象的原因是蔗糖的添加诱导磷转运蛋白OsPT2的表达促进水稻体内磷的吸收利用[27]。苏军等研究发现低磷胁迫下施加外源蔗糖能够影响水稻幼苗根系中4个磷转运蛋白下调表达,5个磷转运蛋白上调表达,其中OsPT2、OsPT3、OsPT4、OsPT6对磷、糖的影响最为敏感[10]。本试验中,杉木高亲和磷转运蛋白ClPht1;4在M32中受蔗糖添加诱导下调表达,但低磷胁迫下添加蔗糖依然能促进M32磷含量和生物量的增加,这可能是外源蔗糖添加能促进杉木韧皮部磷酸蔗糖的循环来提高植株的磷利用率,也可能是在蔗糖供给能够诱导其它PHT基因的表达来促进杉木磷的吸收。由于蔗糖添加能够有效促进根系生长,对于在低磷胁迫下主要通过根系增生来提高磷利用效率的M28家系,其根系能够获得更多的碳源来促进根系生长,因此外源蔗糖添加对M28磷素吸收和利用的促进作用大于M32。蔗糖磷酸合成酶是植物体内蔗糖合成的关键酶,蔗糖合成酶则是能够促进蔗糖合成与分解的双向酶[28]。孔令剑对低磷胁迫下的大豆进行了蔗糖添加处理,发现其根系蔗糖磷酸合成酶活性随着时间的增加而增强,而蔗糖合成酶活性则在磷高效大豆根系中活性增强,在磷低效大豆中表现出活性下降趋势[29]。本试验中低磷胁迫下的杉木根、叶蔗糖磷酸合成酶和蔗糖合成酶活性基本都高于正常供磷处理,添加蔗糖处理下杉木根、叶蔗糖磷酸合成酶和蔗糖合成酶活性基本上都低于不添加蔗糖处理,表明低磷胁迫下蔗糖合成酶活性和蔗糖磷酸合成酶活性提高促进蔗糖的合成来满足植株对蔗糖的消耗需求,而外界蔗糖供给缓解了植株的蔗糖合成压力。蔗糖添加下杉木体内蔗糖含量的增加也导致了叶片花青素的累积,从而反馈给植物降低蔗糖合成酶和蔗糖磷酸合成酶的活性。
研究表明,低磷胁迫下外源蔗糖的添加能够改变植物根系磷饥饿诱导相关基因和蔗糖代谢相关基因的表达[30-31]。Karthikeyan等研究发现低磷胁迫下外源蔗糖的添加能够诱导拟南芥根系UDP葡萄糖磷酸化酶、IPS1、ACP5、PHT1和PHO1一些家族成员表达量显著上升[32]。本试验中,低磷胁迫下外源蔗糖的添加诱导了蔗糖合成酶ClSuSy上调表达,且在正常供磷并添加蔗糖下表达量最高。低磷胁迫下外源蔗糖的添加诱导了蔗糖转运蛋白SUT4在处理15d的M32根系中上调表达,但在45d时在两个家系中均下调表达。SUT4的上调表达可以促进了杉木根部吸收的外源添加蔗糖向地上部分运输,从而增加低磷胁迫下根系和叶片中的蔗糖含量[33]。于新超等对碳水化合物代谢参与番茄低磷胁迫响应的研究表明,低磷胁迫下番茄植株地上部的光合作用受到影响,导致碳水化合物水平的改变,进而影响了蔗糖转运蛋白的表达及对蔗糖在植株的分配,最终影响了植株对低磷胁迫响应的不同[34]。紫色酸性磷酸酶PAPs能够催化水解磷酸单酯和酸酐类有机磷并释放出无机磷,低磷胁迫下根系分泌PAPs是植物适应低磷胁迫的典型特征,植物体内紫色酸性磷酸酶也可以水解有机磷并释放无机磷[35]。低磷胁迫下对水稻幼苗施加外源蔗糖处理,结果发现根系酸性磷酸酶的分泌受抑制,而磷酸转运酶活性增强,酸性磷酸酶基因OsSAP1在根中受蔗糖添加诱导下调表达[10]。本试验中,PAP1和PAP11受低磷胁迫诱导上调表达,低磷胁迫下受蔗糖添加的诱导表达量总体呈下调趋势,但在15d处理的M32根系中明显上调表达。这表明低磷胁迫诱导杉木根系分泌更多的紫色酸性磷酸酶来水解根际有机磷,外源蔗糖的添加干扰了低磷胁迫信号并影响了PAP的合成与分泌[36]。
研究表明,低磷胁迫下外源蔗糖的添加对磷利用效率不同的两种杉木基因型M32和M28根系形态、生理和相关基因表达的影响不同。M28在四种试验处理下的根系形态指标变化差异显著,而M32的根长和根表面积变化不大,这表明M28根系形态更容易受外界蔗糖和磷环境的影响。在不同糖磷供应处理下,M28更易在根系中积累磷,M32更易在叶组织中积累磷。杉木M28在正常供磷时施加蔗糖会降低其根系与叶片磷含量,而M32基因型却无明显变化。M32在15d和45d低磷胁迫和正常供磷处理下叶片花青素含量差异不显著,显示其叶片糖代谢过程对低磷胁迫较强的耐受性而不积累较多的花青素。四种试验处理下,M28根系中ClSuSy和PAP11表达量远高于M32,但SUT4、ClPht1;4和PAP1的表达量远低于M32,且低磷胁迫下两种杉木家系根中相关基因的表达随蔗糖添加的变化也存在一定的差异。孔令剑等研究表明,与磷高效大豆品种相比,低磷胁迫下添加蔗糖处理对磷低效大豆品种根系生物量、蔗糖和磷含量的增强作用影响更显著[29]。不同杉木家系磷效率的差异受植株对磷素吸收和利用能力决定,磷高效利用杉木基因型在低磷胁迫下具有更强的根系增生能力,酸性磷酸酶和有机酸的分泌能力,根系磷素吸收转运能力和体内磷素循环增强能力等[37]。本研究结果表明,低磷胁迫下增加杉木根系的蔗糖供应,或者促进蔗糖向地下部分运输和分配,能够有效提高杉木对低磷胁迫的适应能力和磷素吸收效率。
4 结论
蔗糖添加促进了低磷胁迫下杉木M28和M32苗高、根长、根表面积、根平均直径、根体积、叶片花青素含量、根叶组织蔗糖含量和根叶组织无机磷含量的增加,但仍明显低于正常供磷处理下添加蔗糖处理的杉木增量。蔗糖添加促进了低磷胁迫下杉木M28和M32根、叶蔗糖磷酸合成酶和蔗糖合成酶活性降低。总体上,低磷胁迫下外源蔗糖的添加诱导了杉木M28和M32根系蔗糖合成酶ClSuSy上调表达,蔗糖转运蛋白SUT4、磷转运蛋白ClPht1;4、紫色酸性磷酸酶PAP1和PAP11下调表达。不同磷效率的杉木家系M28和M32对低磷胁迫下外源蔗糖添加的响应不同,M28根系形态更容易受外源蔗糖添加的影响,M32更易在叶组织中积累磷,M28更易在根系中积累磷,且M28根叶组织中的蔗糖合成酶活性和蔗糖磷酸合成酶活性都高于M32。M28根系中ClSuSy和PAP11表达量远高于M32,但SUT4、ClPht1;4和PAP1的表达量远低于M32,且低磷胁迫下两种杉木家系根中相关基因的表达随蔗糖添加的变化也存在一定的差异。总体上,蔗糖对杉木缺磷胁迫响应和糖代谢有重要的影响作用,低磷胁迫下添加蔗糖处理能够在一定程度上缓解杉木缺磷胁迫响应,研究结果有助于认识蔗糖参与杉木低磷胁迫响应的关键作用,也为磷高效杉木基因型的选育提供了参考。

