紫朱软膏对下肢静脉性溃疡成纤维细胞的影响及其机制研究*
杨晓,黄仁燕,李文惠,樊炜静,徐烽,闫少庆,柳国斌
(上海中医药大学附属曙光医院中医血管外科,上海 201203)
下肢静脉性溃疡(venous leg ulcer,VLUs)是下肢小腿溃疡中最常见的一种疾病,是继发于下肢慢性静脉功能不全晚期最严重和难治的并发症,常经久不愈[1],其发病率高,愈合慢且易复发[2],随着年龄的增加发病率和患病率逐渐升高[3]。VLUs的愈合是一个非常复杂的过程,需要大量炎症细胞的浸润、血管再生形成肉芽组织、成纤维细胞迁移、纤维母细胞转化成肌成纤维细胞、胶原沉积 、表皮再生。转化生长因子-β1(TGF-β1)是组织损伤修复与纤维化过程中关键的诱导因子。有效的细胞因子对于疮面愈合至关重要[4]。紫朱软膏是奚九一教授以“补虚祛瘀生肌法”为原则研制的外用药物,具有清热解毒、祛腐生肌、补气益血之功效。紫朱软膏组成药物与TGF-β1/Smad3信号通路关系已有相关的研究[5],笔者在本研究主要研究紫朱软膏与TGF-β1/Smads信号通路的关系,通过检测 TGF-β/Smads 信号通路中的关键蛋白,初步探讨此通路在VLUs愈合过程中的作用及可能机制。
1 材料与方法
1.1实验动物 成年新西兰雄性大白兔,体质量2.0~2.5 kg,上海中医药大学动物实验中心提供,实验动物生产许可证号:SCXK(沪)2009-0069。饲养环境: 室温为(23±2)℃,相对湿度为(56±10)%。以标准颗粒饲料饲养,动物自由摄食及饮水。
1.2试药 外用重组牛碱性成纤维细胞生长因子(商品名:贝复济,rb-bFGF,珠海亿胜生物制药公司,批准文号:国药准字 S10980077);α-SMA抗体(美国Sigma公司,货号:A2547),PCNA抗体(美国Novus Biologicals公司,货号:NB500-106),TGF-β1抗体(美国R&D Systems公司,货号:MAB240-100),p-Smad2、p-Smad3(广州智造软件科技有限公司,货号:9520s),Smad7(美国Sigma公司,货号:AV32008)。
1.3仪器 光学显微镜(重庆奥特光学仪器有限公司,型号:BK-FL21),荧光化学发光成像系统(上海勤翔科学仪器有限公司,型号:ChemiQ4600),数码相机(日本Canon公司,型号:5D Mark Ⅲ),酶标仪(THERMO公司,型号:MK3)。
1.4紫朱软膏制备方法
1.4.1紫朱软膏药物组成及配比 根据紫朱软膏100 kg处方量,主要药材:朱砂3.5 kg,紫草1.5 kg,龙血竭3 kg,黄芪1.5 kg,阿胶2.5 kg,冰片0.5 kg;辅料:白凡士林47.25 kg,羊毛脂15 kg,泊洛沙姆188为12 kg,聚乙二醇4000为0.5 kg,1,2-丙二醇2.5 kg,单硬脂酸甘油酯5.25 kg,对羟基苯甲酸乙酯0.03 kg,水5 kg。
1.4.2特殊药材前处理 朱砂采用200目(内径0.075 mm)水飞朱砂工业化成品;阿胶以电动粉碎机粉碎为内径0.250 mm(60目)粉末;紫草、冰片为有效成分热不稳定药材,采用气流粉碎方式处理;黄芪纤维性较强,先以8倍量75%乙醇提纯2次,再将醇提后药渣以6倍量水提取3次,得到醇提取和水提取浸膏;龙血竭制备成固体分散体以改善其在辅料中的分散性。
1.4.3软膏制剂的制备工艺方法 将上述处理好药材与水溶性基质按照优化的工艺流程混匀,制成软膏制剂。具体通过下述步骤制备:①龙血竭固体分散体的制备:龙血竭用适量90%~95%乙醇溶解完全,加入80~85 ℃熔融的泊洛沙姆188中,搅拌均匀,挥去95%乙醇,得到龙血竭固体分散物。②黄芪提取物用适量纯水混匀,阿胶加纯水,55~60 ℃下烊化,形成阿胶水溶液;并将上述两种水溶液混合均匀后加入到熔融的泊洛沙姆407中,持续搅拌均匀;另在不超过40 ℃下将冰片溶解在丙三醇中,加入到上述混合物,搅拌均匀后,再加入聚乙二醇400、聚乙二醇1500及聚乙二醇4000,混合均匀后将其加入到龙血竭的固体分散物中,持续搅拌均匀冷却至室温。③将朱砂细粉、紫草细粉加入,并加入对羟基苯甲酸乙酯,持续搅拌使其分散均匀即得。将制成的紫朱软膏加热溶解,制成紫朱软膏纱布,每日用无菌剪刀剪成与疮面大小一致的形状,消毒后备用。紫朱软膏主药与基质的比例为1:8,1 g药膏的生药质量是0.11 g。
1.5动物分组 42只新西兰雄性大白兔按照随机数字表法分为7组,每组各6只:VLUs+紫朱软膏低剂量组(a1组)、VLUs+紫朱软膏中剂量组(a2组)、VLUs+紫朱软膏高剂量组(a3组)、VLUs+生长因子组(b组)、VLUs模型组(c组)、一般溃疡组(d组)、VLUs+基质组(e组)。
1.6动物模型的制备 除d组外,其他动物制备VLUs模型。VLUs模型由静脉高压联合溃疡模型的方法建立,方法如下。①静脉高压模型:采用下肢深静脉血栓模型术建立。大白兔腹腔注射3%戊巴比妥钠 1 mL·kg-1麻醉,仰卧位,四肢固定,双侧腹股沟区备皮。左侧腹股沟区切口,分离皮下组织和浅筋膜等,分离股动脉、股静脉,分离并暴露髂-股静脉约1.0 cm。在其近、远心端用兔动脉夹夹闭此静脉,然后用无齿小蚊式钳夹闭血管,时间持续2~3 s。松开蚊式钳并进行缝合,局部皮肤常规消毒。手术后24 h,将放置的动脉夹取出。可吸收缝线逐层缝合皮下组织层和皮肤。②一般溃疡模型采用溃疡模型建立方法。在兔小腿胫前距离足尖6 cm处,定为中心点,备皮3 cm区域,再以中心点为圆心,用龙胆紫溶液做直径 1.5 cm 圆形标记。在圆形标记处做一“十“字形切口,准备一个铁氧体磁铁(直径15 mm,厚5 mm)植入皮肤下切口。接下来,用另一个磁铁夹住切割皮肤。用棉花和纱布绑扎,胶布固定,1周之后,两个磁铁被移除,夹皮自然脱落,产生溃疡。用组织剪修剪整齐。
1.7给药方法 a1,a2,a3组:用紫朱软膏药物均匀涂抹于创面,分别用1,2,3层紫朱软膏纱布,约2,4,6 g·(cm2)-1。 b组:用rb-bFGF喷洒于疮面,每次喷3次,约100 U·(cm2)-1。c、d组未给予药物,每次用两层纱布覆盖换药。e组:基质用凡士林,制作方法同紫朱软膏,制成凡士林纱布,纱布与疮面大小一致,每次用两层纱布覆盖。
1.8疮面愈合时间观察 观察各组疮面大小、颜色、分泌物、肉芽组织情况及创面随时间推移的变化。以创面完全上皮化为标准,比较各组大白兔创面面积变化情况。采用数码照相机联合医学图像分析软件计算,使用数码相机采集的图片导入计算机,选出最清晰图片,应用 Image J-ijl33-jdk15计算,溃疡创面愈合率(%)=(初始面积-观察时间点面积)/初始面积×100%。
1.9愈合评价 采取 3 级愈合评价法,分为完全愈合、部分愈合和不愈合。完全愈合为溃疡面完全愈合;部分愈合为溃疡面愈合>50%;不愈合为溃疡面愈合<50%。
1.10苏木精-伊红(HE)染色实验 将新西兰大白兔在造模成功后第1,7,21天在皮损长径边缘取材,将组织块用10%甲醛溶液固定,乙醇脱水、石蜡包埋、制作病理切片,进行HE染色,光学显微镜下观察各组疮面组织病理学变化。
1.11TGF-β1/smads 信号通路及下游调控基因关键蛋白检测 采用免疫印迹(Western blotting)技术进一步检测。观察这些调控基因表达关键蛋白(TGF-β1、p-Smad2、p-Smad3、Smad7、α-SMA)在创面组织修复过程中的分布特点。使用β- actin) 作内参。

2 结果
2.1疮面愈合评价 7组大白兔疮面愈合情况及创面愈合率对比,第7天,a2、a3 组大白兔疮面干燥,可见大片鲜红色肉芽组织形成;b组、a1组大白兔疮面轻微水肿,可见散在粉红色颗粒状肉芽组织形成;c组大白兔疮面仍严重水肿、污秽模糊,无肉芽组织形成;d组、e组大白兔疮面轻微水肿,肉芽色暗淡,周边角化明显。 第21天,a2、a3组大白兔疮面完全愈合;b、a1组大白兔疮面面积减少,基本愈合;c组大白兔疮面少量结痂,部分假性愈合。d、e组疮面周边可见少量上皮生长,疮面面积减少,见表1。

表1 7组大白兔疮面愈合率比较
2.2组织病理学变化 不同时间VLUs模型变化见图1。第1天,炎细胞开始出现,组织水肿明显,红细胞明显,组织细胞结构疏松;第7天,组织水肿开始消退,炎细胞减少,结缔组织开始增生成纤维细胞增多;第21天,组织水肿消失,炎细胞减少明显几乎消失,结缔组织增生明显。
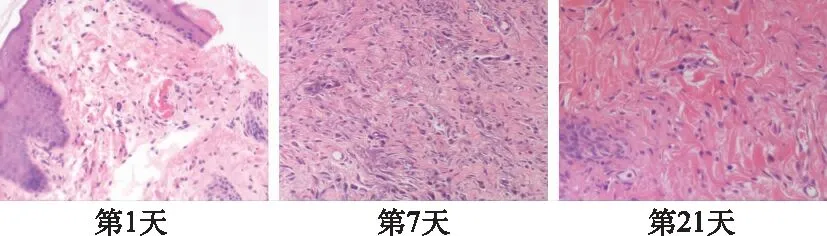
图1 不同时间VLUs模型病理图(HE,×400)
第21天HE 染色图片见图2。a1,a2,a3组细胞结构排列整齐,成纤维细胞增多明显,下肢静脉性溃疡组细胞结构排列紊乱,成纤维细胞增多不明显;成纤维细胞结构增多数量:a2组>a3组>b组>a1组>e组>d组>c组。
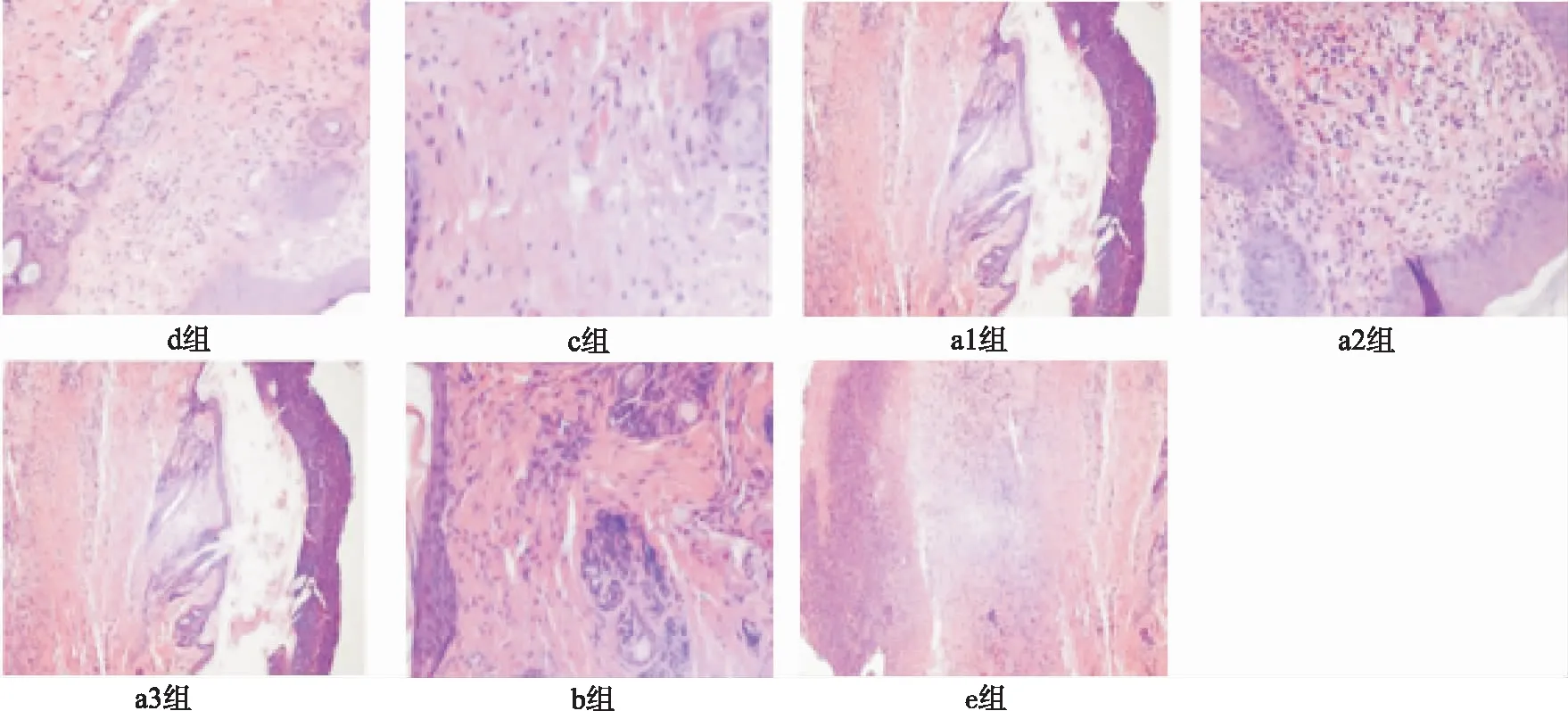
图2 7组下肢静脉性溃疡HE染色结果(×100)
2.3免疫印迹法检测结果 结果见图3。①a2组和b组CollagenⅠ、Collagen Ⅲ蛋白水平最高,d 组含量最低,与d组比较,a2组差异有统计学意义(P<0.05),与c组及e组比较,a2组差异有统计学意义(均P<0.05)。②a2组和b组PCNA、TGF-β1、p-Smad2、p-Smad3蛋白水平含量最高,d 组含量最低,与d组比较,a2组差异有统计学意义(P<0.05),与c组及e组比较,a2组差异有统计学意义(均P<0.05)。③a2组Smad7、Caspase3蛋白水平含量最低,d组含量最高,与d组比较,a2组差异有统计学意义(P<0.05)。与c组比较,a2组差异有统计学意义(均P<0.05)。④a2组和b组α-SMA蛋白水平含量最高,d组含量最低,与d组比较,a2组差异有统计学意义(P<0.05)。
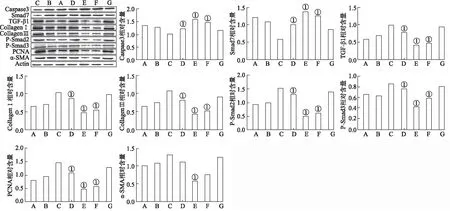
A.a1组;B.a2组;C.a3组;D.e组;E.d组;F .c组;G.b组;①与a2组比较,P<0.05。
3 讨论
VLUs是周围血管科常见的疾病,其修复过程极为复杂,涉及多种组织和修复细胞、细胞因子、生长因子和细胞外基质等调控因素的参与。修复细胞在创伤修复的过程中占核心位置。成纤维细胞贯穿创面修复过程始终,在肉芽形成、创面收缩、基质合成、伤口修复等方面均起重要作用[6],有研究表明,疮面愈合早期炎症期主要由单核、巨噬细胞和中性粒细胞等非特异免疫细胞向伤处迁移并释放多种细胞因子;中期由成纤维细胞和内皮细胞等形成肉芽组织,填补组织缺损,并由表皮细胞增殖、迁移重建皮肤屏障;后期则主要由成纤维细胞分泌并沉积基质。这些细胞行为的调控依赖于细胞因子传递信息,改变细胞因子的信息传递过程有可能干预和调控细胞的行为 。TGF-β1/Smads 通路是 TGF-β主要的信号转导途径,具有多种生物学效应,在组织修复、细胞外基质沉积和组织纤维化等方面发挥关键作用,介导创面愈合过程[7-8]。
笔者在本研究通过研究VLUs兔成纤维细胞增殖,通过形态学观察,以及Western blotting检测,紫朱软膏外用能促进下肢静脉性溃疡的愈合速度;紫朱软膏主要由朱砂、紫草、龙血竭、黄芪、阿胶、冰片六味中药组成。且这六味具有清热解毒、祛腐生肌、补气益血之功效。其中,紫草具有清热解毒、活血凉血的功效;朱砂外用有解毒生肌之功,用治疮疡肿毒,适用于溃疡久不收口;黄芪、阿胶补益气血,气血充足则为创面愈合提供有利条件。诸药合用共奏煨脓祛瘀、补虚生肌之效;紫朱软膏治疗VLUs,已经过大量临床观察,疗效确切[9]。
通过HE染色检测不同疮面组织切片中成纤维细胞的形态及变化,结果表明紫朱软膏组比其他对照组成纤维细胞结构排列整齐,成纤维细胞增多明显。成纤维细胞是创面愈合过程中的主体细胞,其生物学效应在创面修复中起着至关重要的作用,成纤维细胞所合成的胶原是细胞外基质的主要组分,胶原代谢的结果直接影响创面的修复质量[10]。紫朱软膏组成纤维细胞增多,说明外敷紫朱软膏有促进创面成纤维细胞增殖的功效。
Western blotting法检测α-SMA 、PCNA、p-Smad2 、 p-Smad3、 Smad7的蛋白水平,结果与正常对照组比较,TGF-β1处理组细胞增殖明显,α-SMA蛋白水平增加,Smad2 和Smad3蛋白磷酸化水平显著增加,Smad7蛋白水平显著降低,TGF-β和 Smads 蛋白分别是成纤维细胞的趋化因子和下游信号的关键调节蛋白,α-SMA 是成纤维细胞标记物,α-SMA 的表达量可间接反映成纤维细胞的增殖情况[11]。PCNA 属于真核细胞 DNA 复制与核苷酸剪切过程中所需要的一种辅助蛋白,可有效评价细胞增殖状态[12]。Western blotting法检测α-SMA与PCNA的含量升高明显,说明紫朱软膏外用有促进成纤维细胞增殖的作用。
TGF-β1是目前公认的与溃疡愈合密切相关的细胞因子之一,是一类多肽信号分子家族,具有调节细胞生长、分化的重要作用[13]。其中TGF-β1是上皮再生、免疫应答和造血功能的关键抑制因子,是结缔组织生长的促进因子[14],可通过自分泌、旁分泌等方式调节成纤维细胞的生长和分化,刺激成纤维细胞增殖,促进伤口再上皮化。TGF-β1/Smads通路的激活途径中,TGF-β1必须与其跨膜受体结合,才能活化下游效应分子进而激活信号传导,并通过Smads 蛋白将信号由胞质介导入胞核,调节靶基因的转录[1]。p-Smads是Smads分子的活化形式,只有发生磷酸化后才能传递 TG-β1的刺激信号。其中,Smad3的磷酸化是 TGF-β1/Smads信号通路发挥生物学作用的最关键步骤及重要标志[15],细胞内 p-Smad3蛋白表达的多少意味着TGF-β/Smads信号通路被激活以及发挥生物学效应的强弱程度[16]。
实验结果显示,紫朱软膏外用治疗VLUs,引起局部组织细胞的增殖加速,很有可能是由于局部 TGF-β1的表达增加所造成,紫朱软膏通过在蛋白表达水平激活TGF-β/Smads 信号通路,并且伴随着Smad7表达水平降低,TGF-β1、α-SMA 活化水平升高,表明紫朱软膏促进成纤维细胞的增殖可能和TGF-β/Smad3信号通路有关。
综上所述,紫朱软膏外用可有效促进VLUs兔子创面的愈合,诱导TGF-β1/Smads表达,促进成纤维细胞的增殖可能是其作用机制之一,有待通过观察多个相关蛋白、利用多种实验方法等进一步证实。

