黑曲霉对生物炭中磷释放及形态转化的影响
李涵,来张汇,吴代赦,2,吴山*
(1.南昌大学资源环境与化工学院,南昌 330031;2.南昌大学鄱阳湖环境与资源利用教育部重点实验室,南昌 330031)
生物炭是生物质在无氧或缺氧条件下,慢速热解得到的具有多孔结构、大比表面积和高度芳香化的碳质材料[1]。其具有较高的化学稳定性和吸附容量,被广泛应用于土壤改良、温室气体减排和污染土壤修复等方面[2-3]。生物炭表面含有丰富的孔隙和含氧官能团,以及较高的阳离子交换量,因而对环境污染物具有较强的吸附能力[4-5]。生物炭对污染物的吸附性能主要受其理化性质的影响,生物质原料及热解温度是影响生物炭理化性质的两个重要因素[6]。如动物粪便中不存在木质纤维素,动物粪便类生物炭含碳量明显低于植物残渣类生物炭,受有机碳含量影响,动物粪便生物炭的比表面积也低于同热解温度下的植物残渣类生物炭[7]。同时,生物炭的灰分含量、pH、电导率、碳稳定性和微量元素含量均受到热解温度的重要影响[8]。生物炭因含有较多的氮、磷、钾而被认为是一种优良的土壤改良剂[9],其中磷的缓慢释放既可以为农作物提供生物有效态的磷元素,也可以与重金属离子形成不溶性的磷酸盐矿物,钝化土壤中的重金属。
作为一种植物营养元素,磷的生物有效态含量对植物可利用度具有重要影响。然而,农业土壤中的总磷通常只有很小一部分被释放出来,导致了土壤中有效态磷含量相对不足[10]。解磷微生物是指能够将土壤中的难溶性化合态磷转化为可供植物吸收利用的可溶性磷的特殊微生物功能类群[11]。解磷微生物产生有机酸可将不溶性磷和有机磷矿化为磷酸根[12],在不增加化学磷肥的情况下提高土壤磷元素含量,极大改善了植物的磷素营养状况。同时,解磷微生物代谢产生的植酸酶、核酸酶和磷酸酶等可加速有机磷的分解[13]。解磷微生物中,解磷真菌单位时间内分泌的有机酸量大,解磷能力强于解磷细菌[14]。解磷真菌的解磷性能也更稳定,部分细菌在传代培养后会逐渐丧失解磷能力,但真菌在数代之后依然保有优秀的解磷能力[15]。
生物炭对土壤磷素养分的贡献量取决于制备生物炭的原料类型和热解温度[16]。污水污泥和水稻秸秆自身含有大量的磷,以它们为原料制备的生物炭的磷元素含量也较高[17-18]。热解温度是影响含磷化合物在生物炭中的聚合度和溶解度的决定因素,生物炭中磷的形态、晶体结构会随热解温度的升高而改变[19]。生物炭向土壤缓慢释放磷元素,可以有效减少磷肥的施用量,降低磷肥对环境造成的污染[20]。值得注意的是,生物炭中的磷主要为生物有效性较低的磷,如Al/Fe 磷酸盐和不溶性含磷矿物[21]。已有研究表明,土壤中的解磷微生物能够分泌有机酸,促进难溶性磷酸盐的溶解,它们也可能会促进生物炭中磷的释放,从而提高土壤中植物有效态磷的含量。然而,目前大部分研究主要集中于天然土壤理化条件下生物炭中磷的释放[22-24],关于解磷微生物,尤其是解磷性能更加稳定的真菌对生物炭中磷的释放及形态转化的影响仍不清楚。因此,研究解磷微生物对不同生物炭中磷的释放与形态转化的影响,对于在废弃生物质资源化利用与土壤改良领域选择性制备生物炭具有重要意义。
本研究从土壤中筛选出一株解磷真菌,分别在400 ℃和700 ℃下制备了两种生物质来源(市政污泥和水稻秸秆)的生物炭,并以生物炭为唯一磷源培养解磷真菌,测定培养过程中体系磷浓度的变化,同时分析磷的存在形态,探讨解磷微生物存在下不同生物炭中磷的释放与形态转化规律。
1 材料与方法
1.1 材料
1.1.1 土壤样品
筛选解磷真菌的土壤样品于2020 年5 月采集自南昌市红谷滩区(115°47′31″~115°47′34″E,28°39′47″~28°39′49″N),采用“S”形布点采样,采集表层0~10 cm 土壤样品,快速运回实验室后放置于冰箱4 ℃保存。
1.1.2 培养基
NBRIP 液 体 培 养 基[25]:葡 萄 糖 10.0 g,MgCl2·6H2O 5.0 g,Ca3(PO4)25.0 g,(NH4)2SO40.1 g,KCl 0.2 g,MgSO4·7H2O 0.25 g,蒸馏水1 000 mL,调 pH 为7.0~7.5,121 ℃灭菌 20 min。NBRIP 固体培养基:在NBRIP 液体培养基基础上加琼脂粉2%,121 ℃灭菌20 min。PDA 培养基:马铃薯200 g,葡萄糖20 g,琼脂18 g,蒸馏水1 000 mL。生物炭培养基:将NBRIP 液体培养基中的Ca(3PO4)2替换为生物炭,其他不变。无磷培养基:减去NBRIP 液体培养基中的Ca(3PO4)2,其他不变。
1.1.3 生物质原料
从南昌市朝阳污水处理厂收集污泥,静置30 min后,弃上清液,然后在7 000 r·min-1下离心15 min,弃上清液,收集浓缩污泥,然后在60 ℃的烘箱中干燥12 h。最后将干燥的污泥研磨后过60目筛。
将水稻秸秆洗净烘干,剪成3~4 cm 小段后用粉碎机破碎,然后将得到的秸秆粉过60目筛。
1.2 实验方法
1.2.1 解磷微生物的分离及筛选
将采集的土壤样品制成土壤悬液,稀释后涂布于NBRIP 固体培养基上培养。通过观察菌落周围是否产生透明圈初步筛选解磷微生物。将筛选所得解磷微生物的孢子悬液或菌悬液接入无菌NBRIP 液体培养基中,培养后采用钼锑抗比色法测定培养液中可溶性磷的含量。对比各菌株培养液中可溶性磷浓度的大小,筛选出高效解磷菌[26]。
1.2.2 解磷菌的鉴定
(1)解磷真菌DNA的提取
将纯菌株在PDA 培养基中活化,按照真菌基因组DNA 抽提试剂盒说明书(上海生工生物工程公司)中的步骤提取基因组DNA,产物于-20 ℃保存。
(2)解磷真菌ITS基因序列测定
本研究采用真菌鉴定通用引物[27]ITS1(TCCG⁃TAGGTGAACCTGCGG)和 ITS4(TCCTCCGCTTATT⁃GATATGC)进行PCR 扩增,扩增产物于4 ℃保存。PCR 产物经纯化后测序,用Blast 程序与NCBI 数据库中的序列进行比较分析,利用MEGA 7.0 软件进行系统发育树的构建。
1.2.3 生物炭的制备与表征
(1)生物炭的制备
分别以污泥和水稻秸秆为生物质原料,将装满污泥或秸秆粉末的坩埚放入炉中。为了使坩埚内的氧气含量降到最低,将污泥压实,并在坩埚上盖上盖子。升温速率设定为20 ℃·min-1,400 ℃(700 ℃)下停留时间设定为2 h。当加热后炉内温度低于50 ℃时,取出坩埚。待样品冷却后用去离子水冲洗生物炭,去除附着的小颗粒。洗涤后收集生物炭,用冷冻干燥机干燥,然后研磨过60 目筛并密封保存。经以上热解过程制备的污泥生物炭、水稻秸秆生物炭,分别记为SBC和RBC。
(2)生物炭的表征
采用比表面积与孔隙度分析仪(TriStar II 3020,Micromeritics Instrument Corporation,美国)对生物炭的比表面积及孔径进行测定。
1.2.4 解磷微生物的培养
将黑曲霉在PDA 培养基中预培养3 d,用0.9%的生理盐水冲洗固体培养基表面,在含玻璃珠的锥形瓶中充分振荡30 min,将霉菌的菌丝体打散,释放出成熟孢子,最后用4 层无菌纱布过滤掉菌丝体。用血细胞计数板调节菌液浓度为1×106cfu·mL-1。将2 mL的接种物转移到250 mL 以生物炭为唯一磷源的生物炭培养基中,在(25±3)℃、150 r·min-1的摇床上培养,以不加黑曲霉孢子作为对照,每组重复3次。
以8 d 为一个周期,在第一个周期内每日取样10 mL,之后的每个周期,在最后一日取样10 mL。取样后需重新添加无磷培养基,先停止振荡,让锥形瓶中的混合物沉淀30 min 以分离培养悬浮液和生物炭,然后将上层200 mL 含黑曲霉的培养液替换为200 mL 无磷培养基。新补充的培养基在振荡器中继续培养8 d,然后再次更换培养基。一共更换3 次培养基。由于污泥生物炭释放的磷主要为正磷酸盐、焦磷酸盐和微生物磷[28],同时解磷微生物可通过分泌有机酸和释放磷酸酶等方式将不溶性磷和有机磷矿化为可溶性无机磷[12-13]。因此,本研究只考虑了正磷酸盐、焦磷酸盐和微生物磷3 种形态。将10 mL 样品分为A、B 两个子样品,A 样品用于测定总磷。B 样品过 0.22 μm 滤膜,分为样品 B1、B2 和 B3,样品B1 和B2 分别用于测定总溶解磷和正磷,样品B3 测定pH。
1.2.5 磷的浓度与形态的测定方法
样品A用过硫酸钾消解后,采用钼酸铵分光光度法测定总磷。样品B1 在过滤后用过硫酸钾消解,再采用钼酸铵分光光度法测定磷含量,即可得到总溶解磷含量。样品B2 在同样品B1 的方法中省去过硫酸钾消解样品的步骤即测得正磷酸盐含量。培养基中焦磷酸盐和微生物中磷的含量可由上述所测的数据计算得到[28],焦磷酸盐的含量是总溶解磷与正磷酸盐含量之差,而微生物中的磷是总磷与总溶解磷含量之差。对照组中不含微生物,因此只需测定总磷与正磷酸盐含量,释放的焦磷酸盐含量即为总磷与正磷酸盐含量的差值。
2 结果与分析
2.1 解磷微生物的筛选与鉴定
利用NBRIP 固体培养基平板分离,获得4株能产生解磷圈的微生物,包括1 株真菌和3 株细菌。将这4 种微生物分别在无机磷液体培养基中培养7 d 后,测定培养液中的可溶性磷浓度,结果表明其中真菌的解磷能力较强,达到586.0 mg·L-1,远高于其他3 株解磷细菌(解磷能力仅为22.6、14.9、34.0 mg·L-1)。将该真菌菌株命名为PSF-1,对其进行进一步的分子鉴定和解磷特性研究。
用Blast 程序将菌株PSF-1 基因序列与NCBI 数据库中的序列进行比较分析,结果显示,PSF-1 的ITS序列与黑曲霉(Aspergillus niger)的序列具有高度同源性,相似度高达99%。利用MEGA 7.0 进行系统发育树的构建(图1),根据形态观察和ITS 序列对比,鉴定PSF-1为黑曲霉。
2.2 生物炭的比表面积
由表 1 可知,BC700 的比表面积比 BC400 高,而两种生物炭的平均孔径受热解温度影响不同。两种生物炭中,秸秆生物炭比表面积更大,平均孔径远低于污泥生物炭。总孔体积则是污泥生物炭高于秸秆生物炭,BC700 高于BC400。这表明随着热解温度升高,生物质中微孔孔道拓宽,变为中孔甚至大孔。
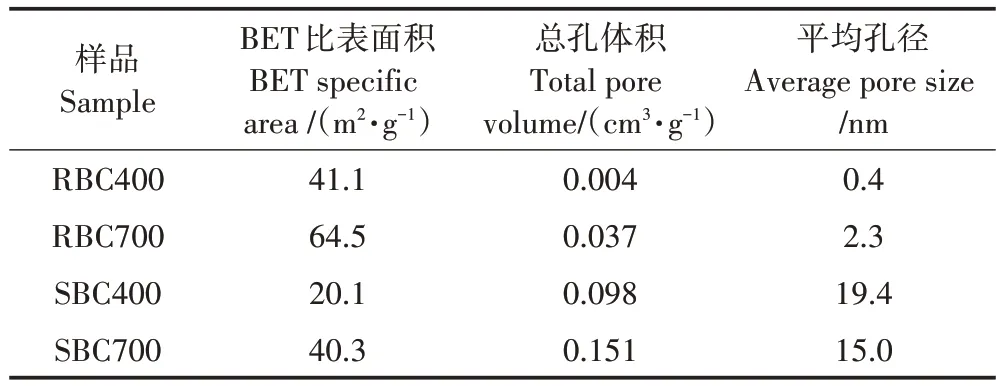
表1 生物炭的孔结构参数Table 1 Parameters of pore structure in biochar
2.3 黑曲霉存在下生物炭释磷过程中体系pH的变化
4 种生物炭培养基中,RBC700 培养基初始状态下呈碱性,其他3 种培养基则为弱酸性。在培养过程中,黑曲霉存在下4 种生物炭培养体系的pH 均大幅下降(图2)。第一个周期内,4 种培养基的pH 均在第6 d 时达到最低。第二个培养周期末的pH 较第一周期末小幅度下降,后续两个培养周期末的pH 则保持稳定。最后一个培养周期末的4种培养基中,SBC400培养基的pH 最高,为(1.74±0.02);RBC700 培养基的pH 最低,为(1.48±0.01)。上述pH 的变化说明,在第一个周期内黑曲霉释放大量有机酸,随着葡萄糖的不断消耗,黑曲霉释放有机酸的速度降低,在更换培养基补充葡萄糖和其他营养物质后,黑曲霉能继续释放有机酸。因为更换的是无磷培养基,体系中的磷并没有得到补充,黑曲霉新陈代谢受到限制,体系pH趋于稳定。
2.4 生物炭培养基中总磷释放量
随着培养时间的延长,4 种生物炭释放的总磷量逐渐增加。对比没有黑曲霉的空白实验发现,4 种生物炭培养基在黑曲霉存在下均显著提高了总磷释放量(P<0.05)(图3)。无黑曲霉存在时,BC400 释放的总磷量高于BC700,在同一热解温度下的两种生物炭中秸秆生物炭释放的总磷量显著高于污泥生物炭(P<0.05)。黑曲霉存在下,污泥生物炭的磷释放量则明显高于秸秆生物炭(P<0.05),SBC700 在黑曲霉的作用下磷释放量可达(78.55±1.06)mg·g-1,远高于RBC700 的(3.64±0.05)mg·g-1。黑曲霉作用下,SBC700 的 磷 释 放 量 显 著 高 于 SBC400(P<0.05),SBC700 在32 d 时的总磷释放量比SBC400 高46.0%。而黑曲霉存在时热解温度对秸秆生物炭的影响不显著,32 d 时 RBC700 总磷释放量比 RBC400 仅高出5.23%。
2.5 黑曲霉存在下生物炭中磷的形态转化
为了解黑曲霉存在下生物炭中磷的形态转化,本研究测定了黑曲霉培养过程中SBC400释放的不同形态的磷含量。研究结果表明,无黑曲霉存在时,SBC400 释放的磷主要为焦磷酸,正磷酸所占比例小于20%(图4a)。在黑曲霉存在下,SBC400 释放的磷主要为正磷酸(图4b),培养1 d 时,SBC400 体系中正磷酸占总磷的44.9%,培养2 d 时正磷酸占总磷的88.3%,培养32 d 后体系中正磷酸比例达到了97.2%;焦磷酸盐含量在培养过程中先升高后降低,在第7 d时达到最高值(1.78±0.96)mg·g-1,然后在第8 d 时降低至(0.01±1.00)mg·g-1,后续两个周期焦磷酸盐含量小幅度回升。整个培养周期中,黑曲霉存在体系中焦磷酸盐的含量显著少于空白实验(P<0.05),这可能是因为黑曲霉将体系中的焦磷酸盐吸收转化;微生物磷一直小幅度增长,说明有一部分的焦磷酸盐被黑曲霉利用于自身的生长繁殖。
3 讨论
本研究从土壤中筛选出一株高效解磷菌株PSF-1,鉴定为黑曲霉(Aspergillus niger)。黑曲霉是一种解磷能力较强的溶磷菌株,在培养过程中,随着黑曲霉菌丝的生长,其对不溶性磷酸盐的溶解能力增强[29]。PSF-1 的解磷能力较强,以磷酸钙为唯一磷源培养7 d 后培养基中的磷浓度可达到586 mg·L-1,与其他研究筛选得到的黑曲霉解磷能力相近。胡南等[30]从尾矿淤泥中筛选出的黑曲霉在以磷矿粉为唯一磷源培养22 d 后,培养基中的磷浓度可达到242 mg·L-1。在另一项研究中,孙冉等[31]通过单孢株筛选得到解磷能力较强的黑曲霉,其在液体培养基中的解磷能力在第4 d达到平稳,为617 mg·L-1。
生物炭的原料类型及热解温度决定其孔隙结构、表面官能团等性质,这些性质影响着生物炭在微生物活动及土壤物质交换中的作用[32]。本研究中,BC700比BC400 的比表面积更大(表1),使其可以充分地与微生物接触,从而释放出更多的磷。此外,当生物炭施用于土壤时,其多孔性和吸附性可以使土壤中的磷在得到保存的同时缓慢释放,避免磷被生物利用而快速消耗。
无黑曲霉存在下,秸秆生物炭的磷释放量高于污泥生物炭,BC400磷释放量高于BC700(图3),这可能是因为BC400 中磷的聚合度较低[28],更容易释放。而黑曲霉作用下,污泥生物炭磷释放量高于秸秆生物炭,BC700 磷释放量高于BC400。通常,磷含量较高的生物质制备的生物炭含磷量也较高,因此使用污泥、猪粪[20]等磷含量较高的原料制备的生物炭改良剂可以有效补充土壤中的磷元素。从实验结果看,热解温度对污泥生物炭中磷的释放有较大影响,但对秸秆生物炭的释磷效应影响较小,总体上,在黑曲霉作用下热解温度高的生物炭能释放出更多的磷。有研究表明,700 ℃热解制备的污泥生物炭释放出的磷最多,因其含有较多的FePO4和AlPO4等酸溶性磷酸盐,而更高热解温度制备的污泥生物炭中会产生既不溶于水也不溶于稀酸的Fe2P,导致生物炭中磷的释放量下降[17]。
通常生物炭中的磷大部分不能直接释放到环境中,但是这些磷可能会被解磷微生物转化利用。在复杂的土壤环境中,解磷微生物分泌的有机酸在生物炭表面为磷的释放创造了一个酸性微环境[19]。解磷微生物可以通过分泌低分子量有机酸溶解无机磷,通过释放磷酸酶、植酸酶等分解有机磷[33-34]。已有研究表明,在解磷微生物的多种解磷机制中,有机酸的溶解占主导作用,解磷微生物在培养过程中会产生草酸、柠檬酸等多种有机酸,有机酸阴离子与磷酸盐矿物中的磷酸根发生离子交换,从而释放出磷[35]。与对照实验相比,本研究中含有黑曲霉的4 种生物炭培养体系pH 均大幅下降,说明黑曲霉在培养过程中产生了有机酸,这可能是葡萄糖氧化过程中产生的葡萄糖酸向培养物中释放H+,使得体系pH下降[36]。因此,黑曲霉分泌的有机酸与生物炭表面的(焦)磷酸根之间的阴离子交换作用,可能是其促进生物炭中磷释放的主要机制。
对于磷的存在形态,本研究发现无黑曲霉存在时SBC400 释放的磷主要为焦磷酸,黑曲霉存在下SBC400 释放的磷主要为正磷酸(图4)。焦磷酸和土壤中有机磷(如植酸)的磷酸基团的键合方式相似[28],因此解磷微生物分泌的磷酸酶也可能参与焦磷酸盐的水解,将焦磷酸转化为正磷酸。同时,微生物磷一直小幅度增长,表明一部分磷作为营养元素被用于黑曲霉的生长繁殖。有研究表明,解磷微生物能吸取环境中的磷并将其转化为有机磷和聚磷酸盐储存在细胞中[37],然后通过降解聚磷酸盐释放正磷酸盐。在磷的各种形态中,正磷酸盐的生物有效性最高[38],因而黑曲霉将各种不溶性的磷转化为正磷酸盐,这可以提高土壤中磷的生物有效性,有利于土壤中植物的生长。
4 结论
(1)从土壤中筛选得到一株具有解磷能力的黑曲霉(Aspergillus niger),并成功鉴定与培养。
(2)污泥生物炭比秸杆生物炭释放出更多的磷,表明磷含量较高的生物质所制备的生物炭中可释放的磷含量也较高;同时,较高的生物质热解温度有利于生物炭中磷的释放。
(3)黑曲霉可以促进生物质炭中磷的释放,促进焦磷酸盐转化为正磷酸盐,提高生物质炭有效态磷的含量。

