EM菌对中华绒鳌蟹抗氧化性能及非特异性免疫的影响
储兰璐,高建操,宋黎黎,孙 毅,邵乃麟,李全杰,聂志娟,徐钢春,,徐 跑,
(1.上海海洋大学水产与生命学院,上海 201306;2.中国水产科学研究院淡水渔业研究中心,江苏无锡 214081)
中华绒螯蟹(Eriocheirsinensis)俗称河蟹、大闸蟹,是我国最重要的淡水甲壳类养殖品种之一。然而,在集约化人工养殖模式发展的过程中,多次爆发由细菌、病毒、立克次体等引起的多种疾病,导致惨重的经济损失,严重威胁河蟹养殖业的健康发展。河蟹完全依靠先天免疫防御病原体[1],其先天免疫系统由细胞免疫和体液免疫组成[2],其中细胞免疫包括包囊、吞噬作用和结节形成,而体液免疫包括蛋白水解级联反应、抗菌肽(AMPs)合成和酚氧化酶激活系统(proPO系统);在河蟹抗感染免疫中细胞免疫与体液免疫相辅相成,共同发挥免疫作用[3]。河蟹的免疫系统在抵抗外源性病原体或污染物时会产生大量的活性氧(ROS),过量的ROS会导致机体的氧化损伤。抗氧化酶系统能够消除机体内过量的ROS,防止或减轻机体的氧化损伤。同先天免疫一样,抗氧化酶系统在维持河蟹的机体健康中也发挥着重要作用[4]。
河蟹肝胰腺是先天免疫反应的重要器官,可以合成和分解许多参与免疫防御的蛋白质[5],如NF-κB通路成分、抗菌肽和抗氧化酶等。Toll样受体作为一种模式识别受体,能直接识别病原相关分子模式。当Toll信号通路被革兰氏阳性细菌或真菌激活时,Toll受体蛋白活化,通过Tube蛋白,使MyD88和Pelle结合成异源三聚体复合物,然后将信号传递给Dorsal/Cactus复合物,Dorsal(NF-κB转录因子)通过磷酸化转移到细胞核,调控某些抗菌肽基因的表达[6]。作为细胞内蛋白成熟过程中的分子伴侣,Hsp90通过调节其受体蛋白的活性与维持受体蛋白结构的稳定间接参与细胞内多条信号通路的调控[7]。
近年来微生态制剂类因其安全、高效、无污染的特点成为水产健康养殖研究的热点。其中, EM菌作为一种益生菌制剂最初被广泛应用于农作物、蔬菜的种植和畜牧的养殖中,是一种以乳酸菌、酵母菌、光合细菌、放线菌和发酵真菌通过发酵工艺培养的复合菌剂,其主要利用有益微生物之间的协同作用,通过竞争排斥抑制病原菌和有害细菌的生长,从而使得有益菌占优势[8]。据报道,日粮添加EM菌不仅可以优化哺乳动物消化道中细菌菌群的组成,通过调控宿主基因表达提高饲料利用率,促进宿主生长发育,还能够激活细胞介导的体液免疫反应[9],提高其免疫力。在水产养殖中,EM菌能够改良养殖水质,显著提高水体中藻类和轮虫密度,促进皱纹盘鲍(Haliotisdiscushannai)、刺参(Apostichopusjaponicusare)、尼罗罗非鱼(Oreochromisniloticus)和淇河鲫(Carassiusauratus)等生长及增强抗病能力[10]。
目前,EM菌对河蟹养殖影响的研究主要集中在养殖水质的改良和河蟹的营养风味上[11],在对河蟹免疫力影响方面仍是空白。本研究以河蟹为试验对象,在养殖过程中定期使用EM菌,从血液细胞学、基因表达和酶活等多层面评估EM菌对河蟹抗氧化能力和非特异性免疫力的影响,以期为EM菌的科学使用提供理论依据。
1 材料与方法
1.1 实验材料
实验用河蟹苗种购自江苏诺亚方舟农业科技有限公司。养殖池塘位于中国水产科学研究院淡水渔业研究中心扬中基地,长×宽=75 m×23 m,水深0.5~1.0 m。实验用蟹初始体重为(27.78±1.44) g。饲养期间水温14.0~32.8 ℃,溶解氧>2 mg/L,氨氮<0.025 mg/L,亚硝酸盐<0.004 mg/L,pH7.8~9.0。
EM菌购自江苏恒泰环保科技发展有限公司,pH3.0~4.0,乳酸菌数1.0×107~1.0×108CFU/mL,酵母菌数1.0×104~1.0×105CFU/mL,光合菌数1.0×103~2.0×103CFU/mL,放线菌数1.0×103~3.0×103CFU/mL,菌种数>80种,代谢产物>10%。
1.2 实验分组
挑选个体大小均匀、附肢完整的健康扣蟹随机分为实验组(EM菌组)和对照组,每组3个池塘重复,每个池塘放养1 100只扣蟹;EM菌组池塘在常规管理的基础上每7 d使用一次EM菌,每666.67 m2水体使用7 500 g EM菌;对照组按常规管理。
1.3 样品采集
采样时间点处于河蟹蜕壳间期,共进行5次采样,依次为4月15日(1壳)、6月3日(2壳)、7月19日(3壳)、8月27日(4壳)、10月21日(5壳)。每个采样时间点从每个池塘中用地笼捕捞6只雄蟹,于冰上麻醉后采样。取河蟹第3步足基关节膜处血淋巴,4 ℃静置过夜,4 ℃ 12 000 r/min离心10 min,收集上清液(血清)用于血清抗氧化和免疫酶活的测定;取5壳蟹肝素抗凝血,用于各类血细胞数量的测定;采集肝胰腺,液氮冻存运回实验室后,于-80 ℃冰箱保存。
1.4 抗氧化酶系统指标检测
血清的超氧化物歧化酶(SOD)活力、过氧化氢酶(CAT)活力、丙二醛(MDA)含量、谷胱甘肽过氧化物酶(GSH-PX)活力均采用南京建成生物工程研究所的试剂盒进行测定,货号依次为:A001-3-2、A007-1-1、A003-1-2和A005-1-2。
1.5 非特异性免疫力检测
1.5.1 血细胞组成
取5壳河蟹的抗凝血,用瑞氏-姬姆萨染色法制作血涂片,油镜下随机选取视野共计200个细胞进行观察,进行透明细胞(HC)、半颗粒细胞(SGC)和颗粒细胞(GC)的分类鉴定和计数[12]。
1.5.2 相关基因的表达量分析
肝胰腺RNA使用离心柱法(TaKaRa)提取,cDNA合成使用PrimeScriptTM 1st Strand cDNA Synthesis Kit(TaKaRa)试剂盒进行。河蟹内参基因β-actin、Gapdh和免疫相关基因引物序列见表1。qRT-PCR分析使用TB GreenTM Fast qPCR Mix(TaKaRa)在CFX96(Bio-rad)上进行。qRT-PCR程序为:95 ℃ 5 s,60 ℃ 30 s,循环数为40。用2-ΔΔCT方法计算各基因的相对表达量。

表1 中华绒螯蟹免疫相关基因荧光定量引物
1.5.3 免疫相关酶活的测定
血清中谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)含量采用全自动血清生化分析仪(Mindray BS-400)测定,所用试剂盒购自深圳迈瑞生物医疗电子股份有限公司。溶菌酶(LZM)活力采用南京建成生物工程研究所的试剂盒(货号A050-1-1)进行测定。
1.6 数据统计与分析
采用SPSS 26.0(IBM Inc.,Chicago,IL,USA)软件进行。数据的正态性和方差齐性分别采用Shapiro-Wilk和Levene(α=0.05)方法进行,对不符合上述要求的数据进行数据转换;随后基于全因子模型进行双因素方差分析,主效应之间的差异分析选用LSD方法;P<0.05表示差异显著,统计结果以平均值±标准差(means±SD)表示。
2 结果
2.1 EM菌对中华绒螯蟹血清抗氧化酶系统的影响
不同处理组河蟹血清抗氧化指标见表2。分析发现EM菌对不同发育阶段河蟹的MDA和CAT有不同的影响。与对照组相比,EM菌在河蟹生长过程中能够降低MDA含量,尤其在1壳和3壳时期,EM菌组的MDA含量显著低于对照组;对照组MDA含量表现为先降低后升高的变化趋势,3壳时对照组血清中MDA含量显著低于1壳、4壳和5壳;EM菌组血清中MDA含量的变化与对照组相似,3壳时血清中MDA含量显著低于其他各生长阶段。5壳时,EM菌能显著提高河蟹血清中CAT活力;在河蟹的生长过程中对照组血清中CAT活力保持相对稳定的状态,但EM菌组血清中CAT呈现先降低后升高的变化趋势,4壳时达到最低值。
表2 EM菌对中华绒螯蟹血清抗氧化指标的影响
对照组SOD活力呈现逐步降低的变化趋势,5壳时SOD活力显著低于生长初期(1~3壳);EM菌组变化趋势与对照组一致,且在生长的各个时期均能提高SOD活力但与对照组之间无显著差异。EM菌对中华绒螯蟹血清中GPX活力无明显作用,在各生长时期,EM菌组与对照组之间无显著差异。
2.2 EM菌对河蟹非特异性免疫的影响
2.2.1 EM菌对中华绒螯蟹血细胞组成的影响
图1可知透明细胞(HC)为圆形,经瑞氏-姬姆萨染色后,细胞质呈淡紫色,细胞核呈紫色;半颗粒细胞(SGC)为卵圆形,经染色后,细胞质中的小颗粒呈现紫色或蓝色,细胞核呈深紫色。颗粒细胞(GC)多呈椭圆形或圆形,细胞质中含有大量具有折光性的颗粒,被染为紫色或蓝色。由图2可以看出HC在三种细胞类型中占比较低,对照组HC占20.96%±1.35%,EM菌组占19.40%±0.21%;对照组SGC占54.96%±3.00%,且EM菌组SGC含量比对照组高2.97个百分点;对照组GC占24.08%±1.69%,EM菌组占22.67%±0.10%。
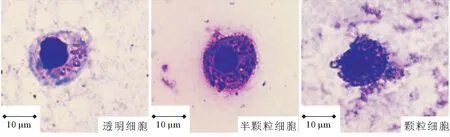
图1 中华绒螯蟹不同血细胞类型
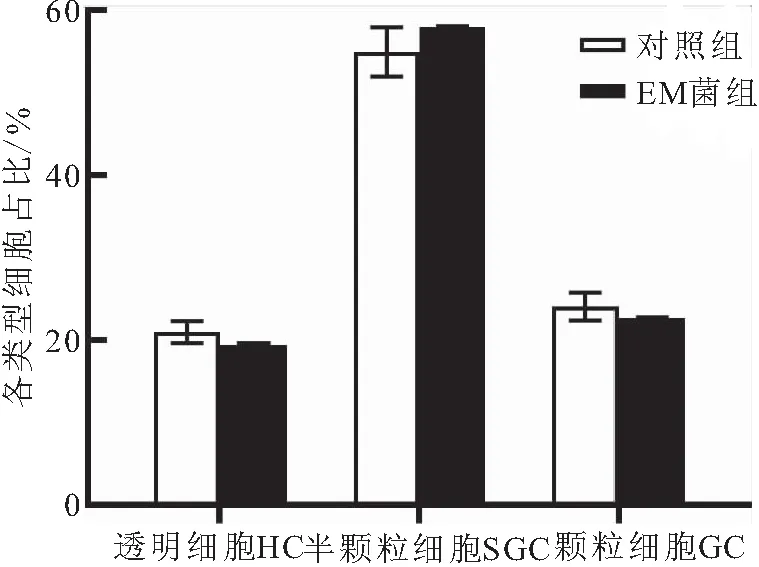
图2 EM菌对中华绒螯蟹血细胞组成的影响
2.2.2 EM菌对河蟹肝胰腺免疫相关基因表达的影响
不同处理河蟹肝胰腺免疫相关基因表达情况见表3。分析发现交互作用“处理×发育阶段”显著影响河蟹免疫相关基因Tube、Hsp90、Dorsal相对表达量,即不同发育阶段河蟹免疫相关基因Tube、Hsp90、Dorsal相对表达量对EM菌的响应程度不同。在河蟹生长的各个阶段,EM菌组Toll2和Tube的表达量均高于对照组,2壳时EM菌组Tube的表达量显著上调;在河蟹的生长发育过程中,Tube、Toll2表达量呈现逐步上升的趋势,5壳时表达量最高,显著高于1~3壳生长阶段。
表3 EM菌对中华绒螯蟹肝胰腺免疫相关基因表达的影响
在河蟹生长的过程中,EM菌能上调Dorsal的表达,且在4壳时与对照组之间差异显著;与对照组相比,EM菌组Dorsal的表达量相对稳定,各生长阶段差异不显著。EM菌同样能够上调河蟹生长过程中Hsp90的表达,2壳和3壳时EM菌组Hsp90的表达量显著高于对照组。
2.2.3 EM菌对中华绒螯蟹血清免疫指标的影响
不同处理组河蟹血清免疫指标见表4。分析发现交互作用“处理×发育阶段”显著影响河蟹免疫酶ALT、AST、ALP、LZM活性,即不同发育阶段河蟹血清的ALT、AST、ALP、LZM活性对EM菌的响应程度不同。5壳时EM菌组血清ALT活力显著低于对照组;对照组ALT呈现逐步升高的变化趋势,5壳时血清中ALT含量显著高于其他生长时期;EM菌组变化趋势与对照组一致,但在河蟹生长的各个时期,EM菌组血清中ALT含量均低于对照组,且在5壳时差异显著。对照组AST活力呈现出逐步上升的趋势,5壳时AST活力高于其他生长时期;EM菌组变化趋势与其一致,且在1壳时河蟹血清中AST活力显著低于对照组。EM菌组血清中ALP活力呈现出先降低后升高的变化趋势,3壳时ALP活力达到最低值,显著低于其他生长时期;除2壳外,其他生长阶段,河蟹血清中ALP活力均高于对照组,且在1壳时两组之间差异显著。2壳时,与对照组相比,EM菌显著提高血清中溶菌酶含量;河蟹对照组和EM菌组血清中溶菌酶含量波动较大,1壳和3壳时溶菌酶含量高于其他生长时期。
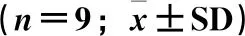
表4 EM菌对中华绒螯蟹血清免疫指标的影响
3 讨论
3.1 EM菌对中华绒螯蟹血清抗氧化酶系统的影响
SOD和CAT是两种重要的抗氧化酶,酶活力与机体清除自由基的能力正相关[19]。GPX有助于将过氧化物转化为毒性较低的羟基化合物,可有效防止活性氧的积累,维持细胞内氧化还原的稳态[20]。MDA是脂质过氧化的毒性产物,它的含量间接反映了机体细胞的氧化损伤程度[21]。徐贵珠[22]发现饲料中添加壳寡糖和茶多糖能提高河蟹血清中CAT和SOD活性,同时降低MDA的含量。与之类似,本研究发现EM菌组MDA含量低于对照组,其中3壳时差异达到显著水平,分析原因是河蟹于7月进行3壳采样,此时气温较高,在高温下养殖水体稳定性下降,残饵、粪便、腐败的水草等容易诱导河蟹产生氧化应激。热应激下河蟹MDA含量随应激时间而逐步增加,进而导致自由基代谢紊乱,病害发生[23],而本实验中EM菌的添加能显著降低MDA含量,表明EM菌对缓解或者抑制河蟹夏季高温天气时应激损伤有一定效果。5壳时河蟹有上岸的习性,该阶段河蟹常处于空气暴露等缺氧环境下。而在缺氧条件下,虾蟹类能够调整体内抗氧化酶活性以适应不利的环境,降低氧化应激的发生[24-27]。因此,本研究中EM菌组5壳河蟹血清中CAT活性显著升高,再次印证了EM菌有助于河蟹缓解或者抑制不利条件下的应激损伤。
3.2 EM菌对中华绒螯蟹血细胞组成的影响
血细胞在河蟹的非特异性防御中主要具有吞噬、包囊的作用,能有效杀死细菌,在河蟹血细胞类群中,半颗粒细胞能伸出伪足,具有较强的吞噬活动能力,是防御反应的关键细胞[28]。本研究结果表明,半颗粒细胞是河蟹血细胞的主要类群,占总血细胞数的50%以上,且EM菌组SGC含量比对照组高2.97个百分点,这一结果与洪宇航等[29]的结果一致。已有研究结果表明EM菌能够降低水体中亚硝酸盐和氨氮含量[11],维持良好的水体环境,水体中病原微生物变少,河蟹血细胞吞噬活动频率较低,半颗粒细胞数量略高于对照组。
3.3 EM菌对河蟹肝胰腺免疫相关基因表达的影响
河蟹主要通过模式识别蛋白识别病原体,引起胞内信号级联反应,通过下游的信号通路激活NF-κB,进入细胞核调节抗菌肽等免疫因子基因的表达,从而启动先天免疫[30,31]。Toll信号通路是河蟹主要的先天免疫信号通路之一,Toll2、Tube和Dorsal均为该通路中的重要组件[16,32]。研究表明,Toll通路相关基因表达的上调与机体非特异性免疫能力提高有关。张盛静等[33]发现在饲料中添加地衣芽孢杆菌可一定程度上提高Toll受体的相对表达量,有效提高凡纳滨对虾(Litopenaeusvannamei)抗哈维氏弧菌(Vibrioharveyi)感染的能力。本研究中,EM菌组雄蟹的Toll2、Tube、Dorsal相对表达量均显著高于对照组,表明EM菌在一定程度上能提高机体对异物的识别能力,进而实现免疫机能的提高。Toll2和Tube表达量在5壳时最高,表明5壳时河蟹上岸后,识别外源病原体的能力最强。3壳时,河蟹Dorsal的表达量则低于其他各生长时期,表明高温季节下,Toll信号通路受到一定的抑制,但EM菌能在一定程度上缓解高温对河蟹免疫力的影响。本实验中添加EM菌能提高河蟹2壳LZM活性和5壳CAT活力,降低3壳MDA含量和5壳ALT活性,综合以上结果说明LZM、CAT、MDA、ALT、TubemRNA、DorsalmRNA有一定的相关性,这与文英等[34]认为Toll通路能提高抗氧化酶类及免疫酶类的活性,清除过多的氧自由基 的结果一致。HSP90是一种热休克蛋白,机体在应激原的诱导下,激活热休克蛋白基因,合成HSPs,HSPs能使动物迅速适应环境的变化,保护细胞免受损伤,其可诱导激活多种免疫因子,参与免疫反应[35]。研究表明高温应激下虾蟹类HSP90 mRNA的相对表达量显著提升,提升甲壳动物的耐受性,抵抗高温带来的应激损害,对机体起保护作用[36]。此外,研究表明HSP90除了与机体免疫相关,在应激原的诱导下,参与机体的炎症反应过程,使动物迅速适应环境的变化,缓解氧化应激带来的组织损伤,保护细胞免受损伤[36,37]。本研究中,EM菌的添加显著提高了2壳时血清中溶菌酶活性,降低了3壳时MDA含量,同时2壳时EM菌组雄蟹HSP90的表达量显著上升,推测HSP90与河蟹的细胞免疫和抗氧化酶系统有关联。本研究发现2壳、3壳阶段河蟹肝胰腺HSP90的表达量显著高于其他发育阶段,同时EM菌组3壳雄蟹HSP90基因的相对表达量显著高于对照组,提示EM菌可能通过诱导HSP90表达的上调,对机体在高温条件下的应激损伤有一定的防御作用。
3.4 EM菌对中华绒螯蟹血清免疫指标的影响
由于河蟹体内缺乏免疫球蛋白,因此其体液免疫主要依靠血淋巴中一些非特异性的酶或因子来进行免疫反应。AST和ALT是重要的氨基转移酶,在机体蛋白质代谢过程中发挥重要作用,其血清中含量与机体肝脏等器官损伤负相关[38]。LZM是一种碱性蛋白,能水解革兰氏阳性细菌细胞壁,破坏和消除侵入体内的异物,血清中较高的LZM活性表明机体的免疫能力较强。ALP是溶酶体的组成成分之一,直接参与磷酸基团的转移与磷酸酯的代谢,促进体内异物的清除,是动物体内重要的解毒酶。Mohammadian等[39]发现益生菌的添加能提高鲤血清溶菌酶、碱性磷酸酶活性。本研究也发现水体添加EM菌后2壳时雄蟹ALP活性和LZM活性显著高于对照组;EM菌组5壳雄蟹血清ALT和1壳雄蟹AST含量显著低于对照组;以上结果表明EM菌组河蟹具有较强的免疫解毒能力和较低的器官损伤水平。
4 结论
总体来说,在水体中添加EM菌有助于提高中华绒螯蟹抵抗氧化应激的能力,也可通过调控河蟹免疫基因的表达和相关酶活性,增强其非特异性免疫力。然而,成蟹养殖周期较长,不同发育阶段处于不同的季节,外界环境条件(如温度、光照等)对养蟹池塘生态系统的影响较大,相比之下EM菌的调控作用微弱,所以不同发育阶段河蟹的抗氧化和先天免疫对EM菌的响应存在差异。因此,如何科学合理地使用EM菌,最大程度发挥EM菌的作用,还需要进一步的研究。

