碳酸镧联合西那卡塞、骨化三醇对维持性血液透析伴SHPT患者iPTH、Ca、P水平的影响
姜飒,祝明伟,刘香云
(1.南阳南石医院肾内科,河南 南阳 473000;2.南阳南石医院血液净化室,河南 南阳 473000)
维持性血液透析(MHD)技术的进步有效延长了终末期肾病患者的生存期,但MHD 治疗引起的并发症也明显增多,其中继发性甲状旁腺功能亢进症(SHPT)在MHD患者中发病率超过50%[1]。SHPT 可导致体内钙磷代谢异常,增加预后不良风险[2]。SHPT的主要干预手段包括药物治疗与手术治疗,但具备手术条件的患者较少,药物治疗成为临床首选。由于目前临床治疗SHPT的药物种类较多,具体药物治疗方案的选择成为国内外研究关注的热点。本研究回顾性分析我院2018年4 月-2021年4 月收治的93例MHD 合并SHPT患者资料,探讨联合用药在MHD 合并SHPT 治疗中的价值,报告如下。
1 资料与方法
1.1 一般资料 回顾性分析我院2018年4 月-2021年4 月93例MHD 合并SHPT患者资料。纳入标准:⑴年龄≥18 岁;⑵规律透析时间≥12 个月,每周透析2~3 次;⑶全段甲状旁腺素(iPTH)≥300ng/L;⑷首次诊断SHPT,未接受过维生素D受体激动剂或拟钙剂等药物治疗;排除标准:⑴有原发性甲状旁腺功能亢进病史;⑵合并其他甲状旁腺疾病,或有甲状旁腺手术治疗史;⑶合并严重心、肝功能不全;⑷合并恶性肿瘤;⑸合并胃溃疡、肠梗阻等消化系统疾病;⑹对本研究所用药物过敏者。按照药物治疗方案,其中单纯应用骨化三醇的患者21例为A 组,应用西那卡塞+骨化三醇的患者29例为B 组,应用碳酸镧+西那卡塞+骨化三醇的患者43例为C 组。三组一般资料差异无统计学意义(P>0.05),见表1。

表1 两组一般资料比较
1.2 方法 所有患者均采用金宝公司产生的血液透析仪进行MHD 治疗,治疗参数:超滤量1500~4800ml,血流量200~250ml/min。治疗期间均要求低磷饮食。三组均给予以下药物治疗,A 组:给予骨化三醇(上海罗氏制药公司生产,国药准字:H2014 0597),剂量0.25ug/d,睡前口服,每4 周调整剂量,最大剂量0.5μg/d。B 组:在A 组基础上,同时加服盐酸西那卡塞(协和发酵麒麟制药公司生产,国药准字J20140122),剂量25mg/d,晚餐后口服,每4周调整剂量,最大剂量75mg/d。C 组:在B 组基础,同时加服碳酸镧(英国Hamol Limited 生产,国药准字H20171351),剂量:血磷≥2.26mmol/L 者每次500mg,血磷<2.26mmol/L 者每次250mg,3 次/d,餐中嚼服,服用4 周后调整剂量,血磷>1.78mmol/L者调整为每次250mg/次;1.13~1.78mmol/L 者维持原剂量;<1.13mmol/L 者调整为每次250 或停药。三组均持续服药6 个月。
1.3 评价方法
1.3.1 血液指标 分别于治疗前、治疗后1m、3m、6m 采集空腹静脉血,以3000r/min 高速离心处理,取上清液检测下列指标:⑴采用磁微粒化学发光法检测iPTH,试剂盒购自由江苏泽成生物公司。⑵采用日立7600型全自动生化分析仪检测血钙、血磷水平,并计算钙磷乘积。
1.3.2 甲状旁腺体积 治疗前与治疗后1m、3m、6m分别进行颈部超声检查,测量甲状旁腺的长、宽以及厚度。
1.3.3 临床症状 观察并记录患者治疗前与治疗后6m 临床症状改善情况,包括皮肤瘙痒、骨关节疼痛以及不宁腿综合征等。
1.3.4 观察并记录治疗期间不良反应,包括胃肠道症状、头痛、肌肉痛等。
1.4 统计学方法 使用SPSS 19.0 软件进行统计分析。计数资料采用χ2检验,计量资料多组间比较采用F 检验,事后两两比较采用LSD 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 iPTH水平以及达标率比较 三组治疗前iPTH水平无明显差异(P>0.05);治疗后三组iPTH水平均明显降低,且C 组低于B 组,B 组低于A 组(P<0.05),见表2。治疗3m,C 组iPTH 达标率高于A 组及B 组;治疗6m,C 组、B 组达标率高于A 组(P<0.05),见表3。

表2 三组iPTH水平比较(pg/dl)

表3 三组iPTH 达标率比较
2.2 甲状旁腺体积比较 三组治疗前、治疗1m 甲状旁腺体积无明显差异(P>0.05);治疗3m、6m 三组甲状旁腺体积均缩小,且C 组、B 组小于A 组(P<0.05),见表4。

表4 三组甲状旁腺体积比较
2.3 钙磷指标比较 三组治疗前钙磷指标无明显差异(P>0.05);治疗后A 组钙磷指标明显升高,B组、C 组明显降低,且C 组、B 组钙、磷以及钙磷乘积均低于A 组,C 组磷、钙磷乘积低于B 组(P<0.05),见表5。
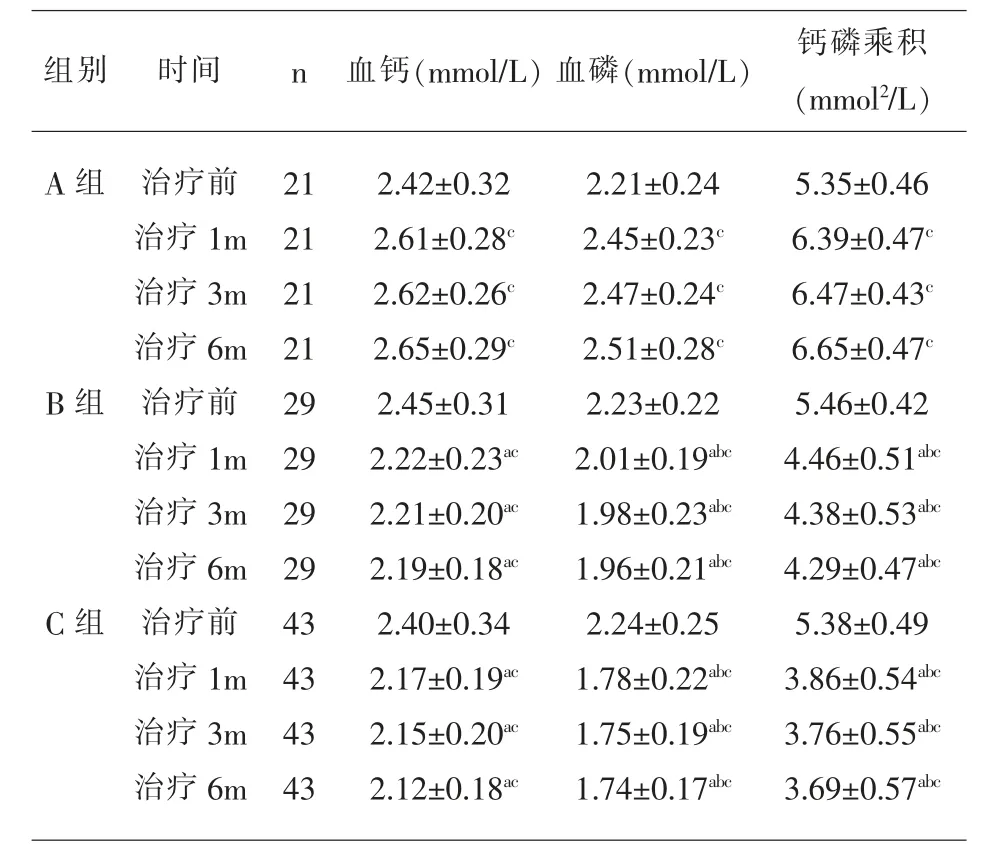
表5 三组钙磷指标比较
2.4 主要临床症状比较 三组治疗后主要临床症状均比治疗前改善(P<0.05),但组间比较差异无统计学意义(P>0.05),见表6。
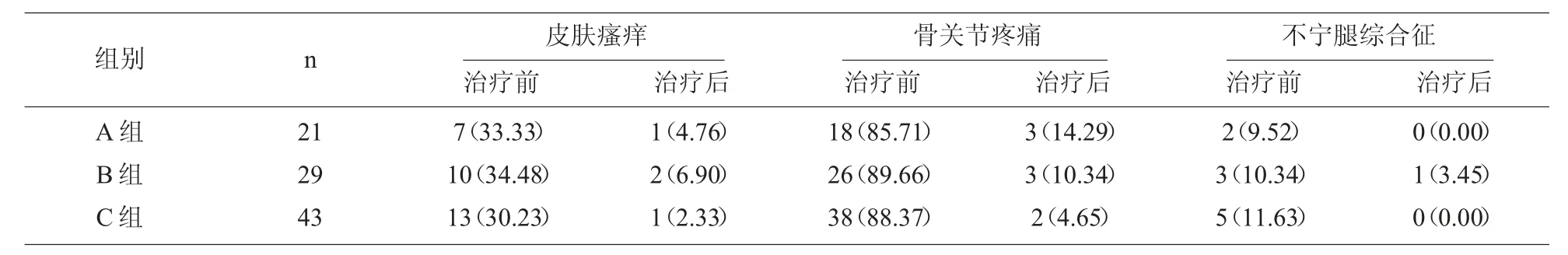
表6 临床症状比较
2.5 不良反应比较 A 组出现腹泻及肌肉痛各1例,B 组出现恶心2例,腹泻与头痛各1例,C 组恶心、腹泻各2例,肌肉痛1例,三组不良反应发生率无明显差异(P>0.05)。
3 讨论
相关资料表明,我国MHD患者中,iPTH水平达标率仅为55.3%,钙和磷达标率仅为53.4%与36.2%[3]。另一项数据指出,在MHD 治疗>10年的患者中,SHPT 发病率 为100%[4]。SHPT 可增加MHD患者骨折、心血管事件风险,提高病死率[5]。与iPTH水平在150~600 ng/L 范围内的CKD患者比较,iPTH水平>600ng/L的患者病死率升高大约15%[6]。因此,加强MHD患者的SHPT 预防与干预管理对于改善患者预后具有积极意义。目前SHPT的治疗方式多样,药物治疗主要采用新型磷结合剂、活性维生素D及其类似物、钙敏感受体激动剂等。
骨化三醇是一种活性维生素D 制剂,能够作用于肠道,促进Ca2+吸收,同时有效抑制iPTH 分泌[7,8]。西那卡塞属于钙敏感受体激动剂,是一种新型治疗SHPT 药物,能够特异性作用于甲状旁腺中的钙受体,提高Ca2+敏感性,抑制iPTH 分泌,并促进钙磷代谢的改善[9,10]。已有研究证实,西那卡塞能够明显下调MHD患者iPTH水平,防止及改善心血管与软组织发生钙化[11]。与上述两种药物比较,碳酸镧的显著优点表现在[12]:⑴具有极强的磷结合力,磷结合系数是CaCO3的2 倍;⑵能够降低血磷含量同时有效防止高钙血症,不增加血管钙化风险;⑶安全性良好,代谢后大部分通过胆汁排出,不会对骨骼、肝脏、大脑造成伤害。
本研究结果显示,上述三种药物联合应用可更加有效控制SHPT 病情,治疗后iPTH 达标率高达95.35%,效果理想。对比三种用药方案患者不同时间点血清iPTH 浓度差异,C 组治疗1m、3m、6m iPTH水平均低于A 组及B 组,进一步证实三种药物联合应用在控制iPTH 方面的效果显著,与吴娟等[13]研究结论一致。本研究中治疗治疗3m、6m 三组甲状旁腺体积均缩小,且C 组、B 组小于A 组,说明联合用药有助于控制甲状旁腺组织增生。
钙磷代谢紊乱是SHPT 发病的始动因素之一,健康人群血清钙、磷浓度在相关激素调节下保持平衡;SHPT患者钙磷代谢紊乱,通过甲状旁腺增生上调iPTH水平,以代偿性维持血清钙、磷浓度[2]。本研究结果显示,治疗后A 组钙磷指标明显升高,B 组、C 组明显降低,且C 组、B 组钙、磷以及钙磷乘积均低于A 组,C 组磷、钙磷乘积低于B 组。骨化三醇促进肠道对钙磷的吸收以及肾小管对钙磷的重吸收,加重异位钙化风险[7]。西那卡塞在抑制iPTH 分泌的同时具有降低血钙的作用,联合应用西那卡塞能够有效削弱骨化三醇血钙升高作用,防止出现继发性高血钙症[14]。已有研究表明,高磷血症能够独立于低钙血症、低维生素D 等因素之外,直接刺激iPTH的合成,因此血磷水平有助于更好控制iPTH[15]。本研究中,C 组患者加用碳酸镧治疗,结果血磷以及钙磷乘积等指标均低于A 组与B 组,说明三种药物联用可显著改善钙磷代谢。
综上所述,碳酸镧+西那卡塞+骨化三醇的治疗方案能够有效控制SHPT患者iPTH水平,调节钙磷代谢,效果显著且安全性良好。

