不同临床分期多发性骨髓瘤患者血清Hcy、sICAM-1、HMGB1水平变化及临床意义
郭改玲,张月玲,贾新勇
(漯河医学高等专科学校第二附属医院检验科,河南 漯河 462000)
多发性骨髓瘤(Multiple Myeloma,MM)属于血液系统恶性肿瘤,占比约为10%,发病机制复杂,患者易出现病理性骨折、贫血,且早期症状不明显,临床应进行及时诊断与治疗[1]。近年来,血清细胞因子水平在临床疾病诊断中应用广泛,其中同型半胱氨酸(Homocysteine,Hcy)参与肿瘤患者凝血、抗凝血活动,会促进肿瘤细胞生长浸润[2];可溶性细胞间黏附分子(soluble Inter Cellular Adhesion Molecule-1,sICAM-1)属于阶段性抗原,广泛分布于骨髓造血细胞及骨髓基质细胞中,在MM患者中处于高表达;高迁移率族蛋白B1(High Mobility Groupprotein B1,HMGB1)在创伤、炎症、恶性肿瘤等发病过程中具有重要作用,且与肿瘤转移、浸润相关[3]。本研究选取我院MM患者174例,旨在探讨不同临床分期血清Hcy、sICAM-1、HMGB1水平变化及临床意义。报告如下。
1 资料和方法
1.1 一般资料 选取2018年3 月-2020年3 月我院MM患者174例,及同期健康体检者60例,MM患者男87例,女87例;年龄43~84 岁,平均61.58±8.82 岁;MM 国际分期系统(International Staging System,ISS)临床分期:Ⅰ期54例,Ⅱ期63例,Ⅲ期57例。健康体检者男30例,女30例;年龄44~85 岁,平均61.63±8.74 岁。两者基线资料(性别、年龄)均衡可比(P>0.05)。
1.2 选例标准 ⑴纳入标准:MM患者均符合《中国多发性骨髓瘤诊治指南(2020年修订)》中MM 诊断标准[4];均为初次诊治;入院前均未进行放化疗;卡氏功能状态评分(KPS)>60 分;均采用硼替佐米+环磷酰胺+地塞米松治疗;均经我院医学伦理委员会批准;均签署知情同意书。⑵排除标准:化疗过程中或化疗前发生感染;持续性慢性感染、腹泻、自身免疫性疾病;近3 个月使用过免疫抑制剂、激素等药物;合并原发性骨质疏松症;伴有其他部位恶性肿瘤;严重肝肾功能障碍或心脑血管疾病。
1.3 方法
1.3.1 检测方法 采集MM患者、健康体检者5ml空腹外周静脉血,于室温下静置1h,以2000r/min的速度离心,时间为10min,分离得到上层血清,保存于-80℃下待测;采用酶联免疫吸附法(Enzyme Linked Immuno Sorbent Assay,ELISA)测定Hcy、sICAM-1、HMGB1水平,严格按照试剂盒(厦门惠嘉生物科技有限公司)说明书操作步骤进行,EXL800 酶标仪型号为EXL800。
1.3.2 预后情况 根据放化疗治疗效果评估预后,分为完全缓解、部分缓解[非常好的部分缓解(VGPR)+部分缓解(PR)+疾病稳定(SD)]及复发,其中疾病进展(PD)记为复发。
1.4 观察指标 ⑴MM患者、健康体检者血清Hcy、sICAM-1、HMGB1水平。⑵不同临床分期MM患者血清Hcy、sICAM-1、HMGB1水平。⑶MM患者临床分期与血清Hcy、sICAM-1、HMGB1水平的相关性。⑷不同预 后MM患者血 清Hcy、sICAM-1、HMGB1水平。⑸血清Hcy、sICAM-1、HMGB1水平对复发MM患者的预测价值。
1.5 统计学方法 采用SPSS22.0对数据进行分析,计量资料采用()表示,组间比较采用独立样本t检验对比,多组间比较采用单因素方差分析,两两比较采用LSD-t 检验,采用Spearman 进行相关性分析,采用受试者工作特征曲线(ROC)及曲线下面积(AUC)进行预测价值分析,P<0.05 为差异有统计学意义。
2 结果
2.1 MM患者、健康体检者血清Hcy、sICAM-1、HMGB1水平 MM患者血 清Hcy、sICAM-1、HMGB1水平高于健康体检者,差异有统计学意义(P<0.05)。见表1。
表1 MM患者、健康体检者血清Hcy、sICAM-1、HMGB1水平()
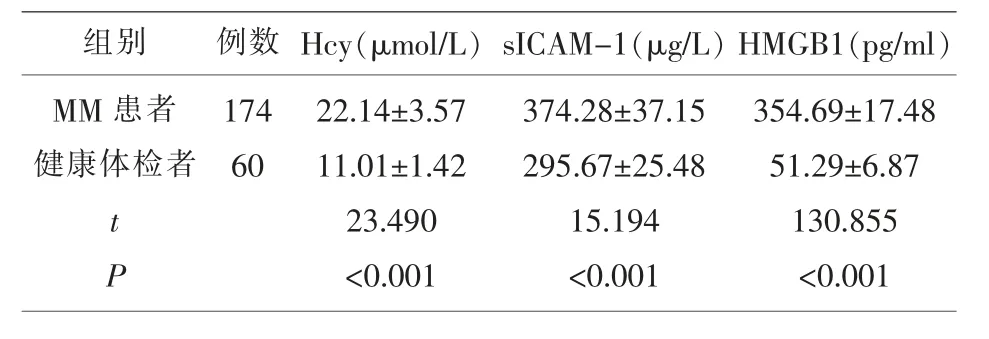
表1 MM患者、健康体检者血清Hcy、sICAM-1、HMGB1水平()
2.2 不同分期MM患者血清Hcy、sICAM-1、HMG B1水平 随着MM患者临床分期的增加,血清Hcy、sICAM-1、HMGB1水平呈逐渐升高趋势,差异有统计学意义(P<0.05)。见表2。
表2 不同分期MM患者血清Hcy、sICAM-1、HMGB1水平()
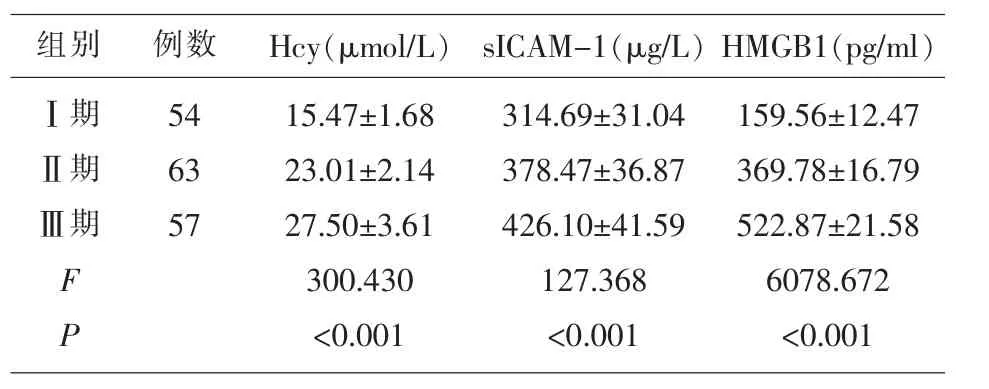
表2 不同分期MM患者血清Hcy、sICAM-1、HMGB1水平()
2.3 MM患者临床分期与血清Hcy、sICAM-1、HMGB1水平的相关性 经Spearman 相关性分析,血清Hcy、sICAM-1、HMGB1水平与MM患者临床分期呈正相关(P<0.05)。见表3。
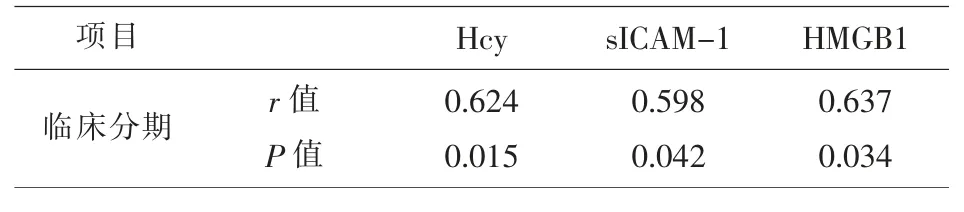
表3 MM患者临床分期与血清Hcy、sICAM-1、HMGB1水平的相关性
2.4 不同预后MM患者血清Hcy、sICAM-1、HMG B1水平 174例MM患者中经治疗后完全缓解101例,部分缓解49例,复发24例;复发患者血清Hcy、sICAM-1、HMGB1水平高于完全缓解、部分缓解患者,且部分缓解患者高于完全缓解患者,差异有统计学意义(P<0.05)。见表4。
表4 不同预后MM患者血清Hcy、sICAM-1、HMGB1水平()
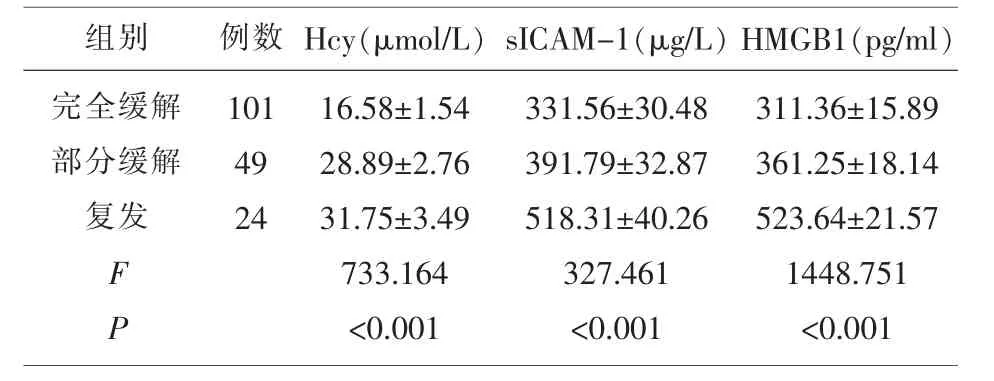
表4 不同预后MM患者血清Hcy、sICAM-1、HMGB1水平()
2.5 血清Hcy、sICAM-1、HMGB1水平对复发MM患者的预测价值 根据血清Hcy、sICAM-1、HMG B1水平对MM患者复发的ROC 曲线,联合预测AUC 值0.876 大于Hcy 预测0.758、sICAM-1 预测0.729、HMGB1 预测0.814(P<0.05)。见表5。

表5 血清Hcy、sICAM-1、HMGB1水平对复发MM患者的预测价值
3 讨论
MM 是由于骨髓浆细胞异常增生,其分泌的单克隆抗体会损伤相关组织与器官,威胁患者生命安全,且近年来发病率呈逐渐上升趋势,预后效果较差[5]。因此临床应积极寻找可靠血清标志物,对MM的早期诊断、病情监测、预后评估具有重要临床意义。
本研究对相关血清细胞因子进行检测,结果显示MM患者血清Hcy、sICAM-1、HMGB1水平高于健康体检者(P<0.05)。其中Hcy 是含硫氨基酸,多形成于甲硫氨酸的去甲基化中,与癌性病变密切相关,能改变肿瘤患者纤溶系统、凝血功能,促进肿瘤细胞浸润与生长。郝苗等[6]学者研究表明,血清Hcy水平在MM患者中呈显著升高趋势,且其变化与MM 具有明显相关性,与本研究结果一致。sICAM-1表达水平升高会选择性促进肿瘤细胞转移及浸润组织黏附,在多种恶性肿瘤中均会显著升高,且与疾病分期、分型、预后均具有相关性[7]。而HMGB1 广泛存在于细胞核中,能参与基因转录调控,维持结构稳定性,癌变过程中HMGB1水平处于高表达状态,与MM 发病具有密切相关性[8]。本研究结果还显示,随着MM患者临床分期的增加,血清Hcy、sICAM-1、HMGB1水平呈逐渐升高趋势,且经Spearman 相关性分析,血清Hcy、sICAM-1、HMGB1水平与MM患者临床分期呈正相关(P<0.05)。ISS 临床分期在初诊MM患者中病情判断及预后评估中具有重要应用价值[9]。且相关研究表明,MM 临床分期增加,血清sICAM-1表达量升高,从而参与MM 发生发展过程[10]。随着病情进展,临床分期增大,血清Hcy、sICAM-1、HMGB1水平逐渐升高,且与疾病进展呈正相关关系,表明本研究中相关因子指标可为临床病情评估判断提供一定参考价值。
另外,MM患者不同预后情况的血清Hcy、sICAM-1、HMGB1水平比较具有一定差异,复发患者高于完全缓解、部分缓解患者,且经ROC 显示,联合预测AUC 值0.876 大于Hcy 预测0.758、sICAM-1 预测0.729、HMGB1 预测0.814(P<0.05)。充分表明血清Hcy、sICAM-1、HMGB1在预测MM患者预后应用中具有重要价值,是病情评估、预测预后的良好辅助指标,且联合应用预测价值更高。但本研究样本数量有限,结果预测具有一定局限性,日后临床研究中应进一步扩大样本量,提高临床应用价值。
综上所 述,MM患者血 清Hcy、sICAM-1、HMGB1水平显著升高,且随着临床分期的增加逐渐升高,对MM 分期、病情进展评估、预后效果预测预后具有重要预测良好辅助价值。

