甲状腺癌患者术后外周血NGAL、TG及TGAb水平的预后评估价值
王晓阳,谢爱敏,郎少磊,田春桃
(河南省三门峡市中心医院医学检验科,河南 三门峡 472000)
甲状腺癌系内分泌常见恶性肿瘤,女性居多,进展缓慢,预后较好[1],但患者复发、转移仍高达30%,且复发合并远处转移者预后通常较差[2]。故尽早预测其病情变化,以改善预后。中性粒细胞明胶酶相关脂质运载蛋白(NGAL)系由中性粒细胞激活后释放的分泌性蛋白,早期被认为系急性肾损伤相关标志物[3]。近年来文献报道,NGAL 不仅介导内皮功能受损、代谢异常,同时对血管生成、组织修复、机体免疫及细胞凋亡增殖产生重要影响[4]。已被证实NGAL 过表达可增加癌细胞铁利用率,促进肿瘤细胞新生血管生成,可促成癌细胞增殖、浸润及转移[5]。甲状腺球蛋白(TG)系由甲状腺滤泡上皮细胞合成且存储于滤泡内的大分子糖蛋白,为合成甲状腺激素的重要前体蛋白甲状腺炎症、功能亢进及甲状腺肿等病理改变皆可引起血TG浓度改变[6]。理论上,甲状腺癌患者经甲状腺切除及131Ⅰ清甲治疗后残留甲状腺组织已去除,血清无法检出TG表达或TG 浓度极低,故认为血TG浓度改变可预测甲状腺癌复发、转移[7]。抗甲状腺球蛋白抗体(TGAb)已被证实系影响TG 含量的相关因素,TGAb 存在可能导致TG 检测值高估或低估,影响TG 预测的准确性,一般认为TG 测量仅在TGAb 阴性时具有实际评估价值[8]。但TGAb 系针对TG 所产生的特异性抗体,或可能反映甲状腺癌病灶组织的存在。基于此背景,本研究检测甲状腺癌术后患者血清NGAL、TG、TGAb,分析其与甲状腺癌不良预后的关系,旨在探讨三者用于预测甲状腺癌手术预后的价值。
1 对象与方法
1.1 研究对象 收集2013年9 月-2017年2 月医院收治的甲状腺癌患者73例。入选标准:年龄>18岁;完成甲状腺切除术或次全切;已完成131I 治疗,甲状腺摄碘率<1%;经病理证实为分化型甲状腺癌,满足分化型甲状腺癌诊治指南中标准[9];术后1 周内完成血清NGAL、TG、TGAb 检测;完成术后3年随访调查;临床、随访资料完善。排除标准:已发生远处转移甲状腺癌;合并全身其他恶性肿瘤;凝血功能异常;直径超过4 cm 颈部占位性病变;既往有颈部手术史;术中无法切除肿瘤组织或术中已发现肿瘤淋巴结或血管侵犯;全身131I 显像检查见异常放射性摄取≥1%;临床资料不全。其中男27例,女46例;年龄18~72 岁,平均(46.2±10.2)岁;其中滤泡状甲状腺癌3例,乳头状甲状腺癌70例;手术方式:全切54例,次全切19例;合并桥本氏甲状腺炎14例。
1.2 方法 所有患者均完成甲状腺全切或次全切术。术后4 周内停服左旋甲状腺素片,至131I 治疗完毕或131I 治疗前停药3~4 周,确保内源性促甲状腺激素(TSH)水平≥30 μIU/ml。131I 治疗前1日(高TSH 刺激状态下)采集空腹外周血标本3~4 ml,室温下离心,分离血清,采用德国西门子公司Immulite 2000型全自动电化学发光免疫分析仪及原装配套试剂测定TG、TGAb水平;NGAL 检测应用酶联免疫吸附试验,试剂盒购自美国R&D 公司;以上各指标检测均严格按仪器及试剂使用说明操作。TGAb≥60 IU/ml 视为阳性;TG≥10 μg/L视为阳性。
1.3 随访 所有患者术后均至少随访3年。甲状腺癌复发或转移依据131I 全身单光子发射型计算机断层显像(见异常放射性浓聚灶)、TG 结果(TG≥10 μg/L,持续性增高)、超声检查(颈部超声提示淋巴结增大)、胸部CT(肺内见异常高密度影,排除炎症、间质、结核等病变)或病理随访证实[10]。并根据术后3年随访结果将患者分为预后良好组(n=31)与预后不良组(n=42)。
1.4 统计学方法 数据分析选择SPSS 20.0 软件,定性资料采用例数(%)描述,用χ2检验或Fisher确切概率分析,定量资料采用()描述,组间比较用t 检验,多因素Logistic 回归分析筛查甲状腺癌手术预后影响因子,各指标相关性分析应用Pearson相关分析,受试者工作曲线(ROC)分析NGAL、TG、TGAb 预测甲状腺癌不良预后的价值,P<0.05 为差异有统计学意义。
2 结果
2.1 随访复发、转移情况 73例甲状腺癌患者术后随访3年发生复发/转移31例(42.47%),分为不良预后组(n=31)与预后良好组(n=42),预后不良组合并毒性弥漫性甲状腺肿所占比例高于预后良好组(P<0.05),其余各资料对比差异无统计学意义(P>0.05),见表1。
表1 甲状腺癌手术不同预后患者基本情况对比()

表1 甲状腺癌手术不同预后患者基本情况对比()
2.2 甲状腺癌术后不同预后患者血清NGAL、TG、TGAb水平比较 甲状腺癌术后预后不良组外周血NGAL、TG、TGAb水平均高于预后良好组(P<0.05),见表2。
表2 甲状腺癌术后不同预后患者血清NGAL、TG、TGAb水平比较()

表2 甲状腺癌术后不同预后患者血清NGAL、TG、TGAb水平比较()
2.3 甲状腺癌手术患者外周血NGAL、TG、TGAb相关关系分析 甲状腺癌手术患者外周血NGAL与TG、TGAb 均呈正相关(r=0.683、0.759,P<0.001),TG与TGAb 呈正相关(r=0.705,P<0.001),见图1~图3。
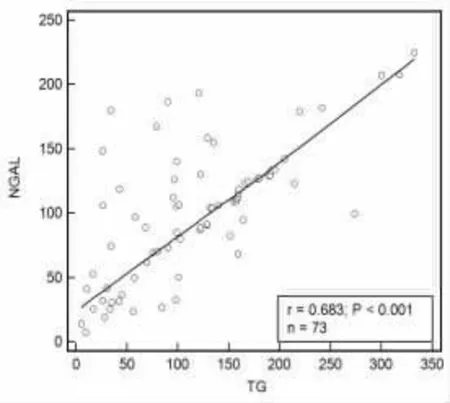
图1 NGAL与TG 相关性分析散点图

图2 NGAL与TGAb 相关性分析散点图

图3 TGAb与TG 相关性分析散点图
2.4 外周血NGAL、TG、TGAb 预测甲状腺癌手术不良预后的价值 外周血NGAL、TG、TGAb对甲状腺癌手术不良预后均有较好的预测价值,其中TGAb 价值最高,约登指数最大时,cut-off 值为679.96,曲线下面积(AUC)为0.892,敏感度、特异性分别为87.10%、90.48%;其次为TG,约登指数最大时,cut-off 值为137.01,AUC 为0.825,敏感度、特异性分别为64.52%、95.24%;NGAL 约登指数最大时,cut-off 值为89.79,AUC 为0.808,敏感度、特异性分别为64.52%、92.86%,见表3与图4。

表3 外周血NGAL、TG、TGAb 预测甲状腺癌手术不良预后的价值

图4 外周血NGAL、TG、TGAb 预测甲状腺手术不良预后的价值
2.5 甲状腺癌手术预后影响因素分析 纳入单因素分析中有统计学意义数据毒性弥漫性甲状腺肿(否=0,是=1)、NGAL(≤cut-off 值=0,>cut-off 值=1)、TG(≤cut-off 值=0,>cut-off 值=1)、TGAb(≤cut-off 值=0,>cut-off 值=1)赋值,进入多因素分析,结果显示:合并毒性弥漫性甲状腺肿及NGAL、TG、TGAb 异常上调均为影响甲状腺癌手术预后的危险因素(P<0.05),见表4。

表4 甲状腺癌手术预后影响因素分析
3 讨论
分化型甲状腺癌虽恶性程度低,但手术后仍有部分患者出现肿瘤复发或转移[11]。前期报道认为,TSH水平、手术方式是甲状腺癌预后影响因子[12,13]。也有学者认为,年龄与甲状腺癌患者不良预后有关[14]。本研究进行单因素及多因素分析均未显示年龄、TSH、手术方式与甲状腺癌不良手术预后的关联,推测以上因素对甲状腺癌手术预后影响不大或无明显影响或并非独立影响因子,可能与其他因素协同共同影响甲状腺癌手术预后。考虑原因为:本组纳入大多数均为中年群体,基础状况较好,故年龄对手术预后影响较小;且大部分患者均应用甲状腺全切术,手术方式无明显区别,对预后无独立影响。有学者表示,甲状腺癌术后与131I“清甲前”TG水平对病灶缓解率及治疗效果产生影响[15]。郑款恒等[16]表示,术后伴TG 异常上升可能提示甲状腺癌不良预后。本研究按甲状腺癌患者随访3年预后情况进行分组,结果发现,预后不良组外周血TG水平明显高于预后良好组,且进行多因素分析发现,高TG水平为影响甲状腺癌术后预后的独立危险因子,这与Maisel 等[17]研究结果相似,故推测TG在甲状腺癌术后随访监测肿瘤复发或转移中有重要作用,分析原因为:分化型甲状腺癌患者术后及彻底完成“清甲”后外周血TG水平完全取决于转移灶或复发灶的形成,无甲状腺病理组织或残余甲状腺组织彻底根除后一般血清TG水平极低或无法检测,体内无TG 来源,仅当出现转移或复发时,甲状腺病理组织存在,导致血清TG浓度异常上调。基于此结果,在“清甲”前TG水平较高的分化型甲状腺患者我们建议适当增加131Ⅰ用药剂量,确保术后残存甲状腺组织彻底清除,以预防甲状腺癌复发、转移。
TGAb 系机体针对TG 所释放的自身一致性抗体,可反映甲状腺组织或分化型甲状腺病灶情况,异常增高常见于甲状腺炎症性疾病或甲状腺良恶性肿瘤中[18]。虽TG水平已成为检测分化型甲状腺癌病灶残留、肿瘤复发及转移的依据[19]。但研究发现,TG 检测受TSH、TGAb 等水平影响[20]。故有学者提出TGAb 有望替代TG 成为甲状腺癌术后复发、转移评估的依据[21]。在本研究中,采用同一种方法检测TG、TGAb水平,以减少以上因素对TG水平的干扰,结果发现预后不良组TGAb 明显高于预后良好组,且TGAb 上升趋势与TG基本一致。同时我们发现,TGAb 为甲状腺癌手术预后的影响因子,这与黄青清等[22]结论相符,我们考虑TGAb 异常高表达患者常可能合并腺体外侵犯、肿瘤直径较大,危险度分层高,更易出现复发、转移[23];且TG为TGAb的靶抗原,在致病因素作用小,TG 自甲状腺滤泡内释放进入血液,导致TGAb 生成,两者结合后通过激活自然杀伤细胞,导致甲状腺细胞受损,造成肿瘤复发、转移。此外,我们还发现合并毒性弥漫性甲状腺肿系影响甲状腺癌手术预后的危险因素,我们分析可能与合并毒性弥漫性甲状腺肿患者大多伴高代谢症及甲状腺肿大,自身免疫功能紊乱,恶性程度更高,更易出现复发、转移。
NGAL 则为中性粒细胞活化后产生的分泌性蛋白,在胚胎发育、炎症、免疫应答及趋化过程中均有关键作用[24]。且已被证实与多种肿瘤发生及进展有关[25,26]。安江宏等[27]研究发现,NGAL 有与铁转运蛋白相似的作用,NGAL 过表达可导致癌细胞内部铁含量增加。而DNA 转录及氧化呼吸链能量传递等活动均由铁离子参与,肿瘤细胞增殖及代谢旺盛皆可引起NGAL 浓度上升[28]。本研究发现,甲状腺癌术后预后不良组外周血NGAL水平明显高于预后良好组,且多因素分析证实NGAL 异常高表达为影响甲状腺癌手术预后的独立因子,得出NGAL对甲状腺癌术后复发、转移评估有重要价值。进行ROC 曲线分析发现,TG、TGAb、NGAL对预测甲状腺癌手术不良预后均有较高的效能,提示NGAL 可作为甲状腺癌不良预后预测的有效补充。且进行相关性分析发现,三者表达均存在明显正相关关系,我们分析原因为:TG 作为甲状腺癌关键肿瘤标志物,其特异性上升可能提示甲状腺病灶存在,预示较高的甲状腺癌复发、转移风险,而其作为TGAb靶蛋白,特异性表达上调可引起TGAb 释放增多,两者共同作用可能进一步加重甲状腺细胞受损,促成肿瘤复发、转移,在此过程中NGAL 同样发挥一定的驱动作用,促进癌细胞新生血管形成,导致甲状腺癌复发、转移,故三者表达可能存在一定的协同影响。但对其确切机制尚待进一步研究证实。
但本研究观察时间短,病例数少,且为回顾性研究,可能存在一定的局限性。后续需进一步扩充样本数量、延长随访时间,展开多中心研究进一步论证NGAL、TG、TGAb对甲状腺癌术后复发、转移的预测价值。

