类风湿因子在抗中性粒细胞胞质抗体相关小血管炎中的临床意义分析
曾雯 赵铖 郑乐婷

【摘 要】目的:探索类风湿因子(RF)在抗中性粒细胞胞质抗体相关小血管炎(AASV)中的临床意义及应用价值。方法:回顾性分析广西医科大学第一附属医院确诊的AASV患者99例,按RF值分为RF阴性组和RF阳性组,比较2组临床资料的差异。结果:RF阳性组55例(55.56%),RF阴性组44例(44.44%)。RF阳性组患者的年龄、C反应蛋白(CRP)高于RF阴性组;RF阳性组肌酐、24 h尿蛋白定量低于RF阴性组。相关性分析显示,RF滴度与CRP、肾小球滤过率呈正相关,与24 h尿蛋白定量呈负相关。2组患者均无病例演变为类风湿关节炎。结论:RF阳性AASV患者较RF阴性AASV患者的年龄、炎症指标更高,肾损害更轻,但两者预后无明显差异,提示AASV中的RF可能为低亲和力RF,在AASV疾病中影响有限。
【关键词】 抗中性粒细胞胞质抗体相关小血管炎;类风湿因子;回顾性分析
抗中性粒细胞胞质抗体相关小血管炎(antineutrophil cytoplasmic antibody-associated vasculitis,AASV)是一类累及全身多器官、多组织的寡免疫复合物坏死性小血管炎。AASV分为3种类型,包括显微镜下多血管炎、肉芽肿性多血管炎和嗜酸性肉芽肿性多血管炎[1],部分调查显示,30%~50%的AASV患者出现类风湿因子(RF)阳性[2],其意义未明。而在原发性干燥综合征、系统性红斑狼疮等多种弥漫结缔组织病研究中,RF阳性与肾受累的发生率有关[3-4]。国外仅有两项研究关注血清RF在AASV中的临床意义[5-6],其结果截然相反;国内未见相关报道。本研究通过回顾性分析AASV患者的临床资料,探讨RF在AASV中的临床意义及应用价值,为临床诊治AASV提供新的思路。
1 资料与方法
1.1 临床资料 选取2012年2月至2017年12月在广西医科大学第一附属医院确诊的AASV患者99例,均符合1990年美国风湿病学会(ACR)制定的AASV分类标准和2012年Chapel Hill共识会议制定的AASV命名标准。排除药物所致血管炎,并排除所有在就诊时确诊感染、肿瘤及除AASV外其他类型的自身免疫性疾病。所有患者随访至失访、死亡或2018年4月。回顾性分析AASV患者的人口学数据、辅助检查、肾脏病理、伯明翰血管炎评分(BVAS)、治疗方法、结局。
1.2 检验及分组方法 RF通过比浊法(欧蒙)测定IgM-RF,按血清RF值的正常范围上限将患者分为RF阳性组(RF≥12.5 U·mL-1)及RF阴性组(RF < 12.5 U·mL-1)。
1.3 病理资料 62例患者进行了肾穿刺活检,根据BERDEN的AASV肾脏病理分类[7],将肾组织病理分为4类,即局灶型、新月体型、混合型、硬化型。
1.4 统计学方法 采用SPSS 24.0软件进行统计分析。计量资料符合正态分布以表示,采用t检验;不符合正态分布以中位数(四分位数间距)[M(P25~P75)]表示,采用Mann-Whitney U检验;计数资料采用χ2检验、连续性校正或Fisher精确检验;通过Spearman相关计算相关系数;采用多元Logistic回归分析模型对肾脏受累进行分析;生存分析采用Kaplan-Meier分析。以P < 0.05为差异有统计学意义。
2 结 果
2.1 基本资料 本研究收集到99例AASV患者,其中显微镜下多血管炎73例,肉芽肿性多血管炎21例,嗜酸性肉芽肿性多血管炎5例;男38例,女61例;年龄10~87岁,中位数59岁;RF阳性组55例(55.56%),RF阴性组44例(44.44%)。RF阳性组中位年龄62岁,大于RF阴性组的55岁,2组比较,差异有统计学意义(P = 0.026)。2组患者的关节、皮肤、黏膜/眼、耳/鼻/喉、心血管、腹部、胸部、神经系统、肾脏系统受累比较,差异无统计学意义(P > 0.05)。治疗后有15例患者再次检测了RF,其中11例RF滴度降至正常水平,4例RF仍为阳性,但均为低滴度阳性(正常值上限的1~2倍)。
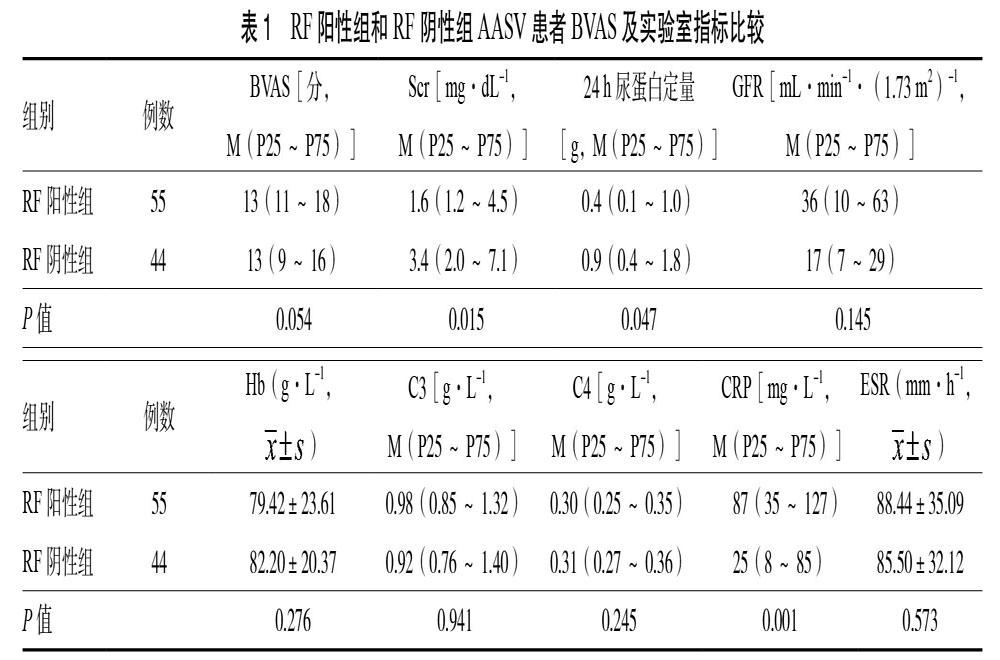
2.2 BVAS及实验室检查 RF阳性组肌酐(Scr)、24 h尿蛋白定量低于RF阴性组,RF阳性组C反应蛋白(CRP)高于RF阴性组,差异有统计学意义(P < 0.05);2組BVAS、肾小球滤过率(GFR)、血红蛋白(Hb)、补体C3(C3)、补体C4(C4)、红细胞沉降率(ESR)比较,差异无统计学意义(P > 0.05)。见表1。19例患者检测了抗环瓜氨酸肽抗体(抗CCP抗体),2组各有1例患者抗CCP抗体阳性,但没有患者表现出关节炎症状、影像学检查显示侵袭性骨关节破坏等改变,在随访中亦没有诊断为RA。
2.3 肾脏病理 62例患者进行了肾脏穿刺活检,局灶型24例(RF阴性11例,RF阳性13例),新月体型10例(RF阴性6例,RF阳性4例),混合型15例(RF阴性8例,RF阳性7例),硬化型13例(RF阴性10例,RF阳性3例)。7例(11.29%)检测出补体沉积,3例(4.84%)检测出免疫球蛋白沉积。2组患者肾脏类型及免疫复合物沉积比较,差异均无统计学意义(P > 0.05)。
2.4 相关性分析 相关性分析显示,RF滴度与CRP水平呈正相关(r = 0.478,P < 0.001),与Scr呈负相关(r = -0.291,P = 0.003),与24 h尿蛋白定量呈负相关(r = -0.330,P =0.001),与GFR呈正相关(r = 0.238,P = 0.018)。采用偏相关校正年龄因素后,RF滴度仍与CRP、24 h尿蛋白定量呈负相关(r = -0.384,P < 0.001;r = -0.247,P = 0.014),与GFR呈正相关(r = 0.298,P = 0.003)。此外,RF滴度与ESR、BVAS、Hb、C3、C4无显著相关性。多元Logistic分析校正年龄及性别因素,结果显示,RF阳性与脏器受累水平均无显著相关性。
2.5 生存預后 中位随访时间为12个月(IQR 5~28个月)。随访期间,14例(14.14%)复发,25例(25.25%)进展为肾衰竭,28例(28.28%)死亡;其中2例患者死于严重感染,5例死于弥漫性肺泡出血,3例死于腹腔内出血,7例死于呼吸道出血,1例死于自发肾破裂出血,10例死于肾衰竭。RF阳性组和RF阴性组患者的存活、肾脏存活及无复发生存的生存曲线比较,差异无统计学意义(P > 0.05)。此外,随访过程中没有病例出现关节影像学检查的RA典型关节影像学表现,也无病例被诊断为RA。RF阳性组和RF阴性组患者生存预后相关指标,见图1。
3 讨 论
RF被定义为以IgG的Fc部分为靶抗原的非特异性自身抗体,是RA的诊断指标之一。RF包括IgM、IgA、IgG、IgE、IgD几种类型[8-9],临床上通常仅检测IgM-RF。外周血RF常用于诊断RA、帮助评估RA疾病活动及病情严重性。然而,许多存在IgG扩增的疾病都可能出现RF阳性[10]。在RA中发现的RF具有高亲和性,多为IgM-RF,由抗原呈递细胞和T细胞共刺激B2-B细胞产生[11]。
除了RA,多种自身免疫疾病、感染性疾病及肿瘤都可检测到不同程度阳性[12-15],多为低亲和性的。据报道,30%~50%的AASV患者出现RF阳性[2],其临床意义尚未明确。本研究中,AASV的RF阳性率为55.56%,与此前研究结果类似[5-6]。本研究显示,RF阳性组年龄显著大于RF阴性组,可能与年龄相关性免疫失调有关[10]。目前,仅有两项关于RF在AASV中临床意义的研究。WATANABE等[5]关于AASV的研究结果表明,RF与CRP、ESR及BVAS有显著相关性。MOON等[6]研究显示,RF与炎症指标、疾病活动无显著相关性。本研究显示,RF与CRP显著相关;但RF阳性组和RF阴性组的ESR、BVAS无明显差异,即2组的血管炎活动度大致相同。本研究关于RF在AASV患者中的临床意义与国外的两项研究结果不尽相同,可能与病例数、种族差异、实验室方法有关。两项研究中均无RF阳性的AASV病例发展为RA[5-6]。本研究在随访过程中,大部分患者治疗后再次检测的RF均呈明显下降趋势,亦没有病例发展为RA。基于以上结果,有理由认为AASV中的RF可能与大多数非RA病例中发现的RF类似,属于低亲和力RF,对关节没有致病性。
WATANABE等[5-6]的两项研究并未关注AASV患者肾脏受累中RF阳性的临床意义。而本研究发现,RF阳性患者具有更好的肾功能及更少的尿蛋白,其可能机制如下:尽管AASV肾炎被认为是寡免疫复合物沉积的肾小球肾炎,但近年来越来越多的证据揭示了免疫复合物和补体在AASV中的致病作用[16-17]。RF与补体竞争性结合免疫复合物,降低补体系统激活的强度并减少原位组织损伤,同时RF与免疫复合物形成较大、溶解性较低的复合物,其可以更有效地被网状内皮系统清除,这种情况下RF具备保护性功能[10]。然而,本研究中2组肾脏病理类型、肾脏补体及免疫球蛋白沉积、治疗强度、生存曲线没有差异,这可能与笔者之前的猜想一致:AASV中的RF为低亲和力RF,其存在时间短暂,并且滴度受到免疫抑制治疗的影响,对AASV疾病的影响有限。由于本研究为回顾性研究,RF在AASV的发病过程中所扮演的角色及应用价值有待扩大样本量及进行前瞻性研究来进一步阐明。
参考文献
[1] JENNETTE JC,FALK RJ,BACON PA,et al.2012 revised international chapel hill consensus conference nomenclature of vasculitides[J].Arthritis Rheum,2013,65(1):1-11.
[2] PAGNOUX C,SEROR R,B?REZN? A,et al.Remittent non-destructive polysynovitis in p-ANCA-positive vasculitis patients with anti-CCP antibodies[J].Joint Bone Spine,2010,77(6):604-607.
[3] PEEN E,MELLBYE OJ,HAGA HJ.IgA rheumatoid factor in primary Sj?gren's syndrome[J].Scand J Rheumatol,2009,38(1):46-49.
[4] SKARE TL,SILVA MB,HOLLER AP,et al.Protective role of rheumatoid factor in lupus nephritis[J].Clin Exp Rheumatol,2009,27(5):895.
[5] WATANABE S,GONO T,NISHINA K,et al.Rheumatoid factor is correlated with disease activity and inflammatory markers in antineutrophil cytoplasmic antibody-associated vasculitis[J].BMC Immunol,2017,18(1):53.
[6] MOON JS,LEE DD,PARK YB,et al.Rheumatoid factor false positivity in patients with ANCA-associated vasculitis not having medical conditions producing rheumatoid factor[J].Clin Rheumatol,2018,37(10):2771-2779.
[7] BERDEN AE,FERRARIO F,HAGEN EC,et al.Histopathologic classification of ANCA-associated glomerulonephritis[J].J Am Soc Nephrol,2010,21(10):1628-1636.
[8] GIOUD-PAQUET M,AUVINET M,RAFFIN T,et al.IgM rheumatoid factor(RF),IgA RF,IgE RF,and IgG RF detected by ELISA in rheumatoid arthritis[J].Ann Rheum Dis,1987,46(1):65-71.
[9] BANCHUIN N,JANYAPOON K,SARNTIVIJAI S,et al.Re-evaluation of ELISA and latex agglutination test for rheumatoid factor detection in the diagnosis of rheumatoid arthritis[J].Asian Pac J Allergy Immunol,1992,10(1):47-54.
[10] INGEGNOLI F,CASTELLI R,GUALTIEROTTI R.Rheumatoid factors:clinical applications[J].Dis Markers,2013,35(6):727-734.
[11] NEWKIRK MM,FOURNIER MJ,SHIROKY J.Rheumatoid factor avidity in patients with rheumatoid arthritis:identification of pathogenic RFs which correlate with disease parameters and with the gal(o)glycoform of IgG[J].J Clin Immunol,1995,15(5):250-257.
[12] NOCTURNE G,VIRONE A,NG WF,et al.Rheumatoid factor and disease activity are independent predictors of lymphoma in primary Sj?gren's syndrome[J].Arthritis Rheumatol,2016,68(4):977-985.
[13] SHIM CN,HWANG JW,LEE J,et al.Prevalence of rheumatoid factor and parameters associated with rheumatoid factor positivity in Korean health screening subjects and subjects with hepatitis B surface antigen[J].Mod Rheumatol,2012,22(6):885-891.
[14] 郭穎,韩淑花,周彩云,等.类风湿因子异常在108例原发性干燥综合征中的临床分析[J].风湿病与关节炎,2018,7(2):43-45.
[15] NAKANO M,UENO M,NISHI S,et al.Determination of IgA-and IgM-rheumatoid factors in patients with rheumatoid arthritis-with and without nephropathy[J].Ann Rheum Dis,1996,55(8):520-524.
[16] OHLSSON S,HOLM L,HANSSON C,et al.Neutrophils from ANCA-associated vasculitis patients show an increased capacity to activate the complement system via the alternative pathway after ANCA stimulation[J].PLoS One,2019,14(6):e0218272.
[17] CRNOGORAC M,HORVATIC I,KACINARI P,et al.Serum C3 complement levels in ANCA associated vasculitis at diagnosis is a predictor of patient and renal outcome[J].J Nephrol,2019,31(2):257-262.
收稿日期:2021-05-28;修回日期:2021-06-30