淄博市23 689例新生儿耳聋基因筛查结果分析△
韩佳佳 胡林 刘轶 魏欣 牟凯
导致听力障碍的因素包括遗传、环境及两者共同作用三大类,研究表明,60%的先天性听力障碍与遗传因素密切相关[1]。遗传性聋分为综合征型聋和非综合征型聋,其中以非综合征型聋为主。非综合型聋具有高度的遗传异质性,70%不伴其他症状,且几乎都属于单基因遗传。目前已知非综合征型聋相关基因约46个,突变频率在不同种族、不同地域间存在差异[2]。近年来针对中国人群的大规模耳聋分子流行病学研究表明,绝大多数的非综合征型聋由GJB2、SLC26A4、GJB3和线粒体DNA12SrRNA[3,4]四个基因突变引起,基因突变位点的确定对制定有效的预防、干预措施具有重要的指导意义。
新生儿听力筛查现已广泛应用于临床,但是现行听力筛查模式的局限性使得它不能有效检出迟发性聋和药物性聋患儿,且现有数据显示部分致病基因突变携带者也能通过新生儿听力筛查[5]。耳聋基因筛查不仅能够尽早明确耳聋的致病原因并尽早采取治疗和干预措施,降低或避免迟发性聋的发生,而且能够尽早筛查出药物性聋的高危人群,指导用药,避免药物性聋的发生。
本研究采用遗传性聋基因芯片技术对淄博市23 689例新生儿4个常见耳聋基因的15个位点进行筛查,不仅有效检出了耳聋基因突变携带者,明确诊断,利于改善预后、指导生育,而且对于药物敏感性聋和迟发性聋的早发现、早诊断和早治疗有重要作用。现将结果报告如下。
1 资料与方法
1.1研究对象 选择2019年1~ 11月在淄博市出生的23 689例新生儿为研究对象,其中,男12 526例,女11 163例,男女比例为1.12∶1。所有受检新生儿均由家属签署知情同意书,自愿进行耳聋基因筛查。
1.2耳聋基因筛查方法
1.2.1DNA的提取 新生儿出生后2~3 d,用采血滤纸采集新生儿足跟末梢血2个血斑,充分渗透,血斑直径≥8 mm,提取DNA,-20 ℃保存备用。
1.2.2PCR扩增 PCR反应体系:遗传性聋基因检测试剂盒中所涉及GJB2、SLC26A4、GJB3和线粒体DNA12SrRNA[3,4]4个基因的15个检测位点(GJB2:c.35 dek G、c.235 del C、c.299 del AT、c.176 del 16;GJB3:c.538 C>T;SLC26A4:c.2168 A>G、c.IVS7-2 A>G、c.IVS15+5 G>A、c.1975 G>C、c.2027 T>A、c.1226 G>A、c.1229 C>T、c.1174 A>T;线粒体DNA12SrRNA:m.1495 C>T、m.1555 A>G)分别分布在A、B、C三个扩增体系中,各取三个扩增体系20 μl,各加DNA5 μl;PCR反应条件:37 ℃ 10 min,95 ℃ 15 min,95 ℃ 30 s,0.4 ℃/s 退火至57 ℃ 30 s,0.2 ℃/s退火至70 ℃ 45 s,循环35 次;60 ℃ 10 min,12 ℃ ∞。
1.2.3杂交和检测 分别取A、B、C三个扩增体系各5 μl进行芯片杂交,杂交完成后经洗涤和干燥放入全自动扫描仪进行芯片扫描和结果分析。
1.2.4测序验证 检测为阳性的样本送由北京博奥生物技术有限公司进行测序验证。
1.3统计学方法 采用SPSS19.0软件进行数据统计分析,计数资料采用χ2检验,P<0.05表示差异有统计学意义。
2 结果
2.1耳聋基因突变在不同性别中的分布 23 689例新生儿共检测出突变者1 162例,总体突变携带率4.90%。其中男婴检出基因突变616例(4.92%,616/1 2 526);女婴检出突变546例(约4.89%,546/11 163)。不同性别之间基因突变检出率无统计学差异(χ2=4.495,P>0.05)。
2.2耳聋基因突变位点筛查结果 1 162例耳聋基因突变中,GJB2基因突变608例(52.32%,608/1 162);GJB3基因突变96例,约占8.26%(96/1 162);SLC26A4基因突变396例,占34.08%(396/1 162);线粒体DNA12SrRNA 基因突变 45例,占3.87%(45/1 162);双基因突变17例,占1.46%(17/1 162)(表1)。
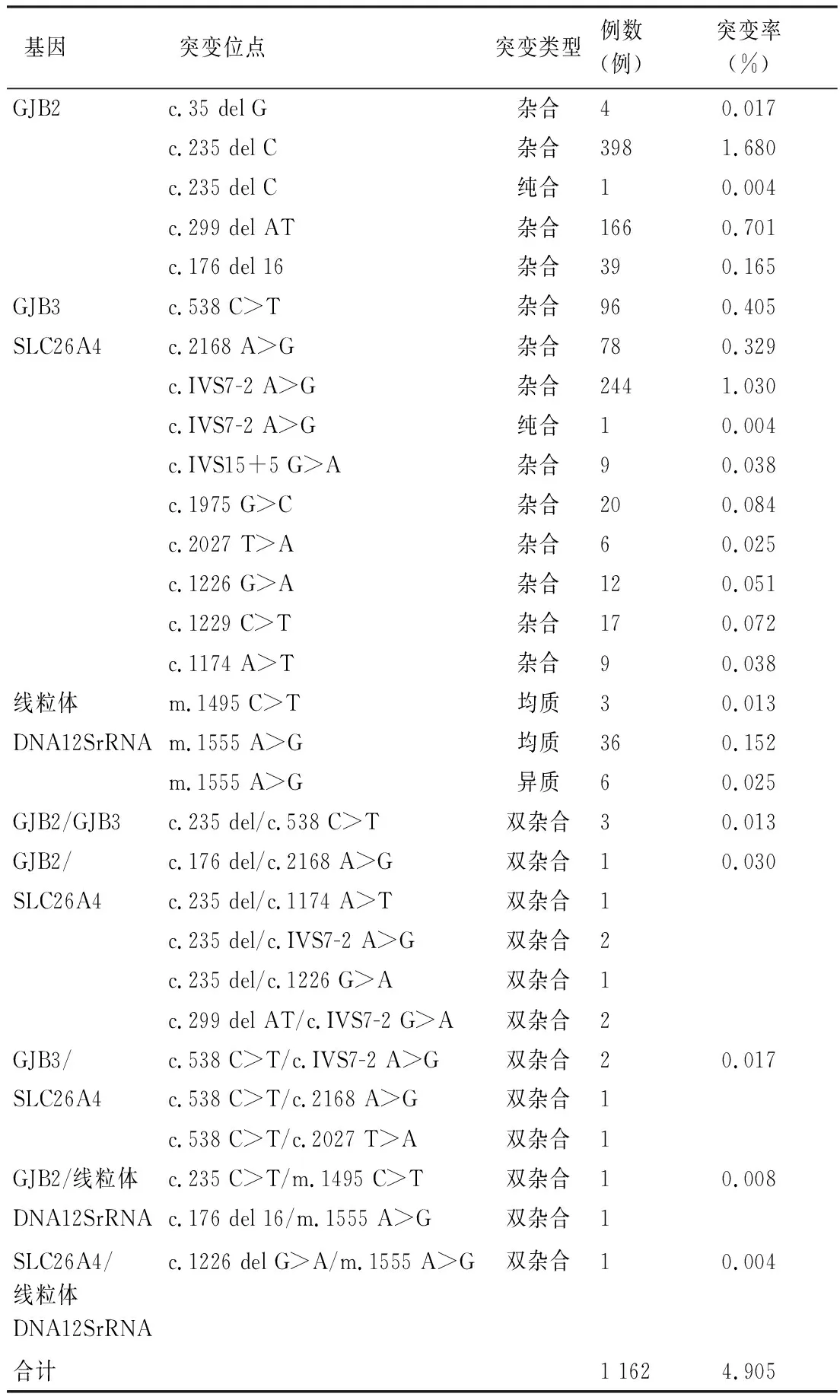
表1 耳聋基因突变位点、突变类型、例数及突变率
3 讨论
遗传性聋基因芯片技术是目前安全、高效、敏感的检测方法之一,可有效检出耳聋基因突变携带者[6]。与全面的诊断测试方法相比,它具有成本低、检测周期短、易于解释以及结果不确定性低的优点,为本地区耳聋基因筛查提供了技术支持。
GJB2基因位于13号染色体,表现为常染色体隐性遗传,是最常见的耳聋致病基因[7]。在我国人群中,常见的GJB2突变类型主要有c.35 del G、c.176 del 16、 c.235 del C和c.299 del AT[8,9]。GJB2 基因的遗传异质性突出,听力学表型呈多样化,可表现为轻度至极重度听力损失。本组对象中共筛查出GJB2基因突变608例(2.57%),其中杂合突变607例,纯和突变1例,另有12例双杂合突变,c.235 del C和c.299 del AT位点突变率较高,分别为1.68%和0.70%。该基因纯合突变是造成患者先天性听力损失的主要病因,尽管杂合突变不绝对致病,但也要密切关注携带者的听力变化情况,定期检查,一旦发现听力异常,要及时采取干预措施,最大程度避免听力损伤。
SLC26A4基因位于7号染色体,也是常染色体隐性遗传,是仅次于 GJB2 基因的常见致聋基因[10]。SLC26A4与大前庭水管综合征(large vestibular aqueduct syndrome,LVAS) 密切相关,可引起中度至极重度的感音神经性听力损失[11]。SLC26A4基因突变患者出生时可表现为听力正常,但当头部受到撞击、外伤或者感冒后才出现听力损失,严重者可引起中度、重度甚至极重度聋,多为语后聋[12]。迟发性聋患儿往往能够通过新生儿听力筛查,很容易被漏检。本研究共筛查出SLC26A4基因突变396例(1.67%),其中杂合突变395例,纯和突变1例,另有12例双杂合突变;IVS7-2位点突变率较高,突变率为1.03%。对于SLC26A4基因突变携带者应及时告之其避免颅压增大和外伤,如:头部撞击以及感冒、发烧等外因诱发耳聋的发生。
GJB3基因位于1号染色体,属常染色体显性或隐性遗传,该基因突变往往会导致高频听力损失或后天性耳聋[13,14]。本研究共筛查出GJB3基因杂合突变96例(0.41%),另有7例双杂合突变;对此类携带者应定期复查听力,及时治疗。
线粒体DNA12SrRNA基因为线粒体遗传,即母系遗传。线粒体DNA12SrRNA 基因突变携带者通常表现为药物引起的感音神经性聋,主要与氨基糖苷类抗生素造成耳聋相关[15,16]。该基因突变的携带者应慎用氨基糖苷类药物,在临床咨询过程中应充分告知新生儿家属,并对其进行用药指导,避免“一针致聋”悲剧的发生。本研究共筛查出线粒体DNA12SrRNA基因突变者45例(0.19%),其中m.1494 C>T均质突变3例,m.1555 A>G均质突变36例,m.1555 A>G异质突变6例,另有3例双杂合突变。对于携带线粒体DNA12SrRNA突变的新生儿,可以指导其临床用药;同时运用线粒体疾病的母系遗传规律,进一步明确先证者家族中尚未发病的母系家庭成员,给予宣教,是一种有效的前瞻性预防手段。
本研究首次在淄博市开展新生儿耳聋基因筛查,初步获得了淄博市遗传性聋的基因突变分布情况。对23 689例新生儿4个常见耳聋基因的15个位点进行筛查,共检出耳聋基因突变携带者1 162例,突变检出率4.90%。其中,GJB2基因突变检出率最高,其次是SLC26A4基因突变,线粒体DNA 12SrRNA最少;以GJB2基因c.235delC杂合突变(1.68%)、 IVS26A4基因IVS7-2杂合突变(1.03%)最多见。由于基因芯片技术所检测的耳聋基因位点有限,因此不能确定所筛查的杂合突变携带者是否还存在其他等位基因突变,因而还需结合听力筛查或者对相应基因进行全序列测序,以确定其是否是先天性或迟发性听力障碍。本研究还检出2例纯合突变和17例双基因杂合突变,有研究表明GJB2和SLC26A4 基因纯合突变与复合杂合突变引起的听力损失程度都以重度、极重度为主,纯合突变引起的听力损失程度往往要重于复合杂合突变引起的听力损失程度[17]。戴朴等[18]对携带GJB2单等位基因突变的中国耳聋人群进行GJB3 基因突变分析,认为同为编码连接蛋白家族成员的GJB3与GJB2 基因可能会以双基因杂合模式导致耳聋,但也有研究[19]显示GJB2、GJB3 双基因杂合突变携带者可以通过听力筛查。因此,GJB2、GJB3 双基因杂合突变是否对其携带者的听力造成影响还需长期的随访进行验证。
本研究通过大样本量的耳聋基因筛查结果分析,补充了本地区人群常见耳聋基因突变分布情况的相关数据,但没有结合听力筛查结果对耳聋基因突变携带者进行分析是本研究的不足之处;此外,本研究还缺乏对耳聋基因筛查异常者的听力随访。对高风险基因型个体的听力状况进行长期随访,对于验证筛查结果、阐明其基因型特有的发病机理至关重要。今后的研究中在进行耳聋基因筛查的同时还要建立完善可行的长期随访制度,并补充听力筛查数据,以验证发病机制,评估干预效果,进一步增强耳聋基因筛查的优势。

