ZEB1对食管癌细胞侵袭转移的影响及作用机制研究
李俊峰,徐 俊,李晓雷,李涵冰
(1.四川省南充市中心医院胸心外科,川北医学院第二临床学院,四川 南充 637000;2.川北医学院附属医院甲状腺乳腺外科,四川 南充 637000)
食管癌(esophageal cancer,EC)是一类发生于食管上皮组织的消化道肿瘤,在所有恶性肿瘤中,EC的发病率为2%,它包括食管鳞癌(esophageal squamous cell carcinoma,ESCC)和食管腺癌(esophageal adenocarcinoma carcinoma,EADC)两种类型,ESCC的发病率高于EADC[1]。由于具有高浸润性和侵袭转移强的特点,ESCC的治疗效果差、引起患者不良预后[2]。因此,深入探究ESCC浸润转移机制有助于为该疾病的治疗提供新策略。促进恶性肿瘤细胞发生侵袭转移能力关键过程是上皮间质转化(epithelial-mesenchymal transition,EMT)的发生[3]。在EMT发生过程中,E盒结合锌指蛋白1(zinc finger E-box-binding protein 1,ZEB1)是关键的调控转录因子,在多种肿瘤中通过诱导EMT来促进肿瘤的浸润及侵袭转移。ZEB1属于E盒结合锌指蛋白家族,通过结合E-box启动子元件促进下游基因转录[3]。ZEB1高表达也常见于在转移性较高的上皮肿瘤细胞中[4]。此外,细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)、丝裂原活化蛋白激酶信号通路及其下游蛋白c-Myc也在EMT的发生过程中起着调控作用,从而促进肿瘤侵袭转移[3]。而在ESCC中,ZEB1的表达加快肿瘤进程并促进淋巴结转移[5],但ZEB1对ESCC侵袭转移的调控机制还少有研究。本研究通过基因敲除手段,考察ZEB1表达对ESCC侵袭转移能力的影响,并探讨ZEB1对侵袭转移和细胞增殖相关蛋白表达的影响。
1 材料与方法
1.1细胞株 ESCC细胞系EC9706购买于ATCC(American Type Culture Collection)。
1.2试剂及耗材 细胞总RNA提取和实时荧光定量聚合酶链反应(real-time quantitative PCR,RT-qPCR)实验中,总RNA利用RNA Isolater Total RNA Extraction Reagent试剂盒,反转录cDNA使用、HiScript Ⅱ 1st Strand cDNA Synthesis Kit试剂盒,RT-qPCR操作利用SYBR Green PCR Master Mix染料,RT-qPCR相关试剂均购买于南京诺唯赞生物科技有限公司。RT-qPCR引物购买于苏州金唯智生物科技有限公司,ZEB1 primers序列为,F:5′-GCCAATAAGCAAACGATTCTG-3′;R:TTTGGCTGGATCACTTTCAAG。shRNA阴性对照质粒及ZEB1 shRNA慢病毒质粒购买于德国默克公司,ZEB1 shRNA序列:5′-CCGGTGT-CTCCCATAAGTATCAATTCTCGAGAATTGA-TACTTATGGGAGACATTTTTG-3′,CCK8检测试剂盒购买于上海翊圣生物科技有限公司。WB抗体包括β-actin、ERK1/2、p-ERK1/2、N-cadherin和E-cadherin,购买于美国Cell Signaling Technology公司。细胞培养试剂包括DMEM无血清培养基、Gibco血清、胰酶,购买于美国GIBCO公司。免疫印迹法(Western blot,WB)所需试剂,RIPA Buffer和PierceTMBCA Protein Assay Kit购买于美国ThermoFisher公司;SDS-PAGE胶成分Tris 6.8,Tris 8.8,29:1聚丙烯酰胺溶液、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、TMED、过硫酸铵购买自上海生工生物工程股份有限公司;电泳所需电源、制胶架、电泳槽及转膜槽购买自美国伯乐Bio-rad公司。
1.3方法
1.3.1细胞培养 DMEM培养基(dulbecco′s minimum essential medium,DMEM)用超纯水溶解后,按比例加入一定量的碳酸氢钠,0.22 μm无菌滤膜过滤分装。使用时加入Gibco胎牛血清,120 mg/L链霉素和120 U/mL青霉素,配成含10%血清的DMEM培养基。EC9706细胞置于37 ℃含5% CO2的细胞培养孵箱中孵育增殖。待细胞密度达到80%~90%后胰酶消化并传代。
1.3.2RT-qPCR 细胞提取总RNA:转染shRNA阴性对照组的EC9706细胞和ZEB1 shRNA沉默后的EC9706细胞从细胞培养瓶中消化,收集离心后,用PBS洗涤2次。细胞沉淀中加入RNA Isolater Total RNA Extraction Reagent 0.5 mL,用枪头反复吹打,直至细胞团块完全消失;加入RNase Free dH2O 200 μL,上下颠倒混匀后,常温静置15 min,4 ℃下12 000 r/min离心15 min;避免接触管底沉淀,吸取400 μL上清转移至新离心管,加入400 μL异丙醇,反复震荡20 s,然后室温静置15 min,4 ℃下12 000 r/min离心15 min;保留管底白色团块,用移液器吸去上清,75%乙醇洗涤RNA沉淀2次,常温干燥。RNA定量:将乙醇挥发后的RNA用RNase Free dH2O溶解,利用分光光度计和Thermo ScientificTMNanoDropTMQC软件对总RNA浓度进行检测,并用RNase Free dH2O将每组RNA浓度调整为1 g/L。逆转录cDNA:按5×gDNA Eraser Buffer 2.0 μL,gDNA Eraser 1.0 μL,Total RNA 1 μL,RNase Free dH2O配方一次加入,至总体积10 μL。42 ℃孵育2 min后,于4 ℃冷却,再加入PrimeScript RT Enzyme Mix I 1.0 μL,5×PrimeScriptBuffer 2 4.0 μL,RNase Free dH2O和RT Primer Mix 1.0 μL至总体积20 μL,程序37 ℃运行15 min。85 ℃灭活15 s后终止反应。PCR反应体系如下配制:SYBR Green PCR Master Mix 5 μL,PCR Forward Primer 0.25 μL,PCR Reverse Primer 0.25 μL,cDNA溶液0.5 μL,RNase Free dH2O 4 μL。每个浓度至少测量3个复孔。ABI 7500型荧光定量PCR仪,设定PCR反应程序:Stage 1:预变性Reps:1,95 ℃ 30 s;Stage 2:PCR反应 Reps:50,95 ℃ 5 s;60 ℃ 30 s,进行实时定量PCR扩增。最后,对荧光实时定量PCR数据进行分析,获得结果。
1.3.3慢病毒shRNA转染 慢病毒ZEB1 shRNA转染:利用HIV病毒将自身基因组插入整合到宿主基因组的特性,让目的细胞稳定表达shRNA,实现沉默目的基因的作用。操作流程:在处于对数生长期的293T细胞内加入10 μg质粒和HIV病毒合成所需要的组分(10 μL Lentiviral Mix和60 μL HG TransgeneTM Reagent);培养24 h后病毒被293T细胞分泌到胞外,此时回收培养基上清(含病毒),用0.22 μm滤头过滤后,加入到需要被转染EC9706细胞培养基内;感染EC9706细胞48 h后,将培养基中加入嘌呤霉素进行真核细胞药物筛选,存活下来的即稳转成功的细胞。
1.3.4CCK8(Cell Counting Kit-8)实验 转染shRNA阴性对照组的ESCC细胞系EC9706和沉默了ZEB1表达的EC9706细胞消化后重悬,以100 μL/孔等量均匀地加入96孔板,两组细胞平行6个副孔。待细胞贴壁后,培养到密度为70%~80%后加入10 μL CCK8溶液,在37 ℃含5% CO2的细胞培养孵箱中培养1~4 h后,与450 nm波长下检测吸光度(optical density,OD)。计算后可得相对细胞活力水平。
1.3.5划痕实验 转染shRNA阴性对照组的ESCC细胞系EC9706及敲除ZEB1的EC9706细胞进行消化后,用1 mL培养体系均匀培养在6孔板中。待细胞贴壁生长并在密度达到80%后,用移液器枪头在孔内细胞上划痕,保证每条划痕线宽度均匀且平行。划线结束后,用灭菌后PBS轻轻洗涤6孔板,将划痕后漂浮的细胞去除,留下清晰可见的划痕线。对6孔板划痕的固定位置进行记录拍照。划痕0 h拍照记录细胞生长状态后,将六孔板放置回37 ℃细胞培养孵箱继续培养;24 h后再次记录细胞生长状态。
1.3.6Western blot 收集细胞:对数期生长的转染shRNA阴性对照组的EC9706及敲除ZEB1的EC9706细胞进行消化后,将细胞培养皿用PBS清洗2次后,合并细胞悬液和洗液,转移至塑料离心管,2 300 r/min转速下离心3 min,用移液器弃去上清液,细胞团块用1 mL PBS重悬后,转移到于1.5 mL离心管里,2 000 r/min离心5 min,将上清吸净。蛋白提取:尽可能用移液枪将PBS去除干净。将提前配好的蛋白裂解液按与细胞等体积的量加入1.5 mL Tube管,与细胞混合并轻轻打匀,置于冰上,裂解55 min,每隔10 min轻轻弹动EP管底部。裂解完毕后,用离心机以12 000 r/min离心30 min,将蛋白上清小心吸出并加入新的离心管中。BCA法用于测定样品蛋白含量,将蛋白用水调至同一浓度。然后在蛋白中加入1/3蛋白体积的loading buffer混匀。100 ℃水浴变性10 min后,放置于冰上冷却10 min,12 500 r/min离心1 min后准备上样。如果不立即使用,应将蛋白保存在-20 ℃冰箱中。制胶及电泳分离蛋白:制备SDS-聚丙烯酰胺凝胶电泳,60 V浓缩胶,140 V分离胶,运行1~1.5 h。全湿转膜:电泳后取下胶,按尺寸剪取滤纸及NC膜,并将它们浸泡在全湿转膜缓冲液中10 min。按海绵→滤纸→NC膜→胶→滤纸→海绵的顺序依次叠放整齐,除了膜不能用试管擀压外,每铺一层都用试管去除气泡。将夹板放入槽中,加入全湿缓冲液,恒流230 mA,转膜时间为2 h;转膜过程中,转膜装置放在冰盒中。丽染:将转膜后的NC膜浸泡在丽春红染液中,慢摇1 min后用dH2O震荡、清洗,根据Marker指示,剪下目标条带,标记,用PBS洗去丽春红。封闭:配制3% BSA封闭液,将条带封闭,37 ℃恒温摇床中孵育1 h。抗体孵育:用PBST将封闭后的条带荡洗一遍,用PBST配制一抗,将条带用一抗封袋,37 ℃恒温摇床孵育1 后4 ℃孵育过夜;一抗孵育结束后,PBST洗3次,10 min清洗一次。用PBST配制二抗,封袋,37 ℃恒温摇床反应1 h。曝光:二抗孵育结束后,用PBST清洗条带,清洗3次,每次10 min。用PBS浸泡条带后,配置ECL显色液,将条带漂洗10 s后采用Amersham Imager 600超灵敏多功能成像仪进行曝光成像。
1.4统计学方法 应用SPSS 13.0统计软件分析数据。计量资料比较采用成组设计的t检验、配对t检验。P<0.05为差异有统计学意义。
2 结 果
2.1ZEB1 shRNA敲除EC9706细胞中ZEB1表达 为了探究ZEB1蛋白表达是否对ESCC细胞系EC9706的增殖和侵袭转移有关,本研究首先构建了ZEB1敲除的EC9706细胞系。采用ZEB1 shRNA对EC9706细胞系进行慢病毒侵染,通过培养和筛选后获得ZEB1敲减后的稳转细胞株。通过RT-qPCR实验检测ZEB1 shRNA转染后EC9706细胞的ZEB1 mRNA转录水平。结果显示,与阴性对照组相比,ZEB1 shRNA显著降低了ZEB1 mRNA的表达水平(P<0.001)。见表1。
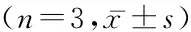
表1 ZEB1 shRNA抑制EC9706细胞ZEB1 mRNA表达Table 1 ZEB1 shRNA inhibited the expression of ZEB1 mRNA in EC9706 cells
2.2敲除ZEB1的EC9706细胞活力降低 为探究敲低ZEB1的EC9706细胞的增殖能力,利用CCK8实验考查细胞活力水平。与转染shRNA阴性对照组的细胞相比,敲低ZEB1的EC9706细胞的细胞活力明显降低(P<0.001),见表2。
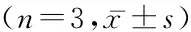
表2 ZEB1 shRNA抑制EC9706细胞活力水平Table 2 The cell viability of EC9706 cells was reduced by ZEB1 shRNA
2.3敲除ZEB1抑制EC9706细胞的侵袭转移能力 利用划痕实验考察ZEB1蛋白表达对ESCC细胞系EC9706细胞的侵袭转移能力的影响。转染shRNA阴性对照组细胞在划痕24 h后增殖迅速,愈合能力强,划痕宽度显著降低。而敲低了ZEB1表达的EC9706细胞,虽然也有一定程度的增殖和愈合,但划痕宽度明显大于对照组(P<0.05)。见表3。
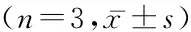
表3 ZEB1 shRNA抑制EC9706细胞侵袭转移表3 ZEB1 shRNA inhibited metastasis of EC9706 cells
2.4敲除ZEB1抑制ERK1/2激活并调节侵袭转移相关蛋白表达水平 针对EMT相关蛋白的表达进行研究,考察了ZEB1敲除后ERK1/2蛋白的表达和E-cadherin、N-cadherin的表达水平。结果显示(图1),对比转染shRNA阴性对照组细胞,转染了ZEB1 shRNA的细胞,ZEB1蛋白表达水平明显降低;敲减ZEB1后,细胞ERK1/2的激活水平被抑制;与EMT相关蛋白N-cadherin表达水平降低,E-cadherin表达水平增高。

图1 ZEB1 shRNA抑制ERK1/2激活并调节cadherin表达水平Figure 1 ZEB1 shRNA inhibited activation of ERK1/2 and regulated expression of cadherin protein levels
3 讨 论
食管癌是发生于食管上皮的恶性肿瘤[6]。目前,手术切除和新辅助化疗食管癌的主要治疗方法。应用于早期食管癌的治疗方案主要是手术切除,当肿瘤进展到中晚期,由于转移扩散的发生,手术治疗效果较差,需要配合化疗[7]。化疗和放疗是治疗食管癌的重要方法。而新辅助治疗,是一种联合化疗或放疗手段在食管癌术前的应用,其作用除了手术前降低食管癌肿瘤分期,使手术获得更好疗效以外,也应用于术后治疗,避免肿瘤向远处转移,从而减少局部复发[8]。但由于食管癌的高侵袭转移性,肿瘤转移和局部复发依旧是食管癌治疗的难点[9]。
恶性肿瘤细胞获得侵袭和迁移能力的关键是上皮间质转化(epithelial-mesenchymal transition,EMT),消除EMT从而抵抗肿瘤侵袭转移是肿瘤治疗的思路之一[10]。在人类恶性肿瘤中,有80%来源于上皮组织。通过EMT,原发性上皮组织肿瘤细胞可以形成间充质细胞,从而具备了迁移能力,进而向血管内侵袭,随着血液循环转移到人体内其他部位[11]。上皮肿瘤细胞最终通过EMT形成肿瘤转移灶,该过程极大地促进了肿瘤进展和恶性程度,增加了临床治疗难度[11]。目前研究表明,调控EMT的主要转录因子包括Twist、Snail和ZEB[12]。ZEB家族是E盒结合锌指蛋白(Zinc finger E-box binding homeobox),包含ZEB1和ZEB2两种类型[3]。在调控EMT发生中,ZEB1是关键的转录因子[3]。研究发现在多种肿瘤中,ZEB1可通过诱导EMT来促进上皮肿瘤细胞的侵袭转移[13-14]。ZEB1启动EMT的作用机制可能是ZEB1通过其锌指结构与E-cadherin的启动子区域结合、抑制E-cadherin表达来实现的。综上所述,ZEB1在上皮肿瘤EMT发生和侵袭转移过程中发挥着重要功能[13]。而其他和ZEB1相关的蛋白,如ERK、MAPK信号通路及其下游蛋白c-Myc,在EMT的发生中发挥着重要作用[15]。如在肺癌细胞中,EMT受到ERK和ZEB1通路的广泛调节[16]。而本文针对侵袭转移能力较强的ESCC细胞进行了研究,考察了ZEB1对癌细胞侵袭转移的影响及ERK的表达变化,发现敲低ZEB1表达后,能够显著抑制ESCC细胞系ES9706细胞的细胞活力、降低细胞的侵袭转移能力,并在蛋白水平抑制ERK1/2活性,促进E-cadherin表达和抑制N-cadherin表达。本研究结果显示ZEB1在ESCC细胞侵袭转移上发挥的关键作用,故而提示可以靶向ZEB1进行ESCC的治疗。目前直接靶向ZEB1的小分子抑制剂还鲜有研究,但最新的研究进展中,发现组蛋白去乙酰化酶(histone deacetylase,HDAC)抑制剂在针对肺癌的治疗上可以逆转EMT,使间充质细胞恢复为上皮细胞,这是通过HDAC抑制剂处理抗性细胞过程中可以抑制ZEB1功能而实现的[17]。除了直接抑制ZEB1活性外,ZEB1也受到上游因子PI3K、STAT3和SIRT等蛋白调控[14,18]。如PI3K抑制剂BENC-511,可以通过调控β-catenin-ZEB1通路来抑制非小细胞肺癌细胞侵袭转移[18]。所以也可以通过抑制ZEB1蛋白上游调控因子、干扰ZEB1信号环路,或是切断ZEB1下游控制元件来抑制ZEB1相关通路,从而起到抑制肿瘤细胞EMT和侵袭转移的作用。由于ESCC细胞具有的强侵袭转移性和难治性,故而靶向ZEB1从而达到抗ESCC具有一定研究价值和临床意义。而本研究将在后续的研究中,将致力探讨ERK1/2是否介导ZEB1对E-cadherin和N-cadherin的调控作用,通过过表达ERK1/2观察ZEB1敲除下EMT的变化,从而深入研究ZEB1在ESCC侵袭转移进展中发挥的关键作用,并寻找干扰ZEB1活性的小分子化合物及其抗肿瘤机制。

